文章信息
- 骨纤维结构不良的流行病学与临床分析
- Epidemiological and Clinical Characteristics of Fibrous Dysplasia of Bone
- 肿瘤防治研究, 2022, 49(5): 408-411
- Cancer Research on Prevention and Treatment, 2022, 49(5): 408-411
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2022.22.0231
- 收稿日期: 2022-03-10
- 修回日期: 2022-03-31
骨纤维结构不良是一种良性骨纤维性病变,最初由Lichtenstein在1938年描述[1],其特征是纤维骨组织代替正常骨组织。骨纤维结构不良的真实人群发生率和致残率很难估计,据报道,约占良性骨肿瘤的5%~7%[2]。骨纤维结构不良的病变发展是伴随着骨骼的发育和更替过程而进行的,不同的病例病程并不完全一致。有些病例可能会出现疼痛、跛行、疲劳骨折或骨折[3-5]。
由于缺乏骨纤维结构不良的流行病学和临床特点数据,其整体的诊断和治疗现状并不清楚。且暂无有关中国人群骨纤维结构不良的流行病学资料报道。本研究回顾了本中心30年来(1991—2020年)骨纤维结构不良住院患者的流行病学资料和临床资料,旨在揭示具有代表性的中国人群的流行病学和临床特征。
1 资料与方法 1.1 纳入与排除标准纳入标准:(1)1991年1月至2020年12月于我院骨与软组织肿瘤诊疗研究中心就诊的骨纤维结构不良患者;(2)影像学符合骨纤维结构不良诊断;(3)活检病理证实为骨纤维结构不良;(4)接受过手术治疗。
排除标准:(1)无病理诊断;(2)病理诊断不明确;(3)未接受过手术治疗。
1.2 研究指标通过查阅临床数据库、影像学资料,收集入选患者的以下数据:(1)患者流行病学特点:包括年龄、性别、部位;(2)肿瘤发病情况:单发或多发、就诊时伴随疼痛、是否发生病理骨折、外科治疗目的;(3)恶变情况:恶变部位、发生时间、恶变肿瘤亚型。
1.3 统计学方法所有数据均采用SPSS21.0软件包进行分析。对计量资料采用均值±标准差、最大值和最小值来表示,对计数资料采用率来表示。
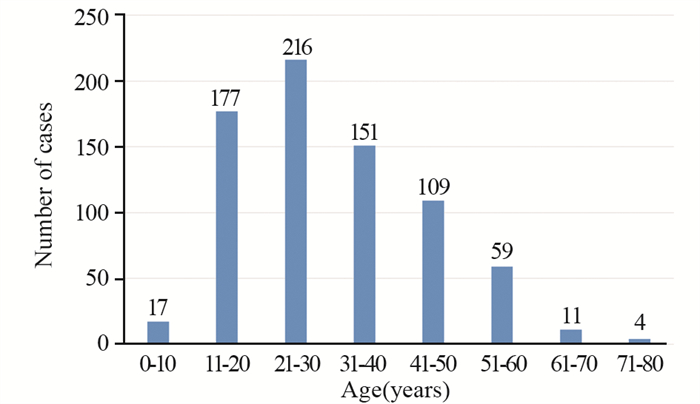
2 结果 2.1 患者年龄、性别、部位的流行病学特点1991年1月—2020年12月于我院骨与软组织肿瘤诊疗研究中心接受外科治疗的骨纤维结构不良患者共744例,其中男363例(48.8%)、女381例(51.2%),男女比例接近1:1。平均年龄31.1±13.5岁,最小5岁,最大74岁,见图 1,其中男性患者平均年龄(32.3±14.1)岁,最小5岁,最大74岁;女性患者平均年龄(29.9±12.9)岁,最小8岁,最大71岁。
|
| 图 1 744例骨纤维结构不良患者的年龄分布图 Figure 1 Age distribution of 744 patients with fibrous dysplasia |
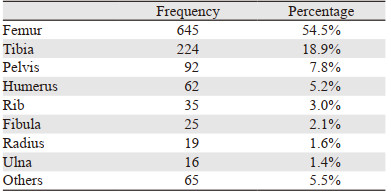
744例患者共有肿瘤部位1 183处,最常见的部位是下肢916处,其后分别是上肢106处,骨盆92处,肋骨36处,脊柱16处,肩胛带骨10处,颅面骨7处。下肢最常见的部位是股骨645处和胫骨224处,上肢最常见的部位是肱骨62处和桡骨19例,见表 1。
多发病例为189例(25.4%),单发病例为555例(74.6%)。就诊时伴随疼痛的患者有488例(65.6%),就诊时发生病理骨折的患者163例(13.8%)。外科治疗目的最多的是以原发肿瘤就诊的患者661例(88.8%),其次是以复发肿瘤就诊的患者45例(6.0%),以前次手术合并症就诊的患者有34例(4.6%)。
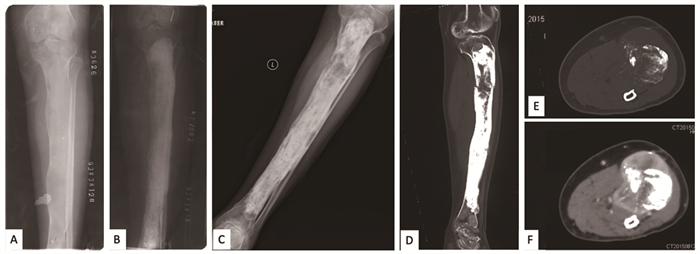
2.3 恶变情况发生恶变的患者有6例(0.8%),平均年龄40.5岁(32~47岁),从初次诊断骨纤维结构不良至诊断为恶性肿瘤的平均时间为7.7年(1.4~22年),3例恶变为骨肉瘤,2例未分化肉瘤,1例间叶性软骨肉瘤。其中1例患者情况,见图 2。
|
| The patient was a 25-year-old female with fibrous dysplasia. A: preoperative X-rays; B: postoperative X-rays; C: a pathological fracture of the upper segment of the left tibia 22 years after the operation; D: osteolytic lesions in the middle and upper segment of the tibia on CT; E: bone destruction and soft tissue mass in bone window; F: soft tissue enhancement window. The malignancy change was confirmed pathologically after biopsy. The pathological result was undifferentiated sarcoma. 图 2 一例发生恶变的骨纤维结构不良患者影像图 Figure 2 Radiographs of one patient with malignant transformation of fibrous dysplasia |
骨纤维结构不良是一种罕见的良性髓内骨肿瘤,组织学上表现为正常的松质骨被矿化不完全的骨质和纤维组织构成。该疾病是由于人胚胎期鸟嘌呤核苷酸结合蛋白(G蛋白)的α亚基(Gsα)基因突变而导致的,因此属于非遗传性疾病[6]。在临床上,50%~70%的骨纤维结构不良患者可以检测到GNAS突变。骨纤维结构不良可分为单骨型、多骨型及McCune-Albright综合征[7-8]。其中McCune-Albright综合征除了骨纤维结构不良,还合并内分泌系统疾病和牛奶咖啡斑,其中内分泌系统疾病可包括性早熟、甲状旁腺功能亢进和生长激素过多[7]。
由于现有的肿瘤登记系统都针对恶性肿瘤,因此基于人群的疾病发生率无法估计。根据文献报道,其年发生率大约为1/30 000,远高于最常见的原发恶性骨肿瘤-骨肉瘤(2~3/1 000 000)[9]。本研究纳入的患者都是接受外科治疗的患者,没有纳入门诊就诊但无手术指征的患者。由于存在选择偏倚,无法通过与其他恶性肿瘤的比例来推算骨纤维结构不良的人群发生率。但据作者检索,文献尚没有超过500例的骨纤维结构不良病例流行病学数据[9-10],本研究可在一定程度上填补该领域的空白。
由于骨纤维结构不良是胚胎期发生的疾病,患者在出生时即可诊断为骨纤维结构不良。在一项研究中[9],患者初次出现症状的年龄平均在18岁(0~62),初次获得诊断的年龄为23岁(0~77),提示大多数患者是在骨成熟以后才出现症状。本研究显示患者就诊时的平均年龄为31岁,就诊的高峰年龄段在10~40岁,进一步揭示该疾病主要在骨骼成熟和骨更新需要更高骨强度期间才出现需要外科干预的情况。在国外的报道中[9, 11],骨纤维结构不良往往表现为显著的女性易发,男女比例大约为1:2,但在本研究中,男女比例大约为1:1,提示不同人种可能存在性别差异。
据文献报道[10, 12-16],骨纤维结构不良最常见的部位是股骨(50%),其次是颅面骨和骨盆。本研究中,股骨占54.5%,与文献报道一致。但由于本研究中心不接诊以颅面骨为首发症状的患者,因此颅面骨患者比例仅为0.6%,存在选择偏倚。本研究显示下肢病变916处,占77.4%,提示需要外科干预的患者主要集中在下肢,这是由于下肢比全身其他骨骼更需要足够的骨强度有关。这也从侧面提醒临床医生,对于骨纤维结构不良患者,推荐进行全身骨扫描筛查,用于了解全身的骨科状况,再根据骨扫描结果来进行X线和CT检查,评估局部骨强度状况。同时,并不是所有的骨纤维结构不良病变都需要外科干预[12, 17-21]。对骨纤维结构不良流行病学数据的全面认识,可能有助于临床对该类疾病的早期发现、准确诊断和正确处理。
本研究提示骨纤维瘤结构不良患者的临床表现,以单发病例最多,这与大多数报道一致[9-10, 22]。在本研究的队列中,没有McCune-Albright综合征,可能与本研究的选择偏倚有关,本研究仅纳入了接受外科治疗的患者数据,很多门诊就诊但没有手术指征的患者并没有纳入本研究。在既往的研究中,因为疼痛首诊的患者比例在44%~65%[10-11, 23-24],本研究为65.6%,其他首诊原因包括跛行、畸形、功能障碍等。由于骨纤维结构不良引起的骨强度不足,163例合并病理骨折,占13.8%,与文献报道类似。由于病理骨折的发生往往给患者生活质量造成很大影响,因此,对于病变骨强度的评估非常重要,既要避免发生病理骨折,也要避免过度治疗。在临床上,并不是所有的病理骨折都需要立即外科干预,有些病例需要进行牵引或者外固定,待骨愈合后再进行外科干预,也有些患者骨愈合后仍然不需要接受外科干预。
本组患者中,以原发肿瘤就诊的患者占88.8%,而因为肿瘤复发或并发症患者的病例为少数。需要指出的是,不同于一般恶性肿瘤的外科治疗原则(彻底去除肿瘤),骨纤维瘤结构不良的外科干预以解决患者主诉为主要目的,因此其治疗主要集中在改善骨强度、纠正畸形、恢复正常的运动系统功能[14, 18, 20, 24-25]。所以即使是复发肿瘤患者,其目的也不是为了去除肿瘤,而是解决骨强度等问题。
临床上,良性肿瘤如骨巨细胞瘤、多发骨软骨瘤等发生恶变的情况时有发生,骨纤维结构不良恶变的发生率在0.4%~6.7%[26-27],但一般认为真实恶变率低于1%,本研究中恶变率为0.8%,与文献报道基本一致。在之前报道中,恶变时患者的平均年龄为46岁[27],本组患者平均年龄为40.5岁,提示发生恶变的患者年龄要高于骨纤维结构不良患者。
综上所述,骨纤维结构不良在中国人群中具有明显的流行病学和临床特征。未来需要进一步以地区为中心,建立肿瘤登记制度,纳入来诊的各种良恶性肿瘤(包括门诊和住院患者),以建立我国骨肿瘤的人群发病数据,为疾病诊断与治疗、国家医保相关政策的制定提供依据。
作者贡献:
徐海荣:采集临床数据、图像及撰写文章
李远:临床数据分析、修改文章
单华超、鱼锋:修改文章
牛晓辉:文章总体构思及修改文章
| [1] |
Lichtenstein L. Polyostotic fibrous dysplasia[J]. Arc Surg, 1938, 36(5): 874-898. DOI:10.1001/archsurg.1938.01190230153012 |
| [2] |
Campanacci M. Bone and Soft Tissue Tumors: Clinical Features, Imaging, Pathology and Treatment[J]. Bone Joint Surg, 1999, 435-461. |
| [3] |
Kancherla NR, Eppakayala S, Nagesh C, et al. Functional outcome in surgical fixation of fibrous dysplasia of proximal femur[J]. Int J Res Orthop, 2022, 8(2): 138-142. DOI:10.18203/issn.2455-4510.IntJResOrthop20220598 |
| [4] |
Gorgolini G, Caterini A, Nicotra L, et al. Surgical treatment of femoral deformities in polyostotic fibrous dysplasia and McCune-Albright syndrome: A literature review[J]. World J Orthop, 2022, 13(3): 329-338. DOI:10.5312/wjo.v13.i3.329 |
| [5] |
Vyas A, Godara A, Kumar N, et al. Fibrous Dysplasia of Proximal Femur: A Case Report of Treatment With Single-Stage Valgus Osteotomy With Dynamic Hip Screw and Fibular Strut Graft[J]. Cureus, 2022, 14(1): e21496. |
| [6] |
Marie PJ, Pollak C de, Chanson P, et al. Increased proliferation of osteoblastic cells expressing the activating Gs alpha mutation in monostotic and polyostotic fibrous dysplasia[J]. Am J Pathol, 1997, 150(3): 1059-1069. |
| [7] |
Geels RES, Meier ME, Saikali A, et al. Long Bone Fractures in Fibrous Dysplasia/McCune-Albright Syndrome: Prevalence, Natural History, and Risk Factors[J]. J Bone Miner Res, 2022, 37(2): 236-243. DOI:10.1002/jbmr.4463 |
| [8] |
Diyora B, Dey S, Dubey A, et al. Cranial fibrous dysplasia: An institutional experience and review of the literature[J]. Surg Neurol Int, 2022, 13: 66. DOI:10.25259/SNI_1218_2021 |
| [9] |
Benhamou J, Gensburger D, Messiaen C, et al. Prognostic Factors From an Epidemiologic Evaluation of Fibrous Dysplasia of Bone in a Modern Cohort: The FRANCEDYS Study[J]. J Bone Miner Res, 2016, 31(12): 2167-2172. DOI:10.1002/jbmr.2894 |
| [10] |
Cheng J, Wang Y, Yu H, et al. An epidemiological and clinical analysis of craniomaxillofacial fibrous dysplasia in a Chinese population[J]. Orphanet J Rare Dis, 2012, 7: 80. DOI:10.1186/1750-1172-7-80 |
| [11] |
MacDonald-Jankowski D. Fibrous dysplasia: a systematic review[J]. Dentomaxillofac Radiol, 2009, 38(4): 196-215. DOI:10.1259/dmfr/16645318 |
| [12] |
Leet AI, Boyce AM, Ibrahim KA, et al. Bone-Grafting in Polyostotic Fibrous Dysplasia[J]. J Bone Joint Surg Am, 2016, 98(3): 211-219. DOI:10.2106/JBJS.O.00547 |
| [13] |
Majoor BCJ, Papapoulos SE, Dijkstra PD, et al. Denosumab in Patients With Fibrous Dysplasia Previously Treated With Bisphosphonates[J]. J Clin Endocrinol Metab, 2019, 104(12): 6069-6078. DOI:10.1210/jc.2018-02543 |
| [14] |
Boyce AM, Chong WH, Yao J, et al. Denosumab treatment for fibrous dysplasia[J]. J Bone Miner Res, 2012, 27(7): 1462-1470. DOI:10.1002/jbmr.1603 |
| [15] |
MM B, Shahidul I, Tanvir A. Tibial fibrous dysplasia in children treated by Ilizarov Technique-A review of treatment options[J]. MOJ Orthopedics Rheumatol, 2021, 13(2): 26-29. DOI:10.15406/mojor.2021.13.00542 |
| [16] |
Florez H, Peris P, Guañabens N. Fibrous dysplasia. Clinical review and therapeutic management[J]. Med Clin (Barc), 2016, 147(12): 547-553. DOI:10.1016/j.medcli.2016.07.030 |
| [17] |
Li W, Huang X, Ye Z, et al. Valgus osteotomy in combination with dynamic hip screw fixation for fibrous dysplasia with shepherd' s crook deformity[J]. Arch Orthop Trauma Surg, 2013, 133(2): 147-152. DOI:10.1007/s00402-012-1633-1 |
| [18] |
Yang L, Jing Y, Hong D, et al. Valgus osteotomy combined with intramedullary nail for Shepherd's crook deformity in fibrous dysplasia: 14 femurs with a minimum of 4 years follow-up[J]. Arch Orthop Trauma Surg, 2010, 130(4): 497-502. DOI:10.1007/s00402-009-0943-4 |
| [19] |
Breck LW. Treatment of Fibrous Dysplasia of Bone by Total Femoral Plating and Hip Nailing A Case Report[J]. Clin Orthop Relat Res, 1972, 82: 82-83. |
| [20] |
Connolly JF. Shepherd's Crook Deformities of Polyostotic Fibrous Dysplasia Treated by Osteotomy and Zickel Nail Fixation[J]. Clin Orthop Relat Res, 1977, 123: 22-24. |
| [21] |
DiMeglio LA. Bisphosphonate therapy for fibrous dysplasia[J]. Pediatr Endocrinol Rev, 2007, 4(Suppl): 440-445. |
| [22] |
DiCaprio MR, Enneking WF. Fibrous Dysplasia. Pathophysiology, evaluation, and treatment[J]. J Bone Joint Surg, 2005, 87(8): 1848-1864. |
| [23] |
Benhamou J, Gensburger D, Chapurlat R. Transient improvement of severe pain from fibrous dysplasia of bone with denosumab treatment[J]. Joint Bone Spine, 2014, 81(6): 549-550. DOI:10.1016/j.jbspin.2014.04.013 |
| [24] |
Hampton MJ, Weston-Simmons S, Giles SN, et al. Deformity Correction, Surgical Stabilisation and Limb Length Equalisation in Patients with Fibrous Dysplasia: A 20-year Experience[J]. Strategies Trauma Limb Reconstr, 2021, 16(1): 41-45. DOI:10.5005/jp-journals-10080-1523 |
| [25] |
Chen WJ, Chen WM, Chiang CC, et al. Shepherd's Crook Deformity of Polyostotic Fibrous Dysplasia Treated with Corrective Osteotomy and Dynamic Hip Screw[J]. J Chin Med Assoc, 2005, 68(7): 343-346. DOI:10.1016/S1726-4901(09)70173-X |
| [26] |
Yabut Jr SM, Kenan S, Sissons HA, et al. Malignant transformation of fibrous dysplasia. A case report and review of the literature[J]. Clin Orthop Relat Res, 1988, 228: 281-289. |
| [27] |
Ruggieri P, Sim FH, Bond JR, et al. Malignancies in fibrous dysplasia[J]. Cancer, 1994, 73(5): 1411-1424. DOI:10.1002/1097-0142(19940301)73:5<1411::AID-CNCR2820730516>3.0.CO;2-T |
 2022, Vol. 49
2022, Vol. 49