文章信息
- TM9SF3在肺腺癌中的表达和临床意义
- Expression and Clinical Significance of TM9SF3 in Lung Adenocarcinoma
- 肿瘤防治研究, 2022, 49(11): 1146-1152
- Cancer Research on Prevention and Treatment, 2022, 49(11): 1146-1152
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2022.22.0212
- 收稿日期: 2022-03-07
- 修回日期: 2022-08-01
2. 210006 南京,南京医科大学附属南京医院(南京市第一医院)肿瘤内科
2. Department of Oncology, Nanjing First Hospital, Nanjing Medical University, Nanjing 210006, China
肺癌是世界范围内最常见的一种原发性恶性肿瘤,也是死亡率最高的癌种[1]。小细胞肺癌(small cell lung cancer, SCLC)和非小细胞肺癌(non-small cell lung cancer, NSCLC)是其主要的病理类型,而肺腺癌(lung adenocarcinoma, LUAD)是NSCLC中最常见的类型。近年来,免疫治疗可以有效地提高LUAD患者的生存时间[2]。免疫疗法通过控制肿瘤微环境(tumor microenvironment,TME)内外的免疫细胞来识别和杀死癌细胞[3]。然而,现有的免疫疗法仍存在一定的局限性(如敏感度低和特异度不高等),有效率仅在25%左右,亟需探寻更多的新靶点。
跨膜蛋白9超家族(TM9SF)的结构是由一个大的N端胞外结构域和9个假定的跨膜结构域组成,该家族蛋白在进化上非常保守[4],在哺乳动物中有四个成员(TM9SF1-TM9SF4)[5]。现有研究发现TM9SF在免疫细胞的黏附和吞噬调控中起重要作用[6]。例如,TM9SF3蛋白能够促进T细胞性白血病细胞增殖和侵袭[7]。然而,TM9SF3在肺腺癌患者中的表达情况及其对免疫微环境的影响目前尚未见报道。因此,本研究通过纳入癌症基因组图谱(The Cancer Genome Atlas, TCGA)中肺癌患者临床数据和测序数据,分析TM9SF的表达及其预后价值。经多个数据库分析,进一步确定TM9SF3的表达对免疫微环境的影响,旨在发现肺腺癌新的预后生物标志物,为患者的免疫治疗提供更多的选择靶点。
1 资料与方法 1.1 研究对象收集南通大学附属南通第三医院2021年6月—2021年11月经病理确诊的肺腺癌患者组织9例(肺癌组),所有患者均为初次诊断,其中男5例、女4例,年龄45~81岁。同时收集距离癌组织5 cm以上的正常肺组织6例作为正常对照组(NT组)。纳入标准:(1)已通过组织病理学确诊为LUAD的患者;(2)患者在就诊前未接受任何与肺癌相关的手术治疗、放射治疗或化学治疗等其他手段的综合治疗;(3)患者年龄≥18岁。排除标准:(1)患者合并有系统的恶性肿瘤;(2)患者既往已经进行过相关抗肿瘤治疗;(3)临床资料不完整;(4)患者基础状况差。其中,6例患者的样本用于提取RNA做qRT-PCR实验,3例患者的样本用于提取蛋白做免疫印迹实验。本研究遵循《赫尔辛基宣言》原则,并经过了南通大学附属南通第三医院伦理委员会的审阅和批准,所有参与者均签署书面知情同意书。
1.2 公共数据收集和预处理收集来自TCGA数据库中497例LUAD患者和54例癌旁对照组织样本的基因表达谱数据,对所有数据进行归一化处理去除丢失和重复的结果,排除年龄、性别、总生存(OS)时间、TNM分期和远处淋巴结转移数据缺失或不足的样本。GEPIA数据库(http://GEPIA.cancerpku.cn/index)整合了来自TCGA和GTEx的33种恶性肿瘤9 736例肿瘤样本和8 587例正常样本中的RNA测序表达数据[8],用于分析TM9SF3表达与LUAD患者的临床病理特征之间的相关性。人类蛋白质图谱数据库(HPA)(www.proteinatlas.org)汇总人体组织中免疫组织化学图谱,用于分析LUAD患者正常肺组织和癌组织中TM9SF3的表达和分布情况[9],及其对LUAD患者预后的影响。
1.3 实验试剂兔抗人TM9SF3抗体购自美国Abcam公司,兔来源内参一抗抗体GAPDH和辣根过氧化物酶(HRP)标记的山羊抗兔IgG抗体购自中国爱博泰克公司,ECL超敏化学发光液购自中国诺唯赞公司。TRIzol试剂和反转录试剂盒购自美国赛默飞公司,SYBN Green Master Mix购自美国ABI公司,引物设计由中国锐博公司进行设计。
1.4 基因集合富集分析在从TCGA数据库中获得的TM9SF3低表达和高表达相关基因的数据集中进行基因集合富集分析(gene set enrichment analysis, GSEA),分析从TCGA数据库中获得的归一化RNA测序数据。首先,GSEA是针对两组样本中测序的所有基因进行富集分析,在其输入的基因表达矩阵中,样本被分成A和B两组,通过对所有基因排序来表示基因在两组间表达量的变化趋势。我们根据标准化富集评分(normalized enrichment score, NES)选择最丰富的信号通路,并分别以GO富集KEGG通路的形式进行展示,以探索TM9SF3的潜在生物学功能。
1.5 免疫浸润分析使用TIMER数据库中的生存模块探索LUAD生存结果与免疫细胞表达量之间的关系。此外,采用体细胞拷贝数变化(somatic copy number alteration, SCNA)模块研究TM9SF3细胞SCNA与6种免疫细胞表达的相关性。同时,通过CIBERSORT算法和TIMER数据库进行免疫浸润分析,展示LUAD中免疫微环境的标志物表达变化,计算LUAD样本中22种免疫细胞的表达变化。通过R软件vioplot软件包显示22个高、低TM9SF3样本中免疫细胞的比例差异。
1.6 免疫印迹实验检测蛋白表达将收集的3例患者组织样本置于冰上,PBS清洗后,加入200 μl蛋白裂解液(CM/RIPA比值为1/100)置冰上研磨;提取蛋白上清液后,采用BCA试剂盒检测蛋白上样量;凝胶电泳(80 V转120 V)分离蛋白;湿转法转膜(250 mA,2 h),随后将PVDF膜用封闭液室温封闭2 h;根据抗体说明书配置一抗稀释液(TM9SF3, 1:1 000;GAPDH,1:6 000),并置于4℃冰箱进行孵育过夜。次日,用TBST缓冲液漂洗后,加入辣根过氧化物酶标记的山羊抗兔(二抗,1:10 000),室温孵育2 h。最后加入显影剂进行曝光显影。以GAPDH为内参计算目的蛋白表达的灰度值。
1.7 qRT-PCR实验根据TRIzol试剂盒的步骤提取6例患者组织的总RNA。qRT-PCR反应体系为10 μl(包括5 μl SYBR Green Master Mix,1 μl引物,1 μl cDNA和3 μl的无RNA酶水),反应条件:UDG酶50℃培养120 s;95℃预变性120 s;95℃变性15 s,40个循环;60℃退火15 s;72℃延伸60 s。同时,以GAPDH作为内参,比较各组中mRNA和相应内参的Ct值,用2-△△Ct分析表达情况,实验均重复3次。TM9SF3引物:上游引物为5'-TGCCAGCCACTTACTGTGAAA-3',下游引物为5'-GCCTCACCAACAATACCCCATA-3'。GAPDH引物:上游引物为5'-TGAAGGTCGGAGTCAACGGATTTGGT-3',下游引物为5'-CATGTGGGCCATGAGGTCCACCAC-3'。
1.8 统计学方法使用R(v. 3.6.2)的“生存”包处理从TCGA-LUAD下载的生存信息,并通过Kolmogorov Smirnov检验评估临床病理特征与TM9SF家族分子表达之间的关系。通过使用未配对的Student's t检验比较LUAD患者癌组织和癌旁样品中的TM9SF3表达。根据TM9SF3基因mRNA表达中位数将LUAD患者分为高表达组和低表达组。采用Kaplan Meier法分析TM9SF3表达与临床预后之间的相关性。Cox回归模型Log rank检验检验TM9SF3高表达组和低表达组LUAD患者的OS是否存在差异,并计算风险比(hazard ratio, HR)。P < 0.05(双侧)为差异有统计学意义,检验水准α=0.05。上述数据资料符合正态分布(Shapiro-Wilk检验P≥0.05),且方差齐性(Levene's检验P≥0.05)数据,多组数据比较采用单因素方差分析,两组数据比较采用两样本t检验。
2 结果 2.1 TM9SF3在LUAD和泛癌中的表达及其预后分析结果显示,与NT组相比TM9SF3在LUAD中表达升高,差异有统计学意义(P < 0.05),见图 1B。Kaplan-Meier Plotter分析发现,TM9SF3高表达的患者总生存率显著低于低表达患者(P=0.003),见图 1C。上述结果表明,高表达的TM9SF3导致LUAD患者的预后更差。当TM9SF3表达增多时,LUAD患者的HR值变高,表明高表达的TM9SF3是肺腺癌患者的独立危险因素,起促癌的作用;同时,肿瘤的临床分期也具有较高的危险因素,见图 1A。LUAD患者逻辑回归分析证实,肿瘤分期越高,患者风险越高(表格略,请扫描本文OSID二维码)。
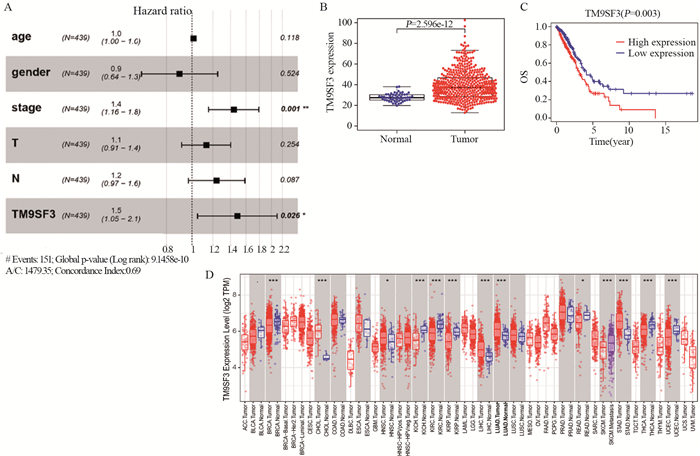
|
| A: The multi-factor Cox regression analysis of the clinical characteristics of TM9SF3 and LUAD patients; B: The expression of TM9SF3 in LUAD patients; C: The OS of TM9SF3 in LUAD patients; D: The expression of TM9SF3 in pan-carcinoma; *: P < 0.05; **: P < 0.01; ***: P < 0.001. 图 1 TM9SF3在LUAD和泛癌中的表达及其预后分析 Figure 1 Expression of TM9SF3 in LUAD and pan-carcinoma and its prognostic analysis |
此外,我们发现TM9SF3在肝细胞癌(LIHC)、胃腺癌(STAD)、肺腺癌和胆管癌(CHOL)中呈现高表达;而在乳腺癌(BRCA)、肾嫌色细胞(KICH)、肾透明细胞癌(KIRC)、肾乳头状细胞癌(KIRP)、甲状腺癌(THCA)和子宫内膜癌(UCEC)中呈低表达的趋势,见图 1D。
2.2 高表达的TM9SF3与临床病理特征和预后的相关性结果显示,在年龄 < 60岁、女性、临床分期Ⅰ+Ⅱ和T分期早的患者中,TM9SF3的表达明显偏低(P < 0.05);而在有无淋巴结转移(N0~N3)和有无远处转移(M0和M1)的LUAD患者分组中,TM9SF3的表达在两组中差异无统计学意义(P=0.291, P=0.213)。随着LUAD患者临床病理分期的增加,TM9SF3基因显著上调(P=0.0471)。TM9SF3高表达的患者总体生存率低,相对风险度也较高,差异均具有统计学意义(P=0.0064, P=0.0034)(图片请扫描本文OSID码)。
2.3 验证TM9SF3在LUAD患者的癌与癌旁正常组织中的表达LUAD患者TM9SF3的蛋白和mRNA水平表达在肿瘤组织中明显增加,差异有统计学意义(P=9.90E-09),见图 2A~B;此外,患者的年龄和性别差异无统计学意义(t=0.488, P=0.638)。LUAD组织样本中TM9SF3蛋白免疫组织化学染色较深,表明TM9SF3的蛋白表达在LUAD样本中较高,见图 2C。
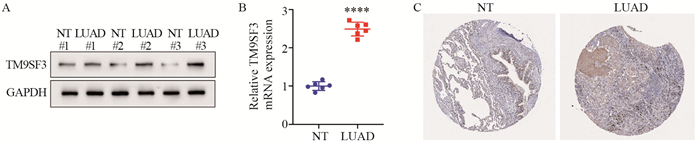
|
| A: Western blot assay detected that TM9SF3 protein expression was significantly up-regulated in three LUAD patients; B: qPCR showed that the mRNA level of TM9SF3 in LUAD patients was significantly increased, and the difference was statistically significant. C: HPA immunohistochemical analysis of TM9SF3 protein expression in LUAD patients (HPA database). ****: P < 0.0001. 图 2 TM9SF3在LUAD患者中的的表达和分布 Figure 2 Expression and distribution of TM9SF3 in LUAD patients |
GSEA分析显示,GO注释揭示了与TM9SF3的表达呈正相关的5个主要的蛋白生物学功能:T细胞介导的细胞毒性、巨噬细胞迁移、巨噬细胞趋化作用、白三烯生物合成过程、抗原刺激引起的急性炎性反应。此外,还发现了5个负相关的主要的蛋白生物学功能:磷脂酰肌醇结合、蛋白质靶向液泡、调节细胞极性的建立或维持、靶向囊泡、蛋白质脱甘露糖基化。KEGG通路富集分析显示与TM9SF3表达正相关最强的5条信号通路:氧化磷酸化、产生IGA的肠道免疫网络、自身免疫性甲状腺疾病、造血、抗原加工和呈递。负相关最强的5个通路是:黏附连接、WNT信号通路、TGFβ信号通路、泛素介导的蛋白水解、磷酸肌醇代谢(图片请扫描本文OSID码)。上述结果发现TM9SF3表达的变化能够参与调控免疫细胞相关的信号通路。
2.5 TM9SF3的异常表达对LUAD组织免疫微环境的影响为了明确TM9SF3是否与细胞内部的免疫相关的信号通路有关联,本研究利用TIMER数据库验证TM9SF3与LUAD患者B细胞、CD8+T细胞、巨噬细胞、中性粒细胞的表达具有相关性,见图 3A;同时,B细胞和DC细胞免疫浸润的比例变化会影响LUAD患者的预后,提示TM9SF3调控的免疫过程可能影响LUAD患者的预后,见图 3B。此外,TM9SF3的拷贝数变异与B细胞、CD4+T细胞和DC免疫细胞浸润之间的关联主要由臂级增益(arm-level gain)来驱动,也显示出TM9SF3对LUAD免疫微环境的影响,见图 3C。以上表明TM9SF3通过调节免疫细胞浸润比例的变化影响LUAD患者的预后。
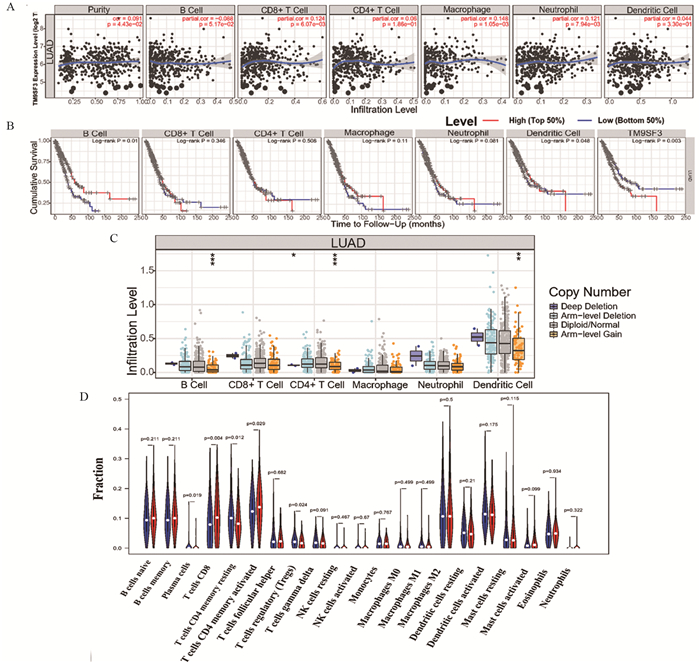
|
| A: The correlation analysis between six types of TIICs and TM9SF3; B: Expressions of six types of TIICs and prognosis in patients with LUAD; C: The correlation between infiltration levels of six types of TIICs and copy number of TM9SF3; D: The ratio of 22 immune cells in LUAD tissues in different TM9SF3 expression groups. Red represents high expression, and blue reprsents low expression. 图 3 差异表达的TM9SF3与免疫细胞浸润的相关性分析 Figure 3 Correlation analysis between differentially-expressed TM9SF3 and immune cells in LUAD tissues |
除此之外,我们还对下载的LUAD患者数据中TM9SF3高/低表达后的22种免疫细胞的表达丰度进行展示,结果显示,当TM9SF3表达增加时,会导致CD8+T细胞(P=0.004)和CD4记忆激活T细胞(P=0.012)相关标志物的表达升高;而在TM9SF3低表达组中,浆细胞(P < 0.019)、CD4记忆静息T细胞(P=0.029)和调节性T细胞(Tregs)(P=0.024)的比例更高,见图 3D。我们还利用TIMER中的“共表达”模块分析揭示了TM9SF3的表达改变对免疫细胞表面标志物的表达影响(表格略,请扫描本文OSID二维码)。
综上所述,TM9SF3不仅能够影响B细胞、中性粒细胞、巨噬细胞、树突细胞和T细胞等免疫细胞的浸润水平,而且与各种免疫细胞表面标志物表达之间的相关性都表明TM9SF3作为免疫治疗的新靶点的潜力和价值。
3 讨论近年来,免疫治疗使肺癌的治疗进入了全新的时代,为肺癌患者迎来了曙光。研究显示,随着免疫检查点抑制剂(immune checkpoint inhibitors, ICIs)的广泛应用,ICIs联合化疗给手术切除的早期非小细胞肺癌患者增加了更多痊愈的机会[10-11];对于晚期NSCLC患者,免疫治疗也能将其5年总体生存率由5%提升至15.5%~23.2%,特别对于程序性死亡受体配体1(programmed cell death ligand 1, PD-L1)高表达的晚期NSCLC患者,多项临床试验研究显示,ICIs单药疗效明显效优于单纯化疗[12-16]。与此同时,发现在采取免疫治疗为一线治疗方案的患者中,7%~27%的患者出现原发耐药,以及约25%的患者会出现继发性耐药现象[17-18]。所以,耐药成为当下免疫治疗持续发展的一大难关。目前,针对耐药主要考虑两个因素:首先,体内免疫调节系统的机制复杂;其次,预测发生率的生物标志物研究不足。所以,明确耐药机制、筛选更多的生物学标志物是当前精准医疗时代背景下亟待解决的问题。本研究主要探究TM9SF3在肺腺癌中的表达和预后意义,同时探讨了TM9SF3对免疫浸润的影响。
本研究首先利用TCGA数据库,发现TM9SF3的表达在LUAD中显著升高。随后将该家族分子的表达与肺癌患者进行生存分析研究,结果表明TM9SF3分子在肺腺癌患者中低表达时,患者生存率明显提高。为了进一步探究和佐证TM9SF家族分子与肺腺癌预后和临床病理特征之间的关系,我们采用多因素Cox回归分析和逻辑回归分析,发现只有TM9SF3与LUAD的预后临床指标显著相关。上述结果初步证明TM9SF3是一种新的促癌基因。我们也从TCGA数据库中筛选了TM9SF3在泛癌中的表达,发现TM9SF3在多种癌症患者样本中高表达,其中包括肝细胞癌、LUAD胃腺癌和胆管癌。此外,我们也利用公认的GEPIA肿瘤数据库验证了TM9SF3的表达高低不仅与LUAD患者的总生存期差异有关,还与患者的年龄、性别、分化程度和肿瘤分期相关,并且在临床LUAD患者样本和人类蛋白组学图谱中验证了TM9SF3在肺腺癌组织中的高表达。目前,有学者研究发现TM9SF3不仅在胃癌组织中上调,而且与胃癌患者的预后不良显著相关[19];也有研究证实TM9SF3与乳腺癌中的紫杉醇耐药有关[20]。而在T细胞白血病中,有学者通过一系列研究证实,表达上调的TM9SF3能够调节细胞的增殖和侵袭能力[7]。最新研究显示,TM9SF3的下调能够明显抑制三阴性乳腺癌相关细胞和岩藻糖苷酶αL1所诱导的细胞增殖和迁移能力[21]。上述研究表明,TM9SF3在癌症发生中发挥重要作用,然而,其在调控肺腺癌发生中的功能机制仍是未知领域。
本研究通过GSEA分析发现免疫相关通路与TM9SF3表达的相关性最强,其中包括TM9SF3与T细胞介导的细胞毒性、巨噬细胞迁移、巨噬细胞趋化性和抗原加工呈递作用显著正相关。肿瘤相关巨噬细胞是肿瘤微环境中的主要参与者[22]。研究人员发现了M2型肿瘤相关巨噬细胞的募集最终促进NSCLC生长[23]。说明TM9SF3与免疫细胞的调控以及与肺癌发生发展相关的通路有关,揭示其在肿瘤免疫治疗中的潜在研究价值。
利用TIMER数据库,本研究探索了TM9SF3对免疫微环境的影响,分析发现TM9SF3的表达增高与LUAD患者体内的6种免疫效应细胞的标志物异常低表达显著相关,同时免疫效应细胞(如B细胞和DC细胞)表达的增加和TM9SF3表达的降低,会增加肺腺癌患者的生存时间。有研究发现,在对LUAD患者进行免疫治疗时,应考虑肿瘤微环境中的驱动突变与B细胞反应之间的联系[24]。B细胞是目前研究中唯一有争议的免疫细胞类型。一方面,它们可以产生与CTL活性相协调的细胞因子,并充当有效的抗原呈递细胞(APC),但另一方面,它们可能通过产生细胞因子来招募髓源性抑制细胞而促进肿瘤发生[25-26]。有研究表明,肿瘤内B细胞的主要作用模式包括将B细胞受体(BCR)同源抗原呈递给CD4+和潜在的CD8+T细胞[27]。树突状细胞属于肿瘤拮抗免疫细胞的一种,功能主要是作为特化APC[28]。这也可以解释为什么抗原加工呈递通路存在于TM9SF3富集KEGG途径中。此外,我们发现LUAD中TM9SF3的不同突变形式与B细胞、CD8+T细胞、CD4+T细胞和DC的免疫浸润有关。最后,本研究在表达不同的TM9SF3患者样本中,探讨22种免疫细胞的表达变化,与TM9SF3表达变化显著相关的免疫细胞有浆细胞、CD8+T细胞、CD4+记忆活化T细胞、CD4记忆静息T细胞和调节性T细胞。上述结果表明,TM9SF3分子能够通过影响LUAD中的免疫细胞的表达参与调节肺腺癌患者的免疫微环境。
总之,我们证明了TM9SF3在LUAD样本中上调,其过表达与LUAD患者的不良临床病理特征和不良预后高度相关。此外,TM9SF3被初步筛选作为LUAD预后分析中的独立预后因素;同时,TM9SF3可能通过影响LUAD的免疫微环境,参与调节LUAD的发生发展。TM9SF3有望成为LUAD新的预后指标和免疫治疗靶点。
作者贡献:
俞华林、许映华:实验操作以及文章撰写
王明伟、李曙光:实验数据统计及处理
张雯雯:生物信息学数据统计
杨劲松、李伟:文章设计和审校
| [1] |
Olive AL. Lung cancer: epidemiology and sceening[J]. Sury clin North Am, 2002, 102(3): 335-344. |
| [2] |
Roberto M, Botticelli A, Cecere F, et al. Immunotherapy in non-small cell lung cancer patients: back to the future[J]. Recenti Prog Med, 2019, 110(12): 587-593. |
| [3] |
Yost KE, Satpathy AT, Wells DK, et al. Clonal replacement of tumor-specific T cells following PD-1 blockade[J]. Nat Med, 2019, 25(8): 1251-1259. DOI:10.1038/s41591-019-0522-3 |
| [4] |
Benghezal M, Cornillon S, Gebbie L, et al. Syn-ergistic control of cellular adhesion by transmembrane 9 proteins[J]. Mol Biol Cell, 2003, 14(7): 2890-2899. DOI:10.1091/mbc.e02-11-0724 |
| [5] |
Chluba-de Tapia J, de Tapia M, Jäggin V, et al. Cloning of a human multispanning membrane protein cDNA: evidence for a new protein family[J]. Gene, 1997, 197(1-2): 195-204. DOI:10.1016/S0378-1119(97)00263-1 |
| [6] |
Froquet R, Le Coadic M, Perrin J, et al. TM9-/Phg1 and SadA proteins control surface expression and stability of SibA adhesion molecules in Dictyostelium[J]. Mol Biol Cell, 2012, 23(4): 679-686. DOI:10.1091/mbc.e11-04-0338 |
| [7] |
Shen L, Du X, Ma H, et al. miR-1193 Suppresses the Proliferation and Invasion of Human T-Cell Leukemia Cells Through Directly Targeting the Transmembrane 9 Superfamily 3 (TM9SF3)[J]. Oncol Res, 2017, 25(9): 1643-1651. DOI:10.3727/096504017X14908284471361 |
| [8] |
Tang Z, Li C, Kang B, et al. GEPIA: a web server for cancer and nor-mal gene expression profiling and interactive analyses[J]. Nucleic Acids Res, 2017, 45(W1): W98-W102. DOI:10.1093/nar/gkx247 |
| [9] |
Thul PJ, Lindskog C. The human protein atlas: A spatial map of the human proteome[J]. Protein Sci, 2018, 27(1): 233-244. DOI:10.1002/pro.3307 |
| [10] |
Vansteenkiste J, Wauters E, Reymen B, et al. Current status of immune checkpoint inhibition in early-stage NSCLC[J]. Ann Oncol, 2019, 30(8): 1244-1253. DOI:10.1093/annonc/mdz175 |
| [11] |
Iams WT, Porter J, Horn L. Immunotherapeutic approaches for small-cell lung cancer[J]. Nat Rev Clin Oncol, 2020, 17(5): 300-312. DOI:10.1038/s41571-019-0316-z |
| [12] |
Garon EB, Hellmann MD, Rizvi NA, et al. Five-Year Overall Survival for Patients With Advanced NonSmall-Cell Lung Cancer Treated With Pembrolizumab: Results From the Phase I KEYNOTE-001 Study[J]. J Clin Oncol, 2019, 37(28): 2518-2527. DOI:10.1200/JCO.19.00934 |
| [13] |
Reck M, Rodríguez-Abreu D, Robinson AG, et al. Pembrolizumab versus Chemotherapy for PD-L1-Positive Non-Small-Cell Lung Cancer[J]. N Engl J Med, 2016, 375(19): 1823-1833. DOI:10.1056/NEJMoa1606774 |
| [14] |
Mok TSK, Wu YL, Kudaba I, et al. Pembrol-izumab versus chemotherapy for previously untreated, PD-L1-expressing, locally advanced or metastatic non-small-cell lung cancer (KEYNOTE-042): a randomised, open-label, controlled, phase 3 trial[J]. Lancet, 2019, 393(10183): 1819-1830. DOI:10.1016/S0140-6736(18)32409-7 |
| [15] |
Herbst RS, Garon EB, Kim DW, et al. Long-Term Outcomes and Retreatment Among Patients With Previously Treated, Programmed Death-Ligand 1-Positive, Advanced Non-Small-Cell Lung Cancer in the KEYNOTE-010 Study[J]. J Clin Oncol, 2020, 38(14): 1580-1590. DOI:10.1200/JCO.19.02446 |
| [16] |
Gadgeel S, Rodríguez-Abreu D, Speranza G, et al. Updated Analysis From KEYNOTE-189: Pembrolizumab or Placebo Plus Pemetrexed and Platinum for Previously Untreated Metastatic Nonsquamous Non-Small-Cell Lung Cancer[J]. J Clin Oncol, 2020, 38(14): 1505-1517. DOI:10.1200/JCO.19.03136 |
| [17] |
Walsh RJ, Soo RA. Resistance to immune checkpoint inhibitors in non-small cell lung cancer: biomarkers and therapeutic strategies[J]. Ther Adv Med Oncol, 2020, 12: 1758835920937902. |
| [18] |
Boyero L, Sánchez-Gastaldo A, Alonso M, et al. Primary and Acquired Resistance to Immunotherapy in Lung Cancer: Unveiling the Mechanisms Underlying of Immune Checkpoint Blockade Therapy[J]. Cancers (Basel), 2020, 12(12): 3729. DOI:10.3390/cancers12123729 |
| [19] |
Oo HZ, Sentani K, Sakamoto N, et al. Identification of novel transmembrane proteins in scirrhous-type gastric cancer by the Escherichia coli ampicillin secretion trap (CAST) method: TM9SF3 participates in tumor invasion and serves as a prognostic factor[J]. Pathobiology, 2014, 81(3): 138-148. DOI:10.1159/000357821 |
| [20] |
Chang H, Jeung HC, Jung JJ, et al. Identification of genes associated with chemosensitivity to SAHA/taxane combination treatment in taxane-resistant breast cancer cells[J]. Breast Cancer Res Treat, 2011, 125(1): 55-63. DOI:10.1007/s10549-010-0825-z |
| [21] |
Liu Q, Dong HT, Zhao T, et al. Cancer-associated adipocytes release FU-CA2 to promote aggressiveness in TNBC[J]. Endocr Relat Cancer, 2022, 29(3): 139-149. DOI:10.1530/ERC-21-0243 |
| [22] |
Cortes JR, Filip I, Albero R, et al. Oncogenic Vav1-Myo1f induces therapeutically targetable macrophage-rich tumor microenvironment in peripheral T cell lymphoma[J]. Cell Rep, 2022, 39(3): 110695. DOI:10.1016/j.celrep.2022.110695 |
| [23] |
Zhang J, Li H, Wu Q, et al. Tumoral NOX4 recruits M2 tumor asso-ciated macrophages via ROS/PI3K signaling-dependent various cytokine production to promote NSCLC growth[J]. Redox Biol, 2019, 22: 101116. DOI:10.1016/j.redox.2019.101116 |
| [24] |
Isaeva OI, Sharonov GV, Serebrovskaya EO, et al. Intratumoral immunoglobulin isotypes predict survival in lung adenocarcinoma subtypes[J]. J Immunother Cancer, 2019, 7(1): 279. DOI:10.1186/s40425-019-0747-1 |
| [25] |
Garaud S, Buisseret L, Solinas C, et al. Tumor infiltrating B-cells signal functional humoral immune responses in breast cancer[J]. JCI Insight, 2019, 5(18): e129641. |
| [26] |
Zhao KL, Yang XJ, Jin HZ, et al. Double-edge Role of B Cells in Tumor Immu-nity: Potential Molecular Mechanism[J]. Curr Med Sci, 2019, 39(5): 685-689. DOI:10.1007/s11596-019-2092-5 |
| [27] |
Veatch JR, Lee SM, Shasha C, et al. Neoantigen-specific CD4(+) T cells in human melanoma have diverse differentiation states and correlate with CD8(+) T cell, macrophage, and B cell function[J]. Cancer Cell, 2022, 40(4): 393-409. e9. DOI:10.1016/j.ccell.2022.03.006 |
| [28] |
Wu CL, Caumartin J, Amodio G, et al. Inhibition of iNKT Cells by the HLA-G-ILT2 Checkpoint and Poor Stimulation by HLA-G-Expressing Tolerogenic DC[J]. Front Immunol, 2020, 11: 608614. |
 2022, Vol. 49
2022, Vol. 49


