文章信息
- 术后放疗在完整切除的胸腺肿瘤治疗中的价值
- Value of Postoperative Radiotherapy in Treatment of Completely Resected Thymic Tumors
- 肿瘤防治研究, 2022, 49(10): 1010-1014
- Cancer Research on Prevention and Treatment, 2022, 49(10): 1010-1014
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2022.22.0141
- 收稿日期: 2022-02-18
- 修回日期: 2022-06-30
胸腺肿瘤是一种相对罕见的胸部实体肿瘤,常位于前纵隔,发病率约3/100万[1]。然而,随着计算机断层扫描(CT)被广泛用于肺癌筛查,越来越多的前纵隔病变也被偶然发现。因此,胸腺肿瘤是亟待重新认识并予以重视的胸部疾病。
世界卫生组织(World Health Organization, WHO)将胸腺肿瘤归类为上皮源性恶性肿瘤,分为胸腺瘤、胸腺癌以及胸腺神经内分泌肿瘤[2]。其中,胸腺瘤最为常见,其次是胸腺癌,胸腺神经内分泌肿瘤最为罕见。不同组织学类型的胸腺肿瘤预后存在差异,完整切除的胸腺癌及胸腺神经内分泌肿瘤的预后不及胸腺瘤[3-4]。
Masaoka-Koga(MK)分期是基于肿瘤侵犯范围的胸腺肿瘤经典手术—病理分期系统,已经沿用40余年[5],目前大多数研究仍沿用该分期系统,但是MK分期对肿瘤的描述不够全面[6]。美国癌症联合委员会(AJCC)和国际抗癌联盟(UICC)制定的第八版TNM分期系统[7]于2015年正式启用,与MK分期相比,第八版TNM分期更加细化了肿瘤的局部侵犯范围,还对肿瘤淋巴结转移和远处转移的情况加以区分。鉴于目前绝大多数的临床证据是基于MK分期的结果,目前的ESMO(European Society for Medical Oncology)胸腺肿瘤指南[8]建议采用MK分期进行临床决策,直到有更多的数据支持新分期的使用。
放疗是胸腺肿瘤综合治疗中重要的治疗方式,包括手术切除后的术后辅助放疗(postoperative radiotherapy, PORT)、不可切除肿瘤的根治性放疗及新辅助治疗,以及转移性肿瘤的姑息放疗等。对于未能完整切除的胸腺肿瘤患者,PORT有助于减少术后复发、提高远期生存。对于完整切除肿瘤的患者,术后辅助放疗的适应证目前尚未明确。一些回顾性研究显示胸腺肿瘤患者术后复发率较高,即使根治切除术后也需行辅助放疗,但是另有一些研究显示,术后辅助治疗并不能减少术后复发,不能延长患者生存期[9-11]。至今为止,尚无Ⅲ期临床研究结果证实胸腺肿瘤完整切除术后辅助放疗的价值,也缺乏有关胸腺肿瘤术后辅助放疗不良反应的系统性研究报道。本文就术后辅助放疗的价值及存在的问题作一综述。
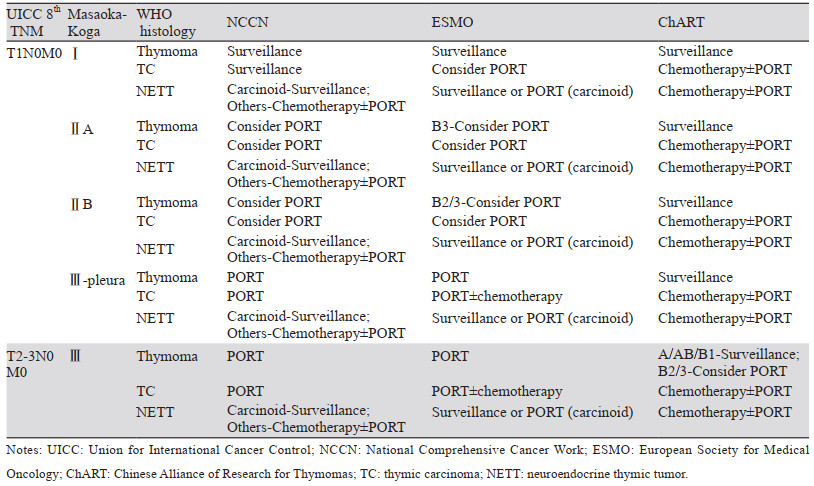
1 完整切除胸腺瘤的术后放疗对于完整切除的胸腺肿瘤患者而言,不同指南对于术后放疗在治疗中的价值有不同的意见。NCCN(National Comprehensive Cancer Work)胸腺瘤与胸腺癌指南[12]认为Ⅰ期胸腺瘤患者无需术后辅助放疗,Ⅱ~Ⅳ期切缘阴性、包膜侵犯的胸腺肿瘤可考虑术后辅助放疗。而ESMO胸腺肿瘤指南[8]中对于术后放疗的选择是在MK分期的基础上,根据WHO分型将胸腺瘤与胸腺癌区别开来,且胸腺瘤的不同分型也有不同的治疗方案,Ⅰ期胸腺瘤患者无需术后辅助放疗,而Ⅱ期患者根据胸腺瘤的类型决定是否放疗,预后相对较差的B2(Ⅱb)、B3(Ⅱa+Ⅱb)型胸腺瘤可考虑术后辅助放疗,而预后相对较好的A型、AB型、B1型无需放疗,Ⅲ期、Ⅳ期胸腺瘤患者需要术后放疗,而Ⅰ~Ⅳ期胸腺癌术后均可考虑术后放疗。基于中国胸腺瘤研究协作组(Chinese Alliance of Research for Thymomas, ChART)数据库建立的胸腺肿瘤复发预测模型,发现T1期胸腺瘤以及T2/T3期A/AB/B1型胸腺瘤(低危组)的复发转移概率远低于T2/T3期B2/B3型胸腺瘤及T1~T3期胸腺癌和胸腺神经内分泌肿瘤(高危组)(2.7% vs. 20.1%, P < 0.001)[13]。因此,ChART建议根据术后复发高危的分组采取不同的术后辅助治疗方案,见表 1。
多项研究表明,完整切除的Ⅰ期胸腺瘤患者术后有良好的生存率,没有PORT的适应证[14-15]。ChART对1994—2012年18个中心的511例MKⅠ期胸腺肿瘤患者进行分析,其中358例行单纯手术,153例行术后放疗,5年总生存率(OS)分别为99%和97%,10年OS分别为99%和91%,差异无统计学意义[11]。在一项基于美国SEER数据库的大型研究中,Forquer等对901例胸腺瘤及胸腺癌患者进行分析,其中316例行单纯手术,585例行术后放疗,结果显示PORT对MKⅠ期患者没有额外获益,甚至有不利影响[15]。另一项基于美国国家癌症数据库(National Cancer Database, NCDB)的研究也显示PORT对Ⅰ期患者生存率影响不大[16]。因此,无论是NCCN、ECMO指南,还是ChART均不推荐对Ⅰ期胸腺瘤进行术后辅助治疗。
1.2 Ⅱ/Ⅲ期胸腺瘤对于完整切除的Ⅱ期胸腺肿瘤,术后是否进行放疗仍然存在争议。既往研究显示在手术完整切除的Ⅱ期胸腺瘤中,10年累积复发率仅为8%,因此,患者可能从辅助放疗中获益甚微[17]。一项韩国的多中心研究分析了2000—2013年1 724例Ⅱ~Ⅳ期胸腺瘤患者生存情况,亚组分析显示Ⅱ期患者PORT组和非PORT组5年无复发生存(RFS)(96.3% vs. 96.6%, P=0.622)或5年OS(94.6% vs. 93.8%, P=0.839)方面差异无统计学意义,提示对于Ⅱ期患者而言,手术的完整切除即可获得长期生存[18]。而在另一项研究中,Korst等对22项MK Ⅱ/Ⅲ期胸腺肿瘤术后辅助放疗的研究进行荟萃分析,结果显示对MK Ⅱ/Ⅲ期胸腺肿瘤完全切除后加用辅助放疗并不降低总复发率,不应常规进行辅助性放疗[19]。
但是,Zhou等[20]对3 823例胸腺瘤患者进行分析,其中2 096例接受术后放疗,1 727例仅行手术治疗,结果显示接受PORT的Ⅱ期(HR=0.57; 95% CI: 0.41~0.80; P=0.001)胸腺瘤患者有更好的总生存率,与上述研究结果并不一致。另外,Jackson等研究显示,PORT对ⅡA期患者的OS没有显著影响,但接受术后辅助放疗的ⅡB期胸腺瘤患者OS更长(P=0.004)[16]。Rimner等对ITMIG回顾性数据库中1 263例完整切除的MKⅡ期/Ⅲ期胸腺瘤患者进行分析,发现术后放疗对患者5年及10年OS有明显获益,多因素分析显示更早的分期、更小的年龄与更好的OS相关,其中B1-3型胸腺瘤获益显著[10]。
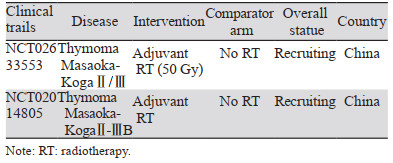
PORT可能使肿瘤侵犯周围器官的Ⅲ期胸腺瘤患者获益。Tateshi等对五项研究中4 746例完整切除的MKⅡ~Ⅲ期胸腺瘤患者进行荟萃分析,其中2 408例患者接受了术后放疗,结果显示MKⅢ期患者行术后放疗与更好的OS相关(HR=0.72; 95%CI: 0.55~0.95; P=0.02)[21]。Tang等对90例pT3N0M0胸腺肿瘤患者进行预后分析,其中41例胸腺瘤,49例胸腺癌,发现PORT与更好的DFS和OS相关[22]。Zhou等研究结果显示接受PORT的Ⅲ期(HR=0.73; 95%CI: 0.59~0.90; P=0.004)胸腺瘤患者有更好的总生存率[20]。然而,一项基于JART数据库1 265例Masaoka Ⅱ~Ⅲ期胸腺肿瘤患者的回顾性研究得出不同的结论,PORT并不增加Ⅱ期和Ⅲ期胸腺瘤的RFS或OS(P=0.350)[9]。由此可见,对于外科手术根治性切除的Ⅱ~Ⅲ期病例是否能够通过辅助放疗获益仍存在很大争议,即便是上述地区性数据库大病例组分析仍然未能得到明确结论,需要更高等级证据支持。目前,有两项Ⅲ期临床试验[23],招募Ⅱ或Ⅲ期完全切除的胸腺肿瘤患者,验证术后辅助治疗的效果,见表 2,希望这些试验的结果为改善我们的临床决策提供良好的数据。
胸腺癌是胸腺肿瘤中恶性程度较高的组织学类型,胸腺癌切除后的复发率(约40%)明显高于胸腺肿瘤(10%~15%)[24]。与胸腺肿瘤相比,胸腺癌切除后的PORT可能对复发率以及总生存率产生更有意义的影响。胸腺癌常采用以手术为主的综合治疗,术后放疗用以控制疾病的局部复发。一些研究提示术后放疗使MKⅡ期及Ⅲ期胸腺癌患者获得显著的生存期获益。日本胸腺研究会(Japanese Association for Research of the Thymus, JART)对1 265例MKⅡ期及Ⅲ期胸腺肿瘤患者进行分析,其中有155例胸腺癌(12.3%)和1 110例胸腺瘤(87.7%)。403例(31.9%)接受了PORT,结果显示Ⅱ期和Ⅲ期胸腺癌的PORT与RFS增加有关(P=0.003),而PORT并不增加Ⅱ期和Ⅲ期胸腺瘤的RFS或OS(P=0.350)[9]。Jackson等对NCDB数据库中2004—2012年4 056例胸腺瘤及胸腺癌患者进行回顾性分析,其中2 001例(49%)接受了PORT,结果显示接受PORT的胸腺癌患者OS获得显著获益(HR=0.79, 95%CI: 0.64~0.97, P=0.025)[16]。Ahmad等对1 042例胸腺癌患者进行分析,结果显示术后放疗与更好的RFS和OS相关[25]。
胸腺神经内分泌肿瘤是胸腺肿瘤中最罕见的类型,术后放疗在治疗中的作用尚未明确。由于神经内分泌肿瘤的罕见性,目前术后辅助放疗的研究较少。一项基于ITMIG和ESTS(European Society of Thoracic Surgeons)数据库的大型回顾性研究显示,术后放疗与胸腺神经内分泌肿瘤的预后无显著相关性,而病理分期和手术切除的完整性是最重要的预后因素[26]。而另一项基于SEER数据库的研究结果显示,术后放疗使Masaoka-Koga ⅡB~Ⅳ期胸腺神经内分泌肿瘤患者生存获益[27]。ESMO指南推荐应在手术后三个月内进行术后辅助放疗[8-9, 25, 28],而对于未能完整切除的胸腺癌和胸腺神经内分泌肿瘤,有必要进行术后辅助放疗[4, 9, 25, 28]。
3 总结和展望胸腺肿瘤是一种相对罕见的纵隔恶性肿瘤,基于既往筛查的研究结果,在0.5%~0.9%的筛查人群中发现有前纵隔病变[29-31],而随着体检中胸部影像学筛查的普及,纵隔病变检出率可能较前增多。由于胸腺肿瘤的发病率相对较低,很难开展前瞻性随机对照研究,导致目前关于术后放疗的研究较为有限,且现有的研究数据及结论存在矛盾。一些基于大型数据库的回顾性研究显示PORT对于R0切除后的Ⅰ期胸腺瘤没有明显生存获益,对于Ⅱ及Ⅲ期胸腺瘤的生存获益仍有争议,PORT与复发无明显相关,而对于胸腺癌的生存和复发有获益[9-11, 25, 28, 32]。目前大部分对PORT适应证及疗效的研究是基于MK分期系统,而基于第八版TNM分期的PORT相关研究较少,基于该分期的PORT适应证及疗效待更多临床证据的明确。
尽管胸腺肿瘤是相对罕见的肿瘤,但随着人们对其认识的不断加深,术后放疗的适应证也会更加明确。对于完整切除的胸腺肿瘤,应当根据肿瘤分期、切除范围、组织学类型的不同决定是否进行术后放疗。
作者贡献:
郝秀秀:资料收集与整理、文献检索及论文撰写
方文涛:论文指导
谷志涛:论文修改及审阅
| [1] |
Hsu CH, Chan JK, Yin CH, et al. Trends in the incidence of thymoma, thymic carcinoma, and thymic neuroendocrine tumor in the United States[J]. PLoS One, 2019, 14(12): e0227197. DOI:10.1371/journal.pone.0227197 |
| [2] |
Marx A, Chan JK, Coindre JM, et al. The 2015 World Health Organization Classification of Tumors of the Thymus: Continuity and Changes[J]. J Thorac Oncol, 2015, 10(10): 1383-1395. DOI:10.1097/JTO.0000000000000654 |
| [3] |
Kondo K, Monden Y. Therapy for thymic epithelial tumors: a clinical study of 1, 320 patients from Japan[J]. Ann Thorac Surg, 2003, 76(3): 878-884. DOI:10.1016/S0003-4975(03)00555-1 |
| [4] |
Fu H, Gu ZT, Fang WT, et al. Long-Term Survival After Surgical Treatment of Thymic Carcinoma: A Retrospective Analysis from the Chinese Alliance for Research of Thymoma Database[J]. Ann Surg Oncol, 2016, 23(2): 619-625. DOI:10.1245/s10434-015-4825-4 |
| [5] |
Koga K, Matsuno Y, Noguchi M, et al. A review of 79 thymomas: modification of staging system and reappraisal of conventional division into invasive and non-invasive thymoma[J]. Pathol Int, 1994, 44(5): 359-367. |
| [6] |
Detterbeck FC, Nicholson AG, Kondo K, et al. The Masaoka-Koga stage classification for thymic malignancies: clarification and definition of terms[J]. J Thorac Oncol, 2011, 6(7 Suppl 3): S1710-S1716. |
| [7] |
Detterbeck FC, Stratton K, Giroux D, et al. The IASLC/ITMIG Thymic Epithelial Tumors Staging Project: proposal for an evidence-based stage classification system for the forthcoming (8th) edition of the TNM classification of malignant tumors[J]. J Thorac Oncol, 2014, 9(9 Suppl 2): S65-S72. |
| [8] |
Girard N, Ruffini E, Marx A, et al. Thymic epithelial tumours: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up[J]. Ann Oncol, 2015, 26(Suppl 5): v40-v55. |
| [9] |
Omasa M, Date H, Sozu T, et al. Postoperative radiotherapy is effective for thymic carcinoma but not for thymoma in stage Ⅱ and Ⅲ thymic epithelial tumors: the Japanese Association for Research on the Thymus Database Study[J]. Cancer, 2015, 121(7): 1008-1016. DOI:10.1002/cncr.29166 |
| [10] |
Rimner A, Yao X, Huang J, et al. Postoperative radiation therapy is associated with longer overall survival in completely resected stageⅡ and Ⅲ thymoma—an analysis of the International Thymic Malignancies Interest Group retrospective database[J]. J Thorac Oncol, 2016, 11(10): 1785-1792. DOI:10.1016/j.jtho.2016.06.011 |
| [11] |
Liu Q, Gu Z, Yang F, et al. The role of postoperative radiotherapy for stageⅠ/Ⅱ/Ⅲ thymic tumor—results of the ChART retrospective database[J]. J Thorac Dis, 2016, 8(4): 687-695. DOI:10.21037/jtd.2016.03.28 |
| [12] |
National Comprehensive Cancer Network. Thymoma and Thymic Carcinoma (Version 1.2020)[Z/OL]. 2019. https://www.nccn.org/professionals/physician_gls/pdf/thymic.pdf.
|
| [13] |
Liu H, Gu Z, Qiu B, et al. A Recurrence Predictive Model for Thymic Tumors and Its Implication for Postoperative Management: a Chinese Alliance for Research in Thymomas Database Study[J]. J Thorac Oncol, 2020, 15(3): 448-456. DOI:10.1016/j.jtho.2019.10.018 |
| [14] |
Willmann J, Rimner A. The expanding role of radiation therapy for thymic malignancies[J]. J Thorac Dis, 2018, 10(Suppl 21): S2555-S2564. |
| [15] |
Forquer JA, Rong N, Fakiris AJ, et al. Postoperative radiotherapy after surgical resection of thymoma: differing roles in localized and regional disease[J]. Int J Radiat Oncol Biol Phys, 2010, 76(2): 440-445. DOI:10.1016/j.ijrobp.2009.02.016 |
| [16] |
Jackson MW, Palma DA, Camidge DR, et al. The Impact of Postoperative Radiotherapy for Thymoma and Thymic Carcinoma[J]. J Thorac Oncol, 2017, 12(4): 734-744. DOI:10.1016/j.jtho.2017.01.002 |
| [17] |
Detterbeck F. Towards a TNM-based prognostic classification for thymic tumours[J]. J Thorac Oncol, 2013, 8(11 Suppl 2): S68. |
| [18] |
Lim YJ, Kim E, Kim HJ, et al. Survival Impact of Adjuvant Radiation Therapy in Masaoka StageⅡ to Ⅳ Thymomas: A Systematic Review and Meta-analysis[J]. Int J Radiat Oncol Biol Phys, 2016, 94(5): 1129-1136. DOI:10.1016/j.ijrobp.2016.01.007 |
| [19] |
Korst RJ, Kansler AL, Christos PJ, et al. Adjuvant radiotherapy for thymic epithelial tumors: a systematic review and meta-analysis[J]. Ann Thorac Surg, 2009, 87(5): 1641-1647. DOI:10.1016/j.athoracsur.2008.11.022 |
| [20] |
Zhou D, Deng XF, Liu QX, et al. The Effectiveness of Postoperative Radiotherapy in Patients With Completely Resected Thymoma: A Meta-Analysis[J]. Ann Thorac Surg, 2016, 101(1): 305-310. DOI:10.1016/j.athoracsur.2015.06.034 |
| [21] |
Tateishi Y, Horita N, Namkoong H, et al. Postoperative Radiotherapy for Completely Resected Masaoka/Masaoka-Koga Stage Ⅱ/Ⅲ Thymoma Improves Overall Survival: An Updated Meta-Analysis of 4746 Patients[J]. J Thorac Oncol, 2021, 16(4): 677-685. DOI:10.1016/j.jtho.2020.12.023 |
| [22] |
Tang EK, Chang JM, Chang CC, et al. Prognostic factor of completely resected and pathologic T3N0M0 thymic epithelial tumor[J]. Ann Thorac Surg, 2021, 111(4): 1164-1173. DOI:10.1016/j.athoracsur.2020.06.078 |
| [23] |
Süveg K, Putora PM, Joerger M, et al. Radiotherapy for thymic epithelial tumours: a review[J]. Transl Lung Cancer Res, 2021, 10(4): 2088-2100. DOI:10.21037/tlcr-20-458 |
| [24] |
Hamaji M, Shah RM, Ali SO, et al. A Meta-Analysis of Postoperative Radiotherapy for Thymic Carcinoma[J]. Ann Thorac Surg, 2017, 103(5): 1668-1675. DOI:10.1016/j.athoracsur.2016.12.042 |
| [25] |
Ahmad U, Yao X, Detterbeck F, et al. Thymic carcinoma outcomes and prognosis: results of an international analysis[J]. J Thorac Cardiovasc Surg, 2015, 149(1): 95-100, 101.e1-2. DOI:10.1016/j.jtcvs.2014.09.124 |
| [26] |
Filosso PL, Yao X, Ahmad U, et al. European Society of Thoracic Surgeons Thymic Group Steering Committee. Outcome of primary neuroendocrine tumors of the thymus: a joint analysis of the International Thymic Malignancy Interest Group and the European Society of Thoracic Surgeons databases[J]. J Thorac Cardiovasc Surg, 2015, 149(1): 103-9. e2. DOI:10.1016/j.jtcvs.2014.08.061 |
| [27] |
Wen J, Chen J, Chen D, et al. Evaluation of the prognostic value of surgery and postoperative radiotherapy for patients with thymic neuroendocrine tumors: A propensity-matched study based on the SEER database[J]. Thorac Cancer, 2018, 9(12): 1603-1613. DOI:10.1111/1759-7714.12868 |
| [28] |
Ruffifini E, Detterbeck F, Van Raemdonck D, et al. Tumours of the thymus: a cohort study of prognostic factors from the European Society of Thoracic Surgeons database[J]. Eur J Cardiothorac Surg, 2014, 46(3): 361-368. DOI:10.1093/ejcts/ezt649 |
| [29] |
Henschke CI, Lee IJ, Wu N, et al. CT screening for lung cancer: prevalence and incidence of mediastinal masses[J]. Radiology, 2006, 239(2): 586-590. DOI:10.1148/radiol.2392050261 |
| [30] |
Rampinelli C, Preda L, Maniglio M, et al. Extrapulmonary malignancies detected at lung cancer screening[J]. Radiology, 2011, 261(1): 293-299. DOI:10.1148/radiol.11102231 |
| [31] |
Yoon SH, Choi SH, Kang CH, et al. Incidental Anterior Mediastinal Nodular Lesions on Chest CT in Asymptomatic Subjects[J]. J Thorac Oncol, 2018, 13(3): 359-366. DOI:10.1016/j.jtho.2017.11.124 |
| [32] |
Ruffifini E, Detterbeck F, Van Raemdonck D, et al. Thymic carcinoma: a cohort study of patients from the European Society of Thoracic Surgeons database[J]. J Thorac Oncol, 2014, 9(4): 541-548. DOI:10.1097/JTO.0000000000000128 |
 2022, Vol. 49
2022, Vol. 49