文章信息
- 食管鳞状细胞癌组织中FGL1的表达、肿瘤浸润淋巴细胞的分布及其意义
- Expression of FGL1, Distribution of Tumor-Infiltrating Lymphocytes, and Their Clinical Significance in Esophageal Squamous-Cell Carcinoma
- 肿瘤防治研究, 2022, 49(10): 1043-1047
- Cancer Research on Prevention and Treatment, 2022, 49(10): 1043-1047
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2022.22.0087
- 收稿日期: 2022-01-27
- 修回日期: 2022-04-22
2. 065000 廊坊,廊坊市中医医院健康体检中心;
3. 065000 廊坊,廊坊市中医医院肛肠外科
2. Health Examination Center, Langfang TCM Hospital, Langfang 065000, China;
3. Department of Anorectal Surgery, Langfang TCM Hospital, Langfang 065000, China
2020年全球食管癌新发病例约60.4万,年发病率为6.3/105,占全部恶性肿瘤的3.1%;食管癌导致的死亡病例约54.4万,年死亡率为5.6/105,占全部恶性肿瘤的5.5%[1]。鳞状细胞癌是食管癌最常见的组织学类型,近年来,随着诊疗技术的进步,尽管其5年生存率有了一定的提高,但纵观全球,5年生存率仍维持在10%~30%的较低水平[2]。寻找食管癌新的生物标志物和治疗靶点,对中晚期食管癌的治疗具有重要意义。
目前临床上对中晚期食管癌患者的治疗主要是放化疗、靶向治疗以及PD-1/PD-L1免疫治疗等,但效果有限,患者会出现肿瘤耐药和不良反应,因此,为了克服肿瘤耐药和不良反应,提高不同检查点抑制剂协同用药的抗肿瘤效果,开发新的免疫治疗靶点迫在眉睫。纤维蛋白原样蛋白1(fibrinogen-like protein 1, FGL1)属于纤维蛋白原家族,其主要由肝细胞分泌,并参与其有丝分裂和代谢功能[3]。相关研究表明,FGL1是淋巴细胞活化基因3(Lymphocyte-activation gene 3, LAG-3)的T细胞抑制功能的主要配体,FGL1与LAG-3具有特异性的高亲和力相互作用,阻断LAG-3/FGL1相互作用可以增强抗肿瘤作用[4]。FGL1作为一个新的免疫检查点靶点显示出显著优势,靶向FGL1是临床试验中一种新的免疫检查点阻断策略[3]。在肿瘤微环境中,TILs的存在也是决定免疫检查点抑制剂抗肿瘤效果的重要因素。当机体存在大量的TILs时,表明机体发挥了抗肿瘤的免疫反应,患者通常具有较好的预后[5]。目前有关FGL1和TILs在食管癌中的研究尚未见报道。鉴于FGL1可作为一个新的免疫检查点且与不良预后相关[6],因此,本研究分析了FGL1在ESCC中的表达、TILs的分布情况及其相关性,同时进行预后分析,为预测食管癌的预后和免疫治疗提供新思路。
1 资料与方法 1.1 临床资料筛选2019—2020年河北医科大学第四医院经手术切除后病理诊断准确且术前未行新辅助治疗的食管鳞状细胞癌(esophageal squamous cell carcinoma, ESCC)手术患者120例,所有切片均由两位高年资病理医师根据第五版WHO消化系统肿瘤病理学和遗传学分类标准进行复阅,确定诊断无误。按照美国癌症联合委员会(American Joint Committee on Cancer, AJCC)和国际抗癌联盟(Union International Center of Cancer, UICC)联合发表的第8版临床分期进行分期。本研究经河北医科大学第四医院伦理委员会批准,所有入选患者均同意手术样本使用且签订书面同意书。120例ESCC患者均经电话随访或来院复查,随访截止时间为2021年12月。
1.2 试剂及仪器兔抗人FGL1单克隆抗体购自Abcam公司(上海,EPR24018-27);RM2135石蜡切片机购自德国Leica公司;全自动免疫组织化学机购自瑞士Roche公司。
1.3 方法所有标本均经3.7%甲醛液固定,常规脱水、透明、石蜡包埋;将蜡块固定于切片机上,切成4 μm厚的薄片,45℃水中展片、贴片,56℃恒温箱中烤片,常规HE染色。免疫组织化学采用EnVision两步法染色,DAB显色,苏木精对比染色。石蜡切片脱蜡、水化、自来水冲洗,抗原修复,切片阳性对照为人正常肝组织,阳性标准为细胞质着色。
1.4 染色结果判定显微镜下观察FGL1定位于细胞质,肿瘤细胞≥1%的细胞质染色即为FGL1阳性,反之则为阴性。肿瘤浸润淋巴细胞(tumor-infiltrating lymphocytes, TILs)包括肿瘤内浸润淋巴细胞(intratumoral tumor-infiltrating lymphocytes, iTILs)和肿瘤间质浸润淋巴细胞(stromal tumor-infiltrating lymphocytes, sTILs),其评估根据浸润程度分为低度(TILs≤10%)和高度(TILs > 10%)。
1.5 统计学方法数据处理采用SPSS26.0统计软件进行分析。Spearman相关性分析FGL1的表达与临床病理特征的关系,Kaplan-Meier法和多因素Cox回归评估总生存率和预后影响因素。P < 0.05为差异有统计学意义。
2 结果 2.1 FGL1在食管鳞状细胞癌中的表达情况120例ESCC患者的临床资料,见表 1。在ESCC组织中,FGL1的阳性表达率为18.3%(22/120),主要定位于细胞质,见图 1。FGL1的表达与TNM分期、淋巴结有无转移呈正相关,而与TILs呈负相关,差异有统计学意义(P < 0.05),见表 1。
|
|
| A: FGL1 negative expression; B: FGL1 positive expression 图 1 食管鳞状细胞癌中FGL1的表达(EnVision, ×200) Figure 1 Expression of FGL1 in ESCC (EnVision, ×200) |
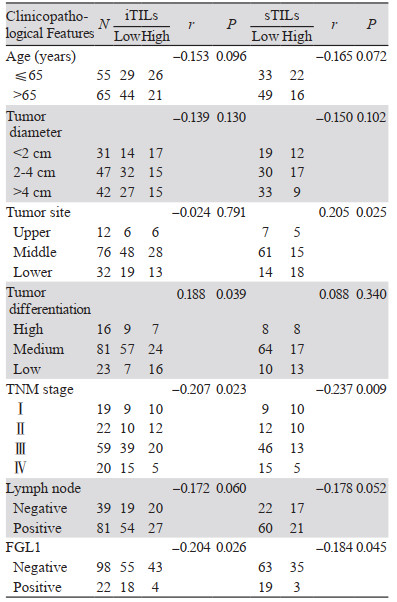
在120例ESCC患者中,低度iTILs 73例(60.8%),高度iTILs 47例(39.2%);低度sTILs 82例(68.3%),高度sTILs 38例(31.7%)。iTILs分布与肿瘤分化程度呈正相关,与FGL1的表达和TNM分期呈负相关;sTILs分布与肿瘤部位呈正相关,与FGL1的表达和TNM分期呈负相关,见表 2。
|
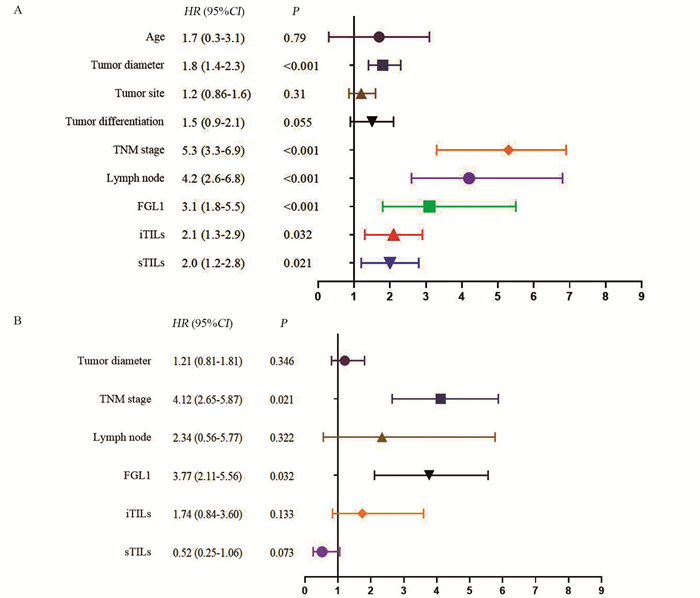
120例ESCC患者从确诊时开始计算生存时间,截至2021年12月,随访时间12~36个月,平均24个月。随访期内死亡13例(10.8%)。Kaplan-Meier生存分析结果显示:患者生存时间与肿瘤直径、TNM分期、淋巴结有无转移、FGL1的表达、iTILs、sTILs有关,差异有统计学意义(P < 0.05),见图 2A。多因素Cox回归结果显示:患者生存时间与TNM分期、FGL1的表达有关,差异有统计学意义(P < 0.05),见图 2B。
|
| A: results of Kaplan–Meier survival analysis. Survival time of patients was related to tumor diameter, TNM stage, lymph node metastasis, FGL1, iTILs and sTILs (P < 0.05); B: multivariate Cox regression results. Survival time of patients was related to TNM stage and FGL1 expression (P < 0.05). 图 2 患者生存时间与临床病理特征的关系 Figure 2 Relationship between survival time and clinicopathological features |
ESCC较常发生于50岁以上的男性,在中国和其他亚洲国家相对常见,其特点是死亡率高,预后差。目前食管癌多采取联合治疗,包括术前放疗和手术切除,或联合放疗、化疗、免疫治疗等[7],但ESCC总体预后非常差。最近一项研究报道ESCC的3年和5年生存率分别为22.2%和19.0%[8]。因此,寻找一种新的生物标志物和治疗靶点迫在眉睫,这对于未来食管癌的治疗也有重要意义。
FGL1属于纤维蛋白原家族,与纤维蛋白原β亚基和γ亚基的羧基末端具有高氨基酸同源性,正常生理条件下,FGL1蛋白主要由肝细胞分泌,并参与其有丝分裂和代谢功能[9-10]。2019年,耶鲁大学陈列平教授团队在Cell上发表了研究论文,证明了FGL1是LAG-3的一个重要的功能性配体,并揭示了该LAG-3-FGL1通路在肿瘤免疫中的作用[4]。自陈列平教授1999年发现PD-L1以来已过去20多年[11]。PD-1及其配体PD-L1的出现是肿瘤免疫治疗领域的里程碑事件和肿瘤免疫逃逸机制的研究热点,也是近年来肿瘤免疫疗法研究的热点。FGL1/LAG-3作为一条新的肿瘤免疫逃逸通路,可能作为肿瘤免疫治疗的生物标志物和治疗靶点,它可能为肿瘤免疫治疗提供一个新的思路。有研究表明,FGL1在肺癌、前列腺癌、黑色素瘤、结直肠癌、乳腺癌和脑瘤中表达上调,但在胰腺癌、肝癌和头颈癌中表达下调[3]。有研究表明,FGL1在肿瘤细胞中高表达,较高的血浆FGL1水平与癌症患者对免疫治疗的耐药性和不良预后相关[12]。临床前动物实验证明,阻断FGL1的单克隆抗体以类似于抗LAG-3的方式刺激T细胞免疫。作为新发现的LAG3高亲和力配体,FGL1有可能以不同于MHCⅡ的作用方式与LAG3结合重新启动“免疫刹车”[13]。此外,血浆中FGL1分泌水平是一个潜在的生物标志物,可用于识别不能从免疫治疗中获益的患者[14]。本研究结果显示,FGL1的阳性率为18.3%,FGL1的表达与TNM分期、淋巴结有无转移和TILs有关。前述的研究已表明,FGL1在肿瘤细胞中高表达,它可能是一个预后不良的生物标志物,本研究120例ESCC患者中,FGL1表达更趋向于临床分期较晚、淋巴结阳性的患者中,提示这些患者的预后不良。
在肿瘤微环境中,除了PD-L1在肿瘤细胞中的表达外,TILs的存在也是决定免疫检查点抑制剂抗肿瘤效果的重要因素[15]。研究表明肿瘤中高度淋巴细胞浸润与良好的预后相关,TILs也成为了一个有价值的预后指标[16]。在FGL1高表达的患者中,TILs,包括iTILs和sTILs的分布范围相对较局限,iTILs分布与FGL1的表达、肿瘤分化程度和临床分期有关;sTILs分布与FGL1的表达、肿瘤部位和临床分期有关。这些研究可能提示,FGL1和TILs联合评估可作为ESCC预测预后的生物标志物,也为将来更进一步的研究提供了思路。本研究生存分析结果显示肿瘤直径、临床分期、淋巴结状况、FGL1的表达、TILs的分布均与患者的预后有关,而且FGL1的表达、TILs的分布和临床分期是患者预后的影响因素,这也证实了我们前述的推论。
总之,免疫系统与肿瘤发生发展的关系是复杂而动态的,特别是免疫微环境中的成分相互制约。因此,充分认识肿瘤的免疫治疗机制,是肿瘤治疗的新方向。在本研究中,FGL1的表达与ESCC的不良预后相关,可能成为ESCC的预后生物标志物。FGL1和TILs联合评估可更好地预测ESCC的预后,为临床治疗提供新的思路,对研究下一代癌症免疫疗法具有重要的意义。
作者贡献:
刘尧:实验设计、实施;数据分析;论文撰写及修改
孙雪梅:临床数据收集、统计学分析
刘静:临床数据筛选
刘炜:实验设计、临床数据筛选
吕菲:免疫组织化学切片染色
刘月平:课题设计、数据审核及指导论文撰写
| [1] |
Sung H, Ferlay J, Siegel RL, et al. Global Cancer Statistics 2020: GLOBOCAN Estimates of Incidence and Mortality Worldwide for 36 Cancers in 185 Countries[J]. CA Cancer J Clin, 2021, 71(3): 209-249. DOI:10.3322/caac.21660 |
| [2] |
Zeng H, Chen W, Zheng R, et al. Changing cancer survival in China during 2003-15: a pooled analysis of 17 population-based cancer registries[J]. Lancet Glob Health, 2018, 6(5): e555-e567. DOI:10.1016/S2214-109X(18)30127-X |
| [3] |
Qian W, Zhao M, Wang R, et al. Fibrinogen-like protein 1 (FGL1): the next immune checkpoint target[J]. J Hematol Oncol, 2021, 14(1): 147. DOI:10.1186/s13045-021-01161-8 |
| [4] |
Wang J, Sanmamed MF, Datar I, et al. Fibrinogen-like Protein 1 is a Major Immune Inhibitory Ligand of LAG-3[J]. Cell, 2019, 176(1-2): 334-347. DOI:10.1016/j.cell.2018.11.010 |
| [5] |
Okadome K, Baba Y, Yagi T, et al. Prognostic Nutritional Index, Tumor-infiltrating Lymphocytes, and Prognosis in Patients with Esophageal Cancer[J]. Ann Surg, 2020, 271(4): 693-700. DOI:10.1097/SLA.0000000000002985 |
| [6] |
Lv Z, Cui B, Huang X, et al. FGL1 as a Novel Mediator and Biomarker of Malignant Progression in Clear Cell Renal Cell Carcinoma[J]. Front Oncol, 2021, 11: 756843. DOI:10.3389/fonc.2021.756843 |
| [7] |
Hoeppner J, Plum PS, Buhr H, et al. Surgical treatment of esophageal cancer-Indicators for quality in diagnostics and treatment[J]. Chirurg, 2021, 92(4): 350-360. DOI:10.1007/s00104-020-01267-8 |
| [8] |
Huang TT, Li SH, Chen YH, et al. Definitive chemoradiotherapy for clinical T4b esophageal cancer - Treatment outcomes, failure patterns, and prognostic factors[J]. Radiother Oncol, 2021, 157: 56-62. DOI:10.1016/j.radonc.2021.01.007 |
| [9] |
Li CY, Cao CZ, Xu WX, et al. Recombinant human hepassocin stimulates proliferation of hepatocytes in vivo and improves survival in rats with fulminant hepatic failure[J]. Gut, 2010, 59(6): 817-826. DOI:10.1136/gut.2008.171124 |
| [10] |
Demchev V, Malana G, Vangala D, et al. Targeted deletion of fibrinogen like protein 1 reveals a novel role in energy substrate utilization[J]. PLoS One, 2013, 8(3): e58084. DOI:10.1371/journal.pone.0058084 |
| [11] |
Dong H, Zhu G, Tamada K, et al. B7-H1, a third member of the B7 family, co-stimulates T-cell proliferation and interleukin-10 secretion[J]. Nat Med, 1999, 5(12): 1365-1369. DOI:10.1038/70932 |
| [12] |
Son Y, Shin NR, Kim SH, et al. Fibrinogen-Like Protein 1 Modulates Sorafenib Resistance in Human Hepatocellular Carcinoma Cells[J]. Int J Mol Sci, 2021, 22(10): 5330. DOI:10.3390/ijms22105330 |
| [13] |
Yu J, Li J, Shen J, et al. The role of Fibrinogen-like proteins in Cancer[J]. Int J Biol Sci, 2021, 17(4): 1079-1087. DOI:10.7150/ijbs.56748 |
| [14] |
Liu XH, Qi LW, Alolga RN, et al. Implication of the hepatokine, fibrinogen-like protein 1 in liver diseases, metabolic disorders and cancer: The need to harness its full potential[J]. Int J Biol Sci, 2022, 18(1): 292-300. DOI:10.7150/ijbs.66834 |
| [15] |
Badalamenti G, Fanale D, Incorvaia L, et al. Role of tumor-infiltrating lymphocytes in patients with solid tumors: Can a drop dig a stone?[J]. Cell Immunol, 2019, 343: 103753. DOI:10.1016/j.cellimm.2018.01.013 |
| [16] |
Zhao Z, Ding H, Lin ZB, et al. Relationship between Tertiary Lymphoid Structure and the Prognosis and Clinicopathologic Characteristics in Solid Tumors[J]. Int J Med Sci, 2021, 18(11): 2327-2338. DOI:10.7150/ijms.56347 |
 2022, Vol. 49
2022, Vol. 49


