文章信息
- 预防性使用PEG-rhG-CSF在有营养风险的局部晚期非小细胞肺癌化疗后中性粒细胞缺乏中的疗效
- Effect of PEG-rhG-CSF in Preventing Chemotherapy-induced Neutropenia in Locally Advanced Non-small Cell Lung Cancer Patients at Nutritional Risk
- 肿瘤防治研究, 2022, 49(9): 904-907
- Cancer Research on Prevention and Treatment, 2022, 49(9): 904-907
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2022.22.0062
- 收稿日期: 2022-01-18
- 修回日期: 2022-05-07
非小细胞肺癌(non-small cell lung cancer, NSCLC)占肺癌发病例数的80%~85%,多数NSCLC确诊时已处于局部晚期,失去手术机会,以化疗为主的治疗方案占重要地位[1]。然而,化疗药物引起中性粒细胞减少,导致剂量降低或周期延迟。重组人粒细胞刺激因子(recombinant human granulocyte colonystimulating factor, rhG-CSF)有刺激造血干细胞分化为成熟粒细胞的功能,是治疗中性粒细胞减少的药物,但半衰期较短。聚乙二醇重组人粒细胞刺激因子(polyethylene glycal recombinant human granulocyte colony-stimulating factor, PEG-rhG-CSF)将聚乙二醇与rhG-CSF结合,可显著升高中性粒细胞,且维持时间更长,预防性使用PEG-rhG-CSF是化疗的重要环节[2-3]。肿瘤患者面临较高的营养风险,而营养状况与化疗耐受性相关[4]。2018年美国国立综合癌症网络(national comprehensive cancer network, NCCN)指南指出在局部晚期NSCLC患者中使用中性粒细胞减少性发热(febrile neutropenia, FN)风险为10%~20%的化疗方案时,需重新评估患者营养状况决定是否预防性使用rhG-CSF[5]。本研究旨在探讨预防性使用PEG-rhG-CSF在降低有营养风险的局部晚期NSCLC使用FN风险为10%~20%的化疗期间中性粒细胞减少症的发生率和持续时间。
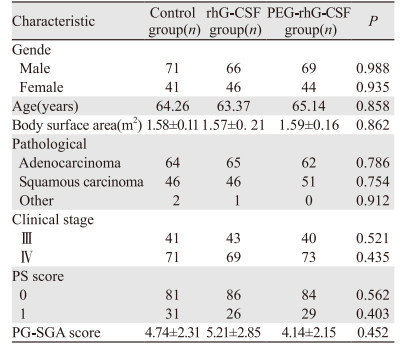
1 资料与方法 1.1 一般资料选取2018年2月—2019年4月我院局部晚期NSCLC患者337例,化疗前由持有营养师资格证的医师使用主观整体营养评估(patient generated-subjective global assessment, PG-SGA)评价患者的营养状况[6],当PG-SGA≥3分判断为有营养风险。所有患者按随机数字表法分为对照组112例、rhG-CSF治疗组112例和PEG-rhG-CSF治疗组113例。三组患者均一线使用基于铂类药物为主且NCCN推荐的当FN风险为10%~20%时的化疗方案(顺铂+紫杉醇,顺铂+长春瑞滨,顺铂+多西他赛,卡铂+紫杉醇)。记录一个化疗周期中的不良反应。本研究经湖北省肿瘤医院伦理委员会批准,所有患者均自愿签署知情同意书。
入组标准:病理确诊为NSCLC; PG-SGA≥3分; TNM分期为Ⅲ~Ⅳ期; PS:0~1分; 肝功能、肾功能、心功能正常。排除标准: 严重心脑血管疾病; 慢性疾病及精神性疾病; 化疗禁忌证; 肺纤维化; 难以控制的感染; 大量胸腔积液。终止标准:出现严重不良反应; 不能或拒绝检测外周血指标。
1.2 分组及治疗方法对照组:未预防性使用药物; rhG-CSF治疗组:化疗结束后24 h使用rhG-CSF皮下注射5 μg/kg.d,连续注射5 d; PEG-rhG-CSF治疗组:化疗结束后24 h使用PEG-rhG-CSF皮下注射100 μg/kg,一个化疗周期注射一次。三组患者人口学和临床特征见表 1,各影响因素间差异无统计学意义(P > 0.05)。
|
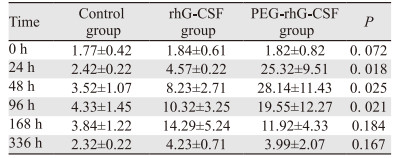
疗效评价:使用rhG-CSF后第0、24、48、96、168、336 h分别进行血常规检查,记录三组中性粒细胞绝对值、中性粒细胞减少症发生率及持续时间、观察化疗后FN发生率及中性粒细胞值从最低值到2.0×109/L以上所需时间。
免疫功能:化疗后第1、7、14 d抽取外周血2 ml,置于EDTA抗凝管中,分别取500 μl抗凝血于2支流式管底部,每管加入2 ml红细胞裂解液,弃上清液后分别加入CD3、CD4、CD8a细胞抗体(美国BD公司)避光孵育30 min后[7],使用流式细胞仪检测CD4+T、CD8+T细胞水平,计算CD4+/CD8+T细胞比值。根据NCI-CTCAE 5.0标准评价不良反应。
1.4 统计学方法采用SPSS22.0软件进行数据分析。各组数据用均数±标准差(x±s)表示,P < 0.05为差异有统计学意义。
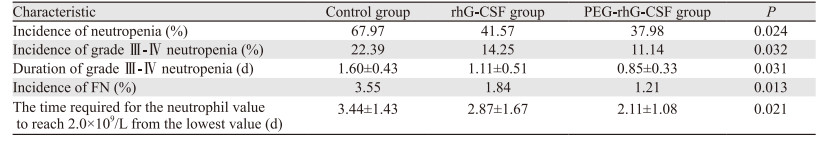
2 结果 2.1 rhG-CSF对化疗后中性粒细胞的影响对照组、rhG-CSF治疗组和PEG-rhG-CSF治疗组的中性粒细胞绝对值在第24、48和96 h时,差异有统计学意义(均P < 0.05),其他时间点差异无意义,见表 2。对照组、rhG-CSF治疗组和PEG-rhG-CSF治疗组中性粒细胞减少症、Ⅲ~Ⅳ度中性粒细胞减少症以及FN的发生率之间差异均有统计学意义(均P < 0.05),PEG-rhG-CSF治疗组Ⅲ~Ⅳ度中性粒细胞减少的持续时间、中性粒细胞从最低值到2.0×109/L以上所需时间均低于对照组和rhG-CSF治疗组。表明单次PEG-rhG-CSF较多次rhG-CSF对粒细胞增殖作用更强,见表 3。
|
|
对照组、rhG-CSF治疗组和PEG-rhG-CSF治疗组化疗后外周血中CD4+/CD8+T细胞比值分别为1.27±0.44、1.32±0.52和1.49±0.25,差异有统计学意义(P=0.032)。
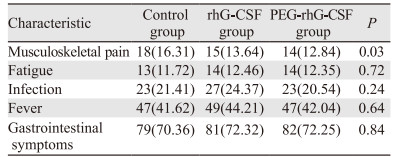
2.3 不良反应对照组、rhG-CSF治疗组和PEG-rhG-CSF治疗组骨骼肌疼痛(以腰骶部为主)的发生率差异有统计学意义(P < 0.05)。疼痛大多发生于预防性治疗后5~7天,非甾体类镇痛药可有效控制疼痛。其他不良反应发生率,差异无统计学意义(P > 0.05),说明rhG-CSF和PEG-rhG-CSF有良好的安全性,见表 4。
|
局部晚期NSCLC的治疗为以化疗为主,基于铂类药物的方案是首选[8-9]。骨髓抑制是化疗常见的不良反应,中性粒细胞减少症发生率达50.2%~92.3%[10],临床上不得不减少药物剂量,延长化疗周期甚至中断化疗。FN被认为是最严重的血液学毒性反应,感染迅猛而危及生命[11]。因此,如何降低中性粒细胞减少症和FN发生率,是保证局部晚期NSCLC治疗的关键因素。
rhG-CSF作用于骨髓中的粒系祖细胞,促进其向中性粒细胞分化和增殖,用于治疗中性粒细胞减少。PEG-rhG-CSF在rhG-CSF末端交联聚乙二醇,半衰期延长,生物稳定性增强,免疫原性与抗原性降低。相较于rhG-CSF,PEG-rhG-CSF有注射次数少和血浆浓度稳定的优点。此外,在预防FN方面似乎更有优势,研究显示[12]使用PEG-rhG-CSF出现中重度骨髓抑制较rhG-CSF明显减少,且有增强免疫功能的作用。
肿瘤患者营养不良的发生率高,患者营养状态差与化疗耐受性低有关。Xiao等[13]发现胃癌的预后营养指数是Ⅲ度以上中性粒细胞减少的危险因素; 曾亚奇等[14]研究表明胰腺癌PG-SGA评分越高,对化疗耐受性越差。上述研究提示营养状况差的患者面临更高不良反应的风险,对于这类人群预防不良反应发生至关重要。目前对有营养风险的肿瘤患者化疗期间预防性使用PEG-rhG-CSF的经验尚不足,相关文献报道极少。
本研究选取使用FN风险为10%~20%时化疗方案有营养风险的局部晚期NSCLC患者,结果提示预防性使用长短效rhG-CSF可降低中性粒细胞减少症和FN发生率。值得注意的是,PEG-rhG-CSF显著缩短重度粒细胞减少持续时间,表明单次PEG-rhG-CSF较多次rhG-CSF对粒细胞增殖作用更强。Pfeil等[15]发现PEG-rhG-CSF单次给药后升高中性粒细胞绝对值,且效果比多次给予rhG-CSF更强,维持的时间更长。安全性方面,Kasahara等[16]通过分析150例患者得出PEG-rhG-CSF无严重不良反应的发生。用药期间少数有发热、乏力和骨骼肌疼痛等不适,对症治疗后缓解,说明rhG-CSF和PEG-rhG-CSF有良好的安全性。喻满成等[17]研究显示在新冠肺炎疫情下乳腺癌患者化疗后预防性使用固定剂量的PEG-rhG-CSF,可有效减少患者注射和抽血的次数、缩短住院时间、减少患者医院暴露的机会,并且其有效性和安全性可靠。本研究证实,预防性使用PEG-rhG-CSF后CD4+/CD8+T细胞比值明显升高,提示患者免疫功能逐渐增强,进而抵御病原菌的侵袭。
综上所述,有营养风险的局部晚期NSCLC使用基于铂类药物为主的化疗方案后预防性使用长短效rhG-CSF可降低化疗期间中性粒细胞减少症和FN的发生率,缩短恢复时间,增强患者免疫功能。单次使用PEG-rhG-CSF效果优于多次rhG-CSF且维持时间更长。PEG-rhG-CSF作为中性粒细胞缺乏的治疗药物疗效安全可靠,后续将进一步开展多中心大样本的研究探讨PEG-rhG-CSF对有营养风险的NSCLC化疗期间中性粒细胞减少的疗效及远期预后。
作者贡献:
田震:选题与设计、数据分析及文章撰写
朱能、李子林、陈永忠:数据收集与整理分析、图表制作
李宏、张新华:基金支持、审核论文
| [1] |
Goodman LM, Moeller MB, Azzouqa AG, et al. Reduction of Inappropriate Prophylactic Pegylated Granulocyte Colony-Stimulating Factor Use for Patients With Non-Small-Cell Lung Cancer Who Receive Chemotherapy: An ASCO Quality Training Program Project of the Cleveland Clinic Taussig Cancer Institute[J]. J Oncol Pract, 2016, 12(1): e101-e107. DOI:10.1200/JOP.2015.006502 |
| [2] |
Gu X, Zhang Y. Clinical efficacy and safety of mecapegfilgrastim in small cell lung cancer as primary prophylaxis of neutropenia post chemotherapy: a retrospective analysis[J]. Ann Palliat Med, 2021, 10(7): 7841-7846. DOI:10.21037/apm-21-1400 |
| [3] |
石远凯, 许建萍, 吴昌平, 等. 聚乙二醇化重组人粒细胞刺激因子预防化疗后中性粒细胞减少症的多中心上市后临床研究[J]. 中国肿瘤临床, 2017, 44(14): 697-684. [Shi YK, Xu JP, Wu CP, et al. Multicenter postmarketing clinical study on using pegylated recombinant human granulocyte-colony stimulating factor to prevent chemotherapy-induced neutropenia[J]. Zhongguo Zhong Liu Lin Chuang, 2017, 44(14): 697-684.] |
| [4] |
Bozzetti F, Mariani L, Lovullo S, et al. The nutritional risk in oncology: a study of 1453 cancer outpatients[J]. Support Care Cancer, 2012, 20(8): 1919-1928. DOI:10.1007/s00520-012-1387-x |
| [5] |
Wang C, Zhu S, Miao C, et al. Safety and efficacy of pegylated recombinant human granulocyte colony-stimulating factor during concurrent chemoradiotherapy for small-cell lung cancer: a retrospective, cohort-controlled trial[J]. BMC Cancer, 2022, 22(1): 542. DOI:10.1186/s12885-022-09644-8 |
| [6] |
Kyle UG, Kossovsky MP, Karsegard VL, et al. Comparison of tools for nutritional assessment and screening at hospital admission: A population study[J]. Clin Nutr, 2006, 25(3): 409-417. DOI:10.1016/j.clnu.2005.11.001 |
| [7] |
Tian Z, Xu L, Chen Q, et al. Treatment of Surgical Brain Injury by Immune Tolerance Induced by Peripheral Intravenous Injection of Biotargeting Nanoparticles Loaded With Brain Antigens[J]. Front Immunol, 2019, 10: 743. DOI:10.3389/fimmu.2019.00743 |
| [8] |
Hata A, Katakami N, Shimokawa M, et al. Docetaxel plus ramucirumab with primary prophylactic pegylated granulocyte-colony stimulating factor support for elderly patients with advanced non-small-cell lung cancer: A multicenter prospective single arm phaseⅡ trial: dragon study(WJOG9416L)[J]. Clin Lung Cancer, 2018, 19(6): e865-e869. DOI:10.1016/j.cllc.2018.07.009 |
| [9] |
Sun J, Bai H, Wang Z, et al. Pegylated recombinant human granulocyte colony-stimulating factor regulates the immune status of patients with small cell lung cancer[J]. Thorac Cancer, 2020, 11(3): 713-722. DOI:10.1111/1759-7714.13322 |
| [10] |
Shimizu T, Taniguchi K, Asakuma M, et al. Lymphocyte-to-Monocyte Ratio and Prognostic Nutritional Index Predict Poor Prognosis in Patients on Chemotherapy for Unresectable Pancreatic Cancer[J]. Anticancer Res, 2019, 39(4): 2169-2176. DOI:10.21873/anticanres.13331 |
| [11] |
徐兵河, 宋艳秋, 王京芬, 等. 聚乙二醇化重组人粒细胞刺激因子预防化疗后中性粒细胞减少的多中心随机对照Ⅱ期临床研究[J]. 中国肿瘤临床与康复, 2016, 23(1): 3-7. [Xu BH, Song YQ, Wang JF, et al. A multicenter, randomized, controlled, phase Ⅱ clinical study of PEG-rhG-CSF for preventing chemotherapy-induced neutropenia in breast cancer patients[J]. Zhongguo Zhong Liu Lin Chuang Yu Kang Fu, 2016, 23(1): 3-7.] |
| [12] |
刘青, 关嵩, 曹峰, 等. PEG-rhG-CSF对同步放化疗中性粒细胞缺乏挽救性治疗临床分析[J]. 中华肿瘤防治杂志, 2017, 24(7): 481-485. [Liu Q, Guan S, Cao F, et al. Clinical analysis of the salvage therapy using pegylated recombinant human granulocyte colony stimulating factor for neutropenia induced by concurrent chemoradiotherapy[J]. Zhonghua Zhong Liu Fang Zhi Za Zhi, 2017, 24(7): 481-485.] |
| [13] |
Xiao AT, Tong YX, Xu XS, et al. Preoperative Nutritional Status Contributes to the Development of Neutropenia Event in Patients With Gastric Cancer Receiving CAPEOX Adjuvant Chemotherapy[J]. Front Oncol, 2020, 10: 692. DOI:10.3389/fonc.2020.00692 |
| [14] |
曾亚奇, 王昆, 宁涛, 等. 晚期胰腺癌患者PG-SGA与化疗不良反应的相关性研究[J]. 重庆医学, 2020, 49(21): 3614-3618. [Zeng YQ, Wang K, Ning T, et al. Study on correlation between PG-SGA and adversereactions of chemotherapy in patients with advanced pancreatic cancer[J]. Chongqing Yi Xue, 2020, 49(21): 3614-3618. DOI:10.3969/j.issn.1671-8348.2020.21.025] |
| [15] |
Pfeil AM, Allcott K, Pettengell R, et al. Efficacy, effectiveness and safety of long-acting granulocyte colony-stimulating factors for pro-phylaxis of chemotherapy-induced neutropenia in patients with cancer: a systematic review[J]. Support Care Cancer, 2015, 23(2): 525-545. DOI:10.1007/s00520-014-2457-z |
| [16] |
Kasahara N, Sunaga N, Kuwako T, et al. Administration of docetaxel plus ramucirumab with primary prophylactic pegylated-granulocyte-colony stimulating factor for pretreated non-small cell lung cancer: a phaseⅡ study[J]. Support Care Cancer, 2020, 28(10): 4825-4831. DOI:10.1007/s00520-020-05317-z |
| [17] |
喻满成, 李祥, 许娟, 等. 新冠肺炎疫情期间乳腺癌化疗中PEG-rhG-CSF的应用[J]. 肿瘤防治研究, 2020, 47(11): 900-902. [Yu MC, Li X, Xu J, et al. Application of PEG-rhG-CSF in Breast Cancer Chemotherapy During COVID-19 Epidemic[J]. Zhong Liu Fang Zhi Yan Jiu, 2020, 47(11): 900-902. DOI:10.3971/j.issn.1000-8578.2020.20.0331] |
 2022, Vol. 49
2022, Vol. 49


