文章信息
- 血清自身抗体联合低剂量螺旋CT在肺癌早期筛查中的价值
- Diagnosis Value of Tumor-associated Auto-antibodies Combined with Low-dose Spiral Computed Tomography in Early Lung Cancer Screening
- 肿瘤防治研究, 2022, 49(9): 908-912
- Cancer Research on Prevention and Treatment, 2022, 49(9): 908-912
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2022.22.0060
- 收稿日期: 2022-01-18
- 修回日期: 2022-05-24
2. 430060 武汉,武汉大学人民医院健康管理中心;
3. 430200 武汉,华中科技大学协和江南医院健康管理中心
2. Medical Examination Center, Renmin Hospital of Wuhan University, Wuhan 430060, China;
3. Medical Examination Center, Union Jiangnan Hospital, Huazhong University of Science and Technology, Wuhan 430200, China
全球肿瘤流行病学调查研究[1]显示,肺癌是全球发病率和病死率较高的恶性肿瘤。在男性人群,肺癌病死率居首位; 在女性人群,肺癌发病率仅次于乳腺癌居第2位,病死率位居首位。肺癌患者5年生存率仅为18.7%[2],若早期发现及诊断,Ⅰa期肺癌患者经手术切除后5年生存率可达80%以上[3]。因此,如何提高早期肺癌的诊断率具有重要的临床意义。目前,肺癌最常见的筛查方式是低剂量螺旋CT(low-dose computed tomography, LDCT)。研究认为LDCT检查可以发现25%高危人群的肺部小结节,但对肺癌的确诊率仅为4%[4],同时LDCT存在一定的辐射暴露危险。近年来众多研究表明,肿瘤发生、发展过程中产生的相关抗原能被机体免疫系统识别并产生肿瘤相关自身抗体(tumor-associated autoantibodies, T-AABs),可作为肿瘤标志物对肺癌进行协助诊断[5-6]。因此本研究探讨7种血清自身抗体即抑癌基因53(tumor protein p53, p53)、蛋白基因产物9.5(protein gene product 9.5, PGP9.5)、干细胞转录因子2(SRY-box transcription factor 2, SOX2)、肿瘤睾丸抗原7(G antigen 7, GAGE7)、肿瘤抗原4-5(RNA helicase 4-5, GBU4-5)、黑色素瘤抗原A1(MAGE family member A1, MAGE A1)和人癌抗原(cancer antigen, CAGE)检测联合LDCT在早期肺癌筛查中的价值。
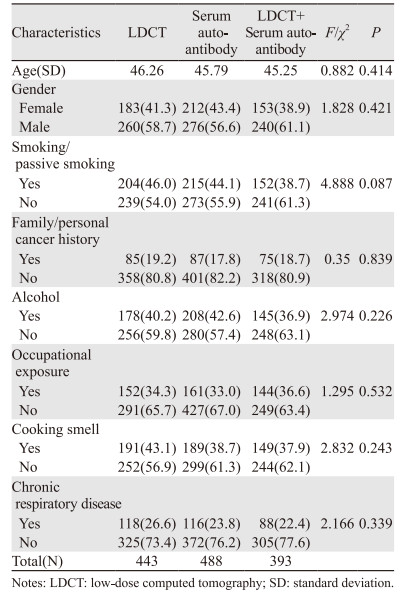
1 资料与方法 1.1 研究对象选取武汉大学人民医院健康体检中心2020年2月—2020年12月体检人群共12 568例,男性7 453例(59.30%),女性5 115例(40.70%),年龄18~80岁。通过纳入标准及排除标准,确定1 324例为肺癌高危人群,该人群均进行胸部X线检查。同时从1 324例肺癌高危人群中随机选取443例进行LDCT检测; 488例采用血清自身抗体检测; 393例采用血清自身抗体联合LDCT检测。肺癌高危人群的一般资料经统计学分析,差异无统计学意义(P > 0.05),具有可比性。肺癌高危人群的随访观察时间为12个月,最终经病理确诊为肺癌的患者共305例,其中LDCT检测组65例,血清抗体检测组88例,LDCT联合血清抗体检测组152例。纳入的研究对象均自愿签署知情同意书及经本院伦理委员会批准。
纳入标准:(1)吸烟/被动吸烟者; (2)经常大量饮酒(男性,≥3次/周,饮酒量≥25 g; 女性,≥3次/周,饮酒量≥12.5g); (3)癌症家族史(一、二级亲属中有诊断明确的癌症病史)/个人癌症史; (4)生活环境接触油烟多; (5)慢性呼吸系统疾病(肺结核、慢性支气管炎、肺气肿、哮喘支气管扩张、矽肺或尘肺等); (6)有害物质职业接触(石棉、橡胶、煤尘、粉尘、农药、放射线等)。满足其中至少一项或以上,列为高危人群。
排除标准:(1)10年内患有肺癌或者其他确诊癌症的患者; (2)受试者依从性较差,不愿意接受肺癌筛查。
1.2 影像学检查及血液样本采集 1.2.1胸部薄层CT(型号:日本东芝Aquilion CX)进行扫描。CT扫描所使用的参数为切片厚度1.00 mm,切片间隔0.8 mm,运用螺旋扫描模式。
1.2.2采集纳入研究者空腹血样标本5 ml,3 h内4℃下3 500 r/min离心5 min,分离血清并储存在-80℃的无菌试管中待用。
1.2.37种自身肿瘤抗体检测试剂盒(酶联免疫法)及其配套试剂盒均购自杭州凯保罗公司。美国热电Thermo MK3酶标仪进行检测。
1.3 实验方法X线检测及胸部CT均由高级职称专职人员进行测量分析。ELISA检测7种TAAbs,严格按照试剂盒说明书操作。酶标仪读取450 nm处吸光度(A450nm)值。阳性判断标准:7种血清肿瘤自身抗体检测浓度任何一项高于其阳性判断值则为阳性。LDCT联合血清抗体检测组阳性判断标准:LDCT检查发现肺结节同时血清自身抗体检测异常者,判断为阳性。检测筛查发现异常者的患者,指导患者入院复查,根据意愿行纤支镜活检、穿刺活检或肺结节/肺叶切除,标本均行病理检查诊断,随访时间一年。
1.4 诊断标准纤维支气管镜活检组织、CT下肺穿刺活检组织、手术肺叶切除组织及肺叶楔形切除病灶组织,肺癌诊断金标准均为病理确诊。
1.5 统计学方法SPSS26.0统计软件进行数据分析。多组间比较采用Kruskal-Wallis秩和检验,两组间比较采用χ2检验。ROC曲线分析四种检测方法对早期肺癌的诊断效能。P < 0.05为差异有统计学意义。
2 结果 2.1 一般资料比较收集符合条件的肺癌高危人群共1 324例。随机分为三组,纳入研究的肺癌高危人群基线临床资料见表 1。各组在年龄、吸烟/被动吸烟、癌症家族史/个人癌症史、饮酒、职业暴露、油烟接触、慢性呼吸系统疾病方面差异均无统计学意义。经12个月随访最终确诊305例肺癌患者,其中肺鳞状细胞癌62例、肺腺癌231例、肺小细胞癌8例、其他类型的肺癌4例(腺鳞癌2例、大细胞癌1例、癌肉瘤1例。
|
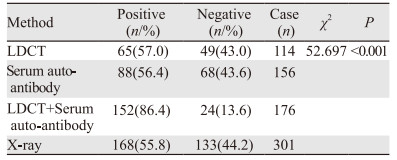
1 324例肺癌高危人群均采用X线检测,其中301例(22.7%, 301/1324)发现了肺部结节。LDCT组肺结节的初筛率为25.7%(114/443);血清抗体检测组肺结节初筛率为32.0%(156/488);而采用血清抗体联合LDCT检测组中肺结节的初筛率为44.8%(176/393),明显高于其他三组检测方法(χ2=77.651, P < 0.001)。
2.3 不同检测方法对肺癌筛查的确诊率比较不同检测组肺结节患者均经病检确诊为早期肺癌,随访一年发现,LDCT+血清抗体组的确诊率(86.4%)明显高于其他三组(P < 0.001),见表 2。
|
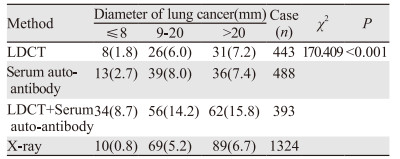
经随访确诊肺癌患者305例,其中肺癌直径≤8 mm有55例,直径9~20 mm有121例,> 20 mm有129例。经统计学分析,LDCT联合血清学抗体检测对不同直径的肺癌结节,其检出率均明显高于其他三组(P < 0.001),见表 3。相比单独运用LDCT和血清抗体检测,LDCT联合血清抗体检测,对于不同直径肺癌结节的检出率也明显提高(均P < 0.001),而LDCT检测组与血清抗体检测组的检出率无明显差异(均P > 0.05)。
|
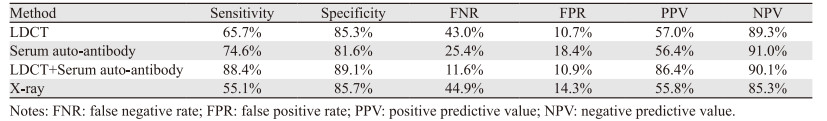
不同检测方法预测肺癌的敏感度、特异性、漏诊率、误诊率、阳性预测值及阴性预测值,见表 4。
|
以肺癌作为疾病组,健康对照组作为对照组绘制ROC曲线,分析X线检测、LDCT检测、血清抗体检测、血清抗体联合LDCT检测对肺癌的诊断效能。X线检测、LDCT检测、血清抗体检测、血清抗体联合LDCT检测的AUC分别为0.576、0.651、0.733和0.863,见图 1。
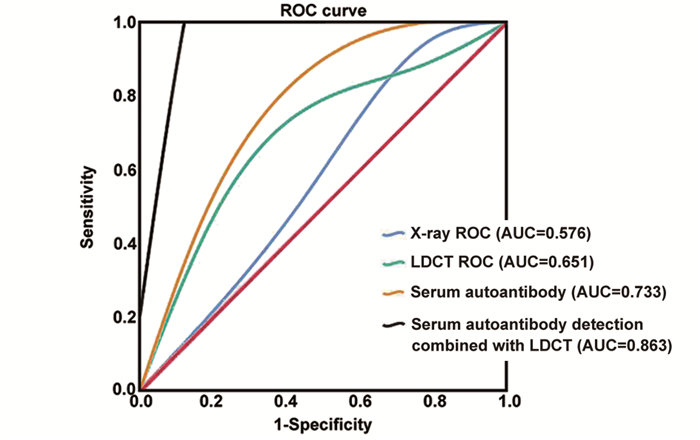
|
| LDCT: low-dose spiral CT. 图 1 不同方法诊断肺癌的ROC曲线 Figure 1 ROC curve of lung cancer by different detection methods |
肺癌是我国癌症死亡的最常见原因,同时发病率、死亡率均高于全球平均水平[7]。肺癌起病比较隐匿,大多数患者首次就诊时就处于中晚期并丧失了最佳治疗时机。肺癌常见病理类型为非小细胞肺癌(non-small cell lung cancer, NSCLC)占80%~85%。Ⅰ期非小细胞肺癌患者术后5年生存率可达80%,但晚期患者术后5年生存率下降至15%左右,且术后复发率较高[8]。尽管目前国内外有很多学者对药物研发、肺癌的发生发展和为改进肺癌治疗策略等方面做了大量研究,但肺癌仍然是预后不良的一种典型疾病[9]。因此,高效的肺癌早期筛查是患者得到早期诊断、及时治疗、改善生活质量、延长患者生存期的有效途径。
2011年,美国国家肺癌筛选试验(national lung screening trial, NLST)的研究结果明确LDCT与X线相比,在肺癌高危人群中进行LDCT筛查能降低20%的肺癌死亡[10]。尽管美国推出了LDCT肺癌筛查指南,但对于推行LDCT筛查一直存在争议。LDCT敏感度高,但准确性和特异性较差[11]。据《新英格兰医学杂志》报道,LDCT虽然可降低肺癌死亡率,但仍然存在许多问题,包括较高的假阳性率、存在一定辐射暴露危险和高成本等。研究发现对高危人群进行LDCT检查可以发现25%的肺部小结节,但肺癌的确诊率仅仅为4%[4]。大多数肿瘤体积已经生长到足够大时甚至肿瘤细胞已经开始转移时才能够被传统的诊断技术检测出来[12],此时患者已经处于中晚期,进行针对性治疗困难并且预后较差,从而导致肺癌患者的总体生存率较低[13]。因此肺癌的早期诊断仍然面临巨大的技术瓶颈和挑战。
1969年Robert W. Baldwin首次建立了肿瘤的自身免疫假说,认为人体出现肿瘤后,自身免疫系统能够针对肿瘤细胞产生抗原特异性的免疫反应。这些激活人体免疫系统的抗原称为肿瘤相关抗原(tumor-associated antigen, TAA)。TAA来自肿瘤发展过程中各信号通路中的核心分子,具有肿瘤源性,与细胞周期、信号转导、增殖及凋亡的调控等生物学过程密切相关[14]。针对TAA产生的T-AABs广泛存在血液循环系统中。多项研究表明在影像学检查确诊癌症数月至数年前即可检测到自身抗体的存在[15],T-AABs在肺癌的早期即已经达到与晚期相似的水平[16]。Qiu等用肺癌细胞系A549的分离蛋白制成芯片,对肺癌确诊前1年内的血清样本和正常对照血清样本进行检测,发现annexin I、14-3-3theta和层粘连蛋白受体1(Laminin receptor 1, LAMR1)的自身抗体在无症状期就已经存在,提示T-AABs检测可作为肺癌高危人群筛查早诊的一种方法[17]。2019年世界肺癌大会(World Conference on Lung Cancer, WCLC)公布了英国国家医疗服务体系(National Health Service, NHS)肺癌筛查研究结果,证实T-AABs在肺癌前瞻性大样本队列研究筛查获益[18];另一方面,T-AABs在肺结节性质分析中的价值已经得到了广泛认可,可作为肺结节危险分层指标,能够提供生物学特性活跃或惰性的信息[19]。本研究发现血清抗体检测对肺结节的初筛率明显高于LDCT组(32.0% vs. 22.7%, P < 0.05),但是对于肺癌的确诊率无统计学意义,因此我们认为单纯依赖血清抗体检测进行肺癌筛查并不能完全替代LDCT。
2017年上海肺科医院等多家临床研究中心对一组肺癌抗体谱检测(7-AABs),包含p53、GAGE7、PGP9.5、CAGE、MAGEA1、SOX2和GBU4-5,在中国人群中的临床价值,进行了大规模多中心研究发现:在验证组中,敏感度和特异性分别可达到61%和90%。在Ⅰ期和Ⅱ期NSCLC中,敏感度亦可达到62%和59%,对于局限性小细胞肺癌(SCLC)敏感度也可以达到59%。研究还发现,与单纯CT相比,CT与7-AABs检测联合使用可显著提高恶性病变的诊断准确率,阳性预测值从57.6%(311/540)提高到90.4%(151/167)(P < 0.001)[20]。Massion的研究证明,自身抗体检测用在肺癌早期筛查偶然发现肺结节的患者进行风险评估,与仅用CT监测相比,可能是一个具有成本效益的医疗资源的使用[21]。本研究发现,与X线、血清抗体和LDCT检测方法相比,血清抗体检测联合LDCT能明显提高肺结节的检出率及肺癌的确诊率(均P < 0.01)。Ren等研究发现,当CT与7-AABs联合评估GGNs(磨玻璃结节)和(或)结节大小在8~20 mm之间和 > 20 mm的患者,诊断准确率分别从50.8%提高到90.5%(P < 0.001)和63.4%提高到90.7%(P < 0.001)。CT与7-AABs联合检测纯GGNs和混合GGNs患者的诊断准确率分别从80.9%(55/68)和79.3%(46/58)提高到94.4%(17/18)和94.7%(18/19)[20]。CT联合7-AABs检测显著降低了不同大小和病理类型的GGNs和(或)其他结节患者的假阳性率。Du的团队发现,7-AAB可以区分恶性、良性病变和健康对照人群,敏感度为56.53%,特异性为91.60%,若结合CT,特异性可进一步提高95.80%。7-AAb对直径 < 8 mm恶性结节也显示出较高的诊断价值[22]。本研究也发现在检测不同直径的肺结节,特别是X线及CT很难查出的直径 < 8 mm结节,血清抗体联合LDCT检测肺小结节的检出率明显提高。同时通过统计分析,LDCT联合血清抗体检测能明显提高早期肺癌筛查的敏感度、特异性、阳性预测值及阴性预测值,降低误诊率及漏诊率。因此我们认为血液分子检测可以与CT一起推动早期肺癌的筛查。两者结合一方面可以通过分子检测阳性选择哪些人需要CT筛查,另一方面可以对CT筛查出来的肺上结节进行良恶性判别。
本研究制订了严格的纳入及排除标准,但最终确定的研究对象是否合理或偏差仍有待商讨。研究对象来自单中心研究,应纳入更多中心的研究对象,确保样本的多样性。同时需延长随访时间,进行与其他已知生物标志物的相关性分析,使研究结果更有效及精确。进一步的相关机制也待研究,从而确定本研究中的靶分子在肺癌发生发展中起到的作用。
综上所述,血液检查与影像学两种技术手段共同推动肺癌筛查是未来中国肺癌领域的发展方向。肿瘤相关自身抗体检测联合LDCT检测运用于肺癌的早期筛查效果显著,具有临床推广使用价值。
作者贡献:
詹娜:论文撰写
徐威:研究设计、论文撰写指导及修订
曾智:数据统计学分析
董丽玲:数据收集
| [1] |
Siegel RL, Miller KD, Fuchs HE, et al. Cancer statistics, 2022[J]. CA Cancer J Clin, 2022, 72(1): 7-33. DOI:10.3322/caac.21708 |
| [2] |
Allemani C, Matsuda T, Di Carlo V, et al. Global surveillance of trends in cancer survival 2000-14 (CONCORD-3): analysis of individual records for 37 513 025 patients diagnosed with one of 18 cancers from 322 population-based registries in 71 countries[J]. Lancet, 2018, 391(10125): 1023-1075. DOI:10.1016/S0140-6736(17)33326-3 |
| [3] |
Goldstraw P, Chansky K, Crowley J, et al. The IASLC Lung Cancer Staging Project: Proposals for Revision of the TNM Stage Groupings in the Forthcoming (Eighth) Edition of the TNM Classification for Lung Cancer[J]. J Thorac Oncol, 2016, 11(1): 39-51. DOI:10.1016/j.jtho.2015.09.009 |
| [4] |
National Lung Screening Trial Research Team, Aberle DR, Adams AM, et al. Reduced lung-cancer mortality with low-dose computed tomographic screening[J]. N Engl J Med, 2011, 365(5): 395-409. DOI:10.1056/NEJMoa1102873 |
| [5] |
Tang ZM, Ling ZG, Wang CM, et al. Serum tumor-associated autoantibodies as diagnostic biomarkers for lung cancer: A systematic review and meta-analysis[J]. PLoS One, 2017, 12(7): e182117. |
| [6] |
杨景伟, 尹德军, 刘玉霞, 等. 血清自身抗体检测联合低剂量螺旋CT在早期肺癌筛查中的临床价值[J]. 系统医学, 2019, 4(17): 10-13. [Yang JW, Yin DJ, Liu YX, et al. Clinical value of serum autoantibody detection combined with low-dose spiral CT in early lung cancer screening[J]. Xi Tong Yi Xue, 2019, 4(17): 10-13.] |
| [7] |
Xia C, Dong X, Li H, et al. Cancer statistics in China and United States, 2022: profiles, trends, and determinants[J]. Chin Med J (Engl), 2022, 135(5): 584-590. DOI:10.1097/CM9.0000000000002108 |
| [8] |
Wang Q, Wang Q, Wang SF, et al. Oral Chinese herbal medicine as maintenance treatment after chemotherapy for advanced non-small-cell lung cancer: a systematic review and meta-analysis[J]. Curr Oncol, 2017, 24(4): e269-e276. DOI:10.3747/co.24.3561 |
| [9] |
Petpiroon N, Bhummaphan N, Tungsukruthai S, et al. Chrysotobibenzyl inhibition of lung cancer cell migration through Caveolin-1-dependent mediation of the integrin switch and the sensitization of lung cancer cells to cisplatin-mediated apoptosis[J]. Phytomedicine, 2019, 58: 152888. DOI:10.1016/j.phymed.2019.152888 |
| [10] |
Kauczor HU, Bonomo L, Gaga M, et al. ESR/ERS white paper on lung cancer screening[J]. Eur Radiol, 2015, 25(9): 2519-2531. DOI:10.1007/s00330-015-3697-0 |
| [11] |
Reck M, Rabe KF. Precision Diagnosis and Treatment for Advanced Non-Small-Cell Lung Cancer[J]. N Engl J Med, 2017, 377(9): 849-861. DOI:10.1056/NEJMra1703413 |
| [12] |
Guo W, Hu M, Wu J, et al. Gprc5a depletion enhances the risk of smoking-induced lung tumorigenesis and mortality[J]. Biomed Pharmacother, 2019, 114: 108791. DOI:10.1016/j.biopha.2019.108791 |
| [13] |
Riihimäki M, Hemminki A, Fallah M, et al. Metastatic sites and survival in lung cancer[J]. Lung Cancer, 2014, 86(1): 78-84. DOI:10.1016/j.lungcan.2014.07.020 |
| [14] |
Ullah MF, Aatif M. The footprints of cancer development: Cancer biomarkers[J]. Cancer Treat Rev, 2009, 35(3): 193-200. DOI:10.1016/j.ctrv.2008.10.004 |
| [15] |
Jett J, Healey G, Macdonald I, et al. Determination of the Detection Lead Time for Autoantibody Biomarkers in Early Stage Lung Cancer Using the UKCTOCS Cohort[J]. J Thorac Oncol, 2017, 122(11): S2170. |
| [16] |
Brims F, McWilliams A, Fong K. Lung cancer screening in Australia: progress or procrastination?[J]. Med J Aust, 2016, 204(1): 4-5. DOI:10.5694/mja15.01109 |
| [17] |
Qiu J, Choi G, Li L, et al. Occurrence of autoantibodies to annexin I, 14-3-3 theta and LAMR1 in prediagnostic lung cancer sera[J]. J Clin Oncol, 2008, 26(31): 5060-5066. DOI:10.1200/JCO.2008.16.2388 |
| [18] |
Leavitt J, Pangilinan J. 2019 World conference of lung cancer round-up[J]. Oncology (Williston Park), 2019, 33(11): 687519. |
| [19] |
中华医学会肿瘤学分会, 中华医学会杂志社. 中华医学会肿瘤学分会肺癌临床诊疗指南(2021版)[J]. 中华肿瘤杂志, 2021, 43(6): 591-621. [Oncology Society of Chinese Medical Association, Chinese Medical Association Publishing House. Oncology Society of Chinese Medical Association guideline for clinical diagnosis and treatment of lung cancer (2021 edition)[J]. Zhonghua Zhong Liu Za Zhi, 2021, 43(6): 591-621. DOI:10.3760/cma.j.cn112152-20210207-00118] |
| [20] |
Ren S, Zhang S, Jiang T, et al. Early detection of lung cancer by using an autoantibody panel in Chinese population[J]. Oncoimmunology, 2018, 7(2): e1384108. DOI:10.1080/2162402X.2017.1384108 |
| [21] |
Massion PP, Healey GF, Peek LJ, et al. Autoantibody Signature Enhances the Positive Predictive Power of Computed Tomography and Nodule-Based Risk Models for Detection of Lung Cancer[J]. J Thorac Oncol, 2017, 12(3): 578-584. DOI:10.1016/j.jtho.2016.08.143 |
| [22] |
Du Q, Yu R, Wang H, et al. Significance of tumor-associated autoantibodies in the early diagnosis of lung cancer[J]. Clin Respir J, 2018, 12(6): 2020-2028. DOI:10.1111/crj.12769 |
 2022, Vol. 49
2022, Vol. 49


