文章信息
- HBx蛋白抑制DKK4表达的机制及对肝癌细胞系增殖和迁移的影响
- Mechanism of HBx Protein Inhibiting DKK4 Expression and Its Effect on Proliferation and Migration of Hepatocarcinoma Cell Lines
- 肿瘤防治研究, 2022, 49(9): 899-903
- Cancer Research on Prevention and Treatment, 2022, 49(9): 899-903
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2022.21.1524
- 收稿日期: 2021-12-29
- 修回日期: 2022-04-25
肝细胞癌占原发性肝癌的70%~90%,是全球癌症相关死亡的第三大原因,其中50%的患者是由乙型肝炎病毒(hepatitis B virus, HBV)感染及其相关疾病所致[1]。乙型肝炎病毒编码的X蛋白(HBx)是分子量为17 kda的154个氨基酸多肽,为多功能病毒调节因子,参与病毒的生命周期和HBV相关肝癌的发生发展[2]。大量数据表明,HBx能够促进或抑制细胞的凋亡,且能调节多种细胞信号转导途径,包括AP-1、NF-κB、PI3K、CREB及Wnt信号通路等。然而,HBx相关肝癌的确切致癌靶点和信号转导机制尚不完全明确。
Wnt信号通路的异常活化在包括肝癌在内的多种肿瘤中均有发现。Dickkopf蛋白(DKKs)是Wnt信号通路的拮抗剂,包含4种分泌蛋白(DKK1、2、3和4)。研究表明[3]DKK4在肝癌组织中的转录和翻译水平低于癌旁正常组织。
组蛋白去乙酰化是一种被广泛研究的翻译后组蛋白修饰,由组蛋白乙酰转移酶(HATs)和组蛋白去乙酰化酶(HDACs)的相反活性控制。通过去除乙酰基,HDACs逆转染色质乙酰化,改变癌基因和肿瘤抑制因子的转录基因,参与调节细胞周期、凋亡、DNA损伤反应、血管生成、自噬和其他细胞过程。本实验研究结果阐释了乙型肝炎病毒X蛋白如何通过去乙酰化作用下调DKK4的表达,并影响肝癌细胞的增殖和迁移能力,旨在为乙型肝炎病毒相关肝癌的进展提供理论依据。
1 材料与方法 1.1 材料人肝癌细胞系SMMC7721、HepG2均由唐都医院传染科实验室保存。腺病毒Ad-HBx由重庆医科大学感染性疾病分子生物学教育部重点实验室提供; Ad-GFP购自汉恒生物科技(上海)有限公司; siHDAC1由西安擎科泽西生物科技有限公司合成; 过表达DKK4慢病毒购自西安擎科泽西生物科技有限公司; DKK4、HDAC1和SIRT1一抗抗体均购自Abcam公司(英国剑桥)。HepG2使用含10%胎牛血清的DMEM培养基培养,培养条件为37℃、5%CO2; SMMC7721使用含10%胎牛血清的1640培养基培养,培养条件为37℃、5%CO2。
1.2 腺病毒感染分别用过表达乙型肝炎病毒X蛋白的重组腺病毒(MOI=110)及阴性对照腺病毒(MOI=10)感染肝癌细胞系,培养24 h后观察绿色荧光蛋白表达情况,当感染效率高于90%,用于后续实验。加入曲古抑菌素A(trichostatin A, TSA)处理细胞24 h,浓度分别为2、4、8和16 μmol/L。
1.3 Western blot检测利用蛋白裂解液收取各组细胞,用RIPA裂解液提取细胞总蛋白。将蛋白与5×蛋白上样缓冲液混合后在沸水中煮10 min,然后使用BCA试剂盒进行蛋白定量。配制10%的分离胶和浓缩胶,每孔上样20 μg,蛋白Marker 5 μl。跑胶后转膜2 h,再用奶粉封闭1 h,最后置膜于抗体孵育盒中,与一抗进行过夜孵育。次日用1×TBST洗膜5次,再孵育二抗1 h,之后再次用1×TBST洗膜5次。ECL法发光,并用Image J分析条带的灰度值,以GAPDH作内参。
1.4 MTT实验将处理后的细胞按照每孔5 000~1 0000个细胞接种到96孔板中,每孔体积200 µl,随后每孔中加入20 µl的5 mg/ml MTT溶液,37℃孵育4 h。1 000 rpm离心5 min,弃培养基,每孔中加入150 µl DMSO,震荡溶解10 min,酶标仪490 nm波长下检测吸光值。
1.5 结晶紫实验将各组细胞消化成单细胞悬液,并调整浓度为1×105个/毫升,以每孔1 ml接种于六孔板中,置于培养箱中培养,并于24 h后进行结晶紫染色。每孔加入1 ml 95%甲醇固定细胞10 min,后用1%结晶紫染色20 min,蒸馏水冲洗干净后风干。加入33%醋酸脱色,充分振荡后在570 nm处测定吸收度。
1.6 Transwell小室检测病毒处理48 h后将各组细胞消化成单细胞悬液,并调整浓度为1×105个/毫升重悬于无血清的RPMI1640培养基中。每组细胞取200 μl加入Transwell小室中的上室,下室加入500 μl含10%FBS的培养基,继续培养24 h后用棉签擦去上室膜上表面的细胞,位于下表面的细胞用95%无水乙醇固定10 min,1%结晶紫染色20 min,蒸馏水冲洗干净后风干,200倍的倒置显微镜下拍照。
1.7 统计学方法使用GraphPad统计学软件对数据进行处理和分析。计量单位用均数±标准差表示,两组间比较采用独立样本t检验。P < 0.05为差异有统计学意义。
2 结果 2.1 腺病毒HBx下调DKK4的表达Western blot结果显示:在SMMC7721细胞中,Ad-GFP和Ad-HBx组中DKK4的相对表达量分别为1.1464±0.0315和0.7308±0.0688;在HepG2细胞中,Ad-GFP和Ad-HBx组中DKK4的相对表达量分别为1.6458±0.1794和0.8093±0.0538。与Ad-GFP相比,SMMC7721细胞中Ad-HBx感染组中DKK4的表达显著下降(t=7.764, P=0.0162)。HepG2细胞中Ad-HBx感染组中DKK4的表达显著下降(t=6.313, P=0.0242),见图 1。
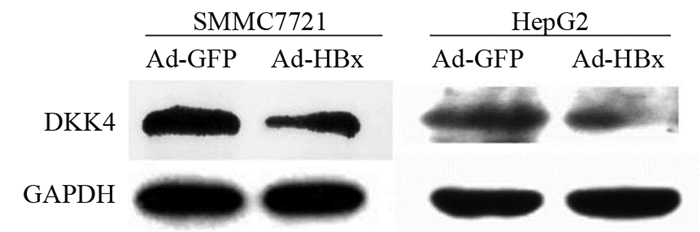
|
| 图 1 Ad-HBx感染肝癌细胞系后DKK4的表达 Figure 1 Expression of DKK4 in hepatocellular carcinoma cell lines infected with Ad-HBx |
Western blot结果显示:Ad-HBx组以及不同浓度梯度的TSA(分别为2、4、8和16 μmol/L)处理Ad-HBx的肝癌细胞系后,相对表达量分别为0.2522±0.1142、0.6843±0.0053、1.4061±0.1828、1.0786±0.3131和0.0805±0.0339。与Ad-HBx组相比,随着TSA升高,DKK4的表达上调,在浓度为4 μmol/L时达到最高值,具有统计学意义(t=7.569, P=0.0170),见图 2。
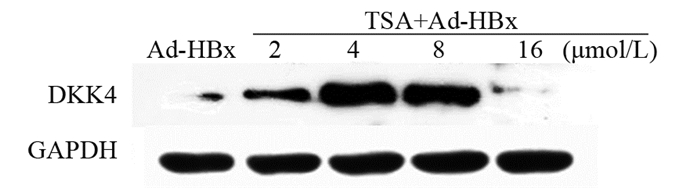
|
| 图 2 TSA处理Ad-HBx感染的肝癌细胞系后DKK4的表达 Figure 2 Expression of DKK4 in Ad-HBx-infected hepatoma cell lines treated with TSA |
Western blot结果显示:Ad-GFP组、Ad-HBx处理组和TSA处理组,HDAC1的相对表达量分别为0.4096±0.0178、1.5051±0.0838和0.7057±0.0125,Ad-HBx组与Ad-GFP组相比,HDAC1表达显著升高,差异有统计学意义(t=18.07, P=0.0030),TSA处理后,HDAC1的表达显著下调(t=13.34, P=0.0056)。三组细胞中SIRT1的相对表达量分别为0.1560±0.1418、1.2018±0.1665和0.5781±0.0493,与Ad-GFP组相比,Ad-HBx组中SIRT1的表达升高差异有统计学意义(t=6.761, P=0.0212),TSA处理后,SIRT1的表达显著下降(t=5.077, P=0.0367),见图 3。
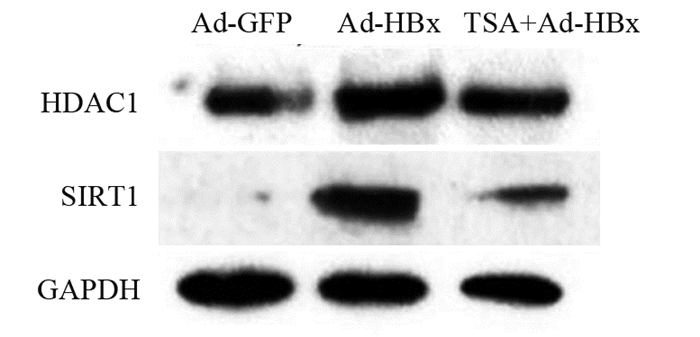
|
| 图 3 TSA处理Ad-HBx感染的肝癌细胞后HDAC1和SIRT1的表达 Figure 3 Expression of HDAC1 and SIRT1 in Ad-HBx-infected hepatoma cells treated by TSA |
Western blot结果显示:Ad-GFP组、Ad-HBx组和加入siHDAC1处理后DKK4的相对表达量分别为0.7313±0.0565、0.2679±0.0685和0.7135±0.0787,其中,与Ad-HBx组相比,抑制HDAC1后,DKK4的表达显著上调(t=6.039, P=0.0263),见图 4。
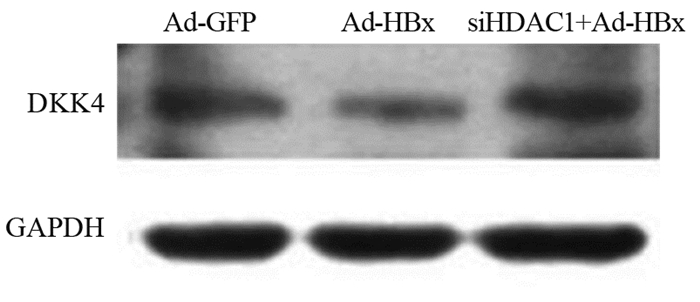
|
| 图 4 下调HDAC1后DKK4的表达 Figure 4 Expression of DKK4 after down-regulation of HDAC1 |
MTT实验结果发现,与Ad-GFP组相比,Ad-HBx组细胞增殖显著增加(t=5.580, P=0.0051);与Ad-HBx组相比,si-HDAC1+Ad-HBx组、Lenti-DKK4+Ad-HBx组和si-HDAC1+Lenti-DKK4+Ad-HBx组细胞增殖显著下降(t=5.495, P=0.0053; t=6.292, P=0.0033; t=5.348, P=0.0059)。结晶紫实验结果发现,与Ad-GFP组相比,Ad-HBx组细胞增殖显著增加(t=12.81, P=0.0002);si-HDAC1+Ad-HBx组、Lenti-DKK4+Ad-HBx组和si-HDAC1+Lenti-DKK4+Ad-HBx组细胞增殖显著下降(t=12.21, P=0.0003; t=14.34, P=0.0001; t=9.628, P=0.0007)。细胞迁移实验发现,与Ad-GFP组相比,Ad-HBx组发生迁移的细胞数显著增加(t=4.726, P=0.0420);与Ad-HBx组相比,si-HDAC1+Ad-HBx组、Lenti-DKK4+Ad-HBx组和si-HDAC1 +Lenti-DKK4+Ad-HBx组发生迁移的细胞数显著下降(t=6.205, P=0.0250; t=6.568, P=0.0224; t=6.296, P=0.0243),见图 5。
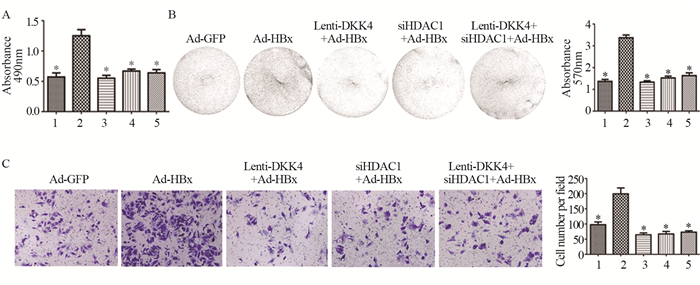
|
| *: P < 0.05, compared with Ad-HBx group; 1: Ad-GFP; 2: Ad-HBx; 3: Lenti-DKK4+Ad-HBx; 4: siHDAC1+Ad-HBx; 5: Lenti-DKK4+siHDAC1+Ad-HBx. 图 5 过表达DKK4和下调HDAC1后肝癌细胞系增殖(A, B)和迁移(C)能力的变化 Figure 5 Proliferation(A, B) and migration(C) of hepatocellular carcinoma cell lines after overexpression of DKK4 and silencing of HDAC1 |
众所周知,乙肝病毒感染是肝癌的主要危险因素。HBx定位于细胞质,参与了包括Wnt/β-catenin在内的多种与肝细胞癌发生、侵袭、迁移和复发有关的细胞信号转导途径[4]。现有研究表明,HBx通过表观遗传修饰调节促癌基因及抑癌基因的表达。Fan等[5]证明了HBx促使RelA与EZH2、TET2和DNMT3L形成复合物,从而引起DNA去甲基化诱导EpCAM的表达。HBx通过募集DNA甲基转移酶DNMT3A到NQO1基因的启动子区域,引起其高甲基化,进而沉默其表达[6]。此外,HBx还可诱导具有抑癌活性的基因启动子甲基化,如负调控细胞周期的p16INK4A基因、E-钙粘蛋白、谷胱甘肽S-转移酶P1(GSTP1)基因、SFRP1、SFRP5等[7]。另一方面,HBx还可以通过诱导某些肿瘤抑制相关基因的组蛋白去乙酰化来促进HBV诱导的HCC发病。例如,HBx介导的CDH1和IGFBP-3基因的抑制涉及转录因子mSin3A/HDAC1复合物和Sp1/HDAC1复合物向相应基因的启动子募集[8]。HBx通过HDAC1抑制cccDNA的表观沉默[9]。本文实验结果表明,HBx可以通过上调HDAC1、SIRT1引起DKK4的去乙酰化,进而导致其表达下降。
Dickkopf被认为是Wnt信号通路的拮抗剂,其家族包括4个分泌蛋白(DKK1~4)。DKK4对肿瘤进展的影响尚不完全清楚,在不同肿瘤中DKK4作用不尽相同[10]。大肠癌组织中DKK4的表达高于正常组织,且可以增强大肠癌的转移、侵袭和血管生成能力。DKK4可能是典型Wnt信号转导的下游基因。DKK4通过激活Wnt/PCP非经典通路促进肾癌细胞增殖,增强细胞侵袭力[11]。而在肝癌中,已有报道证明DKK4在肝癌组织中的转录和翻译水平低于癌旁正常组织,DKK4的过表达降低了细胞的增殖、迁移和侵袭。相反,shRNA对DKK4的敲除促进了细胞增殖,恢复了细胞的侵袭性[12]。我们的实验也证明了,乙型肝炎病毒X蛋白能下调DKK4的表达,过表达DKK4后能够抑制肝癌细胞系的增殖和迁移能力。
我们进一步深入研究了HBx下调DKK4表达的分子机制。DNA甲基化和组蛋白修饰都可能导致染色体重塑,从而影响区域编码基因和非编码RNA(ncRNAs)的表达,这是表观遗传变化最为清楚的机制之一。在HBV相关性肝癌中,许多病毒因子和受干扰的宿主因子有可能改变肝细胞的表观遗传状态,其中HBx被认为是最重要的因素。既往研究表明DKK4在肝癌细胞系中表达下降,但与甲基化无关[3]。另一方面,有报道称TCF7L1能够招募CTBP和HDAC1来抑制结肠癌细胞中DKK4基因的表达[13]。组蛋白去乙酰化在肿瘤进展中占据非常重要的作用,其中HDACs通过去乙酰基发挥作用,与肿瘤晚期疾病和不良预后相关。例如,HDAC1、2和3的高表达与胃癌的不良预后相关[14],HDCA1在肿瘤的发生和进展中有双重作用。在急性早幼粒细胞白血病(APL)前期,HDAC1拮抗了致癌基因PML-RAR的活性,但是在白血病期,却有利于APL细胞的增长[15]。SIRT1调节DDR的多个步骤,包括损伤感知、信号转导、DNA修复和凋亡,SIRT1与多种DDR蛋白相互作用并脱乙酰化,包括Ku70、NBS1、APE1、XPA、PARP-1、TopBP1和KAP1。SIRT1拮抗p53乙酰化并促进DNA损伤后癌细胞的存活。SIRT1促进肝癌的发生,并且和c-Myc的表达相关。有研究表明[16],RNA结合蛋白RPS3在核糖体外通过转录后调控SIRT1表达促进肝癌的发生,并提出RPS3/SIRT1通路可作为HCC的潜在治疗靶点。
综上所述,本研究为乙肝相关性肝癌的进展提供了理论依据,但HBx是否招募HDAC1在DKK4启动区,或者HBx与HDAC1结合后再募集在DKK4启动子区尚需开展深入研究。
作者贡献:
张文静、张谷芬:课题设计、资料分析、撰写论文
王晓艳、张颖:参与收集数据、修改论文
权会琴:拟定写作思路,指导撰写并定稿、基金资助
| [1] |
Ren L, Zeng M, Tang Z, et al. The Antiresection Activity of the X Protein Encoded by Hepatitis Virus B[J]. Hepatology, 2019, 69(6): 2546-2561. DOI:10.1002/hep.30571 |
| [2] |
Fu S, Zhang J, Yuan Q, et al. Lost Small Envelope Protein Expression from Naturally Occurring PreS1 Deletion Mutants of Hepatitis B Virus Is Often Accompanied by Increased HBx and Core Protein Expression as Well as Genome Replication[J]. J Virol, 2021, 95(14): e0066021. DOI:10.1128/JVI.00660-21 |
| [3] |
Fatima S, Lee NP, Tsang FH, et al. Dickkopf 4 (DKK4) acts on Wnt/β-catenin pathway by influencing β-catenin in hepatocellular carcinoma[J]. Oncogene, 2012, 31(38): 4233-4244. DOI:10.1038/onc.2011.580 |
| [4] |
Chaturvedi VK, Singh A, Dubey SK, et al. Molecular mechanistic insight of hepatitis B virus mediated hepatocellular carcinoma[J]. Microb Pathog, 2019, 128: 184-194. DOI:10.1016/j.micpath.2019.01.004 |
| [5] |
Fan H, Zhang H, Pascuzzi PE, et al. Hepatitis B virus X protein induces EpCAM expression via active DNA demethylation directed by RelA in complex with EZH2 and TET2[J]. Oncogene, 2016, 35(6): 715-726. DOI:10.1038/onc.2015.122 |
| [6] |
Wu YL, Wang D, Peng XE, et al. Epigenetic silencing of NAD(P)H: quinone oxidoreductase 1 by hepatitis B virus X protein increases mitochondrial injury and cellular susceptibility to oxidative stress in hepatoma cells[J]. Free Radic Biol Med, 2013, 65: 632-644. DOI:10.1016/j.freeradbiomed.2013.07.037 |
| [7] |
Elpek GO. Molecular pathways in viral hepatitis-associated liver carcinogenesis: An update[J]. World J Clin Cases, 2021, 9(19): 4890-4917. DOI:10.12998/wjcc.v9.i19.4890 |
| [8] |
Arzumanyan A, Friedman T, Kotei E, et al. Epigenetic repression of E-cadherin expression by hepatitis B virus x antigen in liver cancer[J]. Oncogene, 2012, 31(5): 563-572. DOI:10.1038/onc.2011.255 |
| [9] |
Guerrieri F, Belloni L, D'Andrea D, et al. Genome-wide identification of direct HBx genomic targets[J]. BMC Genomics, 2017, 18(1): 184. DOI:10.1186/s12864-017-3561-5 |
| [10] |
Lou X, Meng Y, Hou Y. A literature review on function and regulation mechanism of DKK4[J]. J Cell Mol Med, 2021, 25(6): 2786-2794. DOI:10.1111/jcmm.16372 |
| [11] |
胡光辉, 赖鹏, 刘欢, 等. Dickkopf-4激活Wnt/PCP通路促进肾透明细胞癌的增殖及侵袭[J]. 同济大学学报(医学版), 2015, 36(1): 18-23. [Hu GH, Nai P, Liu H, et al. Dickkopf-4 activates Wnt/PCP pathway to promote the proliferation and invasion of renal cell carcinoma[J]. Tong Ji Da Xue Xue Bao (Yi Xue Ban), 2015, 36(1): 18-23.] |
| [12] |
Chouhan S, Singh S, Athavale D, et al. Glucose induced activation of canonical Wnt signaling pathway in hepatocellular carcinoma is regulated by DKK4[J]. Sci Rep, 2016, 6: 27558. DOI:10.1038/srep27558 |
| [13] |
Eshelman MA, Shah M, Raup-Konsavage WM, et al. TCF7L1 recruits CtBP and HDAC1 to repress DICKKOPF4 gene expression in human colorectal cancer cells[J]. Biochem Biophys Res Commun, 2017, 487(3): 716-722. DOI:10.1016/j.bbrc.2017.04.123 |
| [14] |
Schizas D, Mastoraki A, Naar L, et al. Histone Deacetylases (HDACs) in Gastric Cancer: An Update of their Emerging Prognostic and Therapeutic Role[J]. Curr Med Chem, 2020, 27(36): 6099-6111. DOI:10.2174/0929867326666190712160842 |
| [15] |
Santoro F, Botrugno OA, Dal Zuffo R, et al. A dual role for Hdac1: oncosuppressor in tumorigenesis, oncogene in tumor maintenance[J]. Blood, 2013, 121(17): 3459-3468. DOI:10.1182/blood-2012-10-461988 |
| [16] |
Zhao L, Cao J, Hu K, et al. RNA-binding protein RPS3 contributes to hepatocarcinogenesis by post-transcriptionally up-regulating SIRT1[J]. Nucleic Acids Res, 2019, 47(4): 2011-2028. DOI:10.1093/nar/gky1209 |
 2022, Vol. 49
2022, Vol. 49


