文章信息
- 阴性淋巴结数目在实体肿瘤预后中的价值
- Prognostic Value of Negative Lymph Nodes Count in Solid Tumors
- 肿瘤防治研究, 2022, 49(8): 843-849
- Cancer Research on Prevention and Treatment, 2022, 49(8): 843-849
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2022.21.1523
- 收稿日期: 2021-12-29
- 修回日期: 2022-04-18
2. 730000 兰州,兰州大学第二医院普通外科
2. Department of General Surgery, The Second Hospital of Lanzhou University, Lanzhou 730000, China
癌症的发病率和死亡率在全世界范围内迅速增长,估计值表明2020年全球有1 930万新发病例和近1 000万癌症死亡病例,我国恶性肿瘤的发病和死亡人数分别占世界25.3%和31.4%[1],恶性肿瘤已成为危害人群健康的主要原因之一。目前对可切除实体肿瘤的治疗仍采取手术治疗为主,放射治疗、化学治疗、分子靶向治疗和免疫治疗为辅的综合性治疗,但整体预后差。因此寻找与预后相关的危险因素尤为重要。之前大量研究表明,美国癌症联合委员会(AJCC)/国际抗癌联盟(UICC)制定的术后病理(pathological tumor-node-metastasis, pTNM)分期系统是目前最重要和最基本的指导治疗策略和评估肿瘤预后的重要工具,但其准确性仍不清楚[2]。目前的pTNM分期系统中T分期通过原发肿瘤的病理检查即可确定,但精确的N分期很难确定。N分期仅是指阳性淋巴结(positive lymph node, PLN),PLN状态在评估肿瘤预后中的价值不言而喻。PLN计数在很大程度上取决于所检查的淋巴结的总数,在仅检查少量淋巴结的情况下可能无法准确预测。送检淋巴结不仅包含PLN,也包含阴性淋巴结(negative lymph node, NLN),虽然阴性淋巴结数(negative lymph node count, NLNC)与肿瘤分期无关,一旦检索到的淋巴结范围不够,生存预测就会不准确。近年来,NLNC在实体肿瘤预后中的价值在众多研究中得到证实,NLNC增加可以有效改善实体肿瘤患者的总生存期(OS)或肿瘤特异性生存期(CSS)。由于淋巴微转移(lymph node micrometastasis, LNMM)[3]的存在,NLNC不能通过常规病理检查来诊断,并且NLN计数有一个独特的优势,即它几乎不受检索到的项数影响[4],这表明NLNC可以被视为一个重要的标志物,甚至可能是改善预后的必要条件[5]。检查更多的NLNC可以提高潜在转移的PLN的检出率,提高分期的准确性,减少分期迁移[6],因此本文对NLNC在实体肿瘤预后中的价值进行综述,以期为未来的临床研究提供参考。
1 以淋巴结转移数目进行病理分期的实体肿瘤 1.1 胃癌胃癌根治术加淋巴结清扫是可以提高胃癌患者5年OS的标准术式[7]。淋巴结状态是反映胃癌进展情况及指导术后治疗的关键指标之一,也是行胃癌根治术后的一个强有力的预后预测因素[8],临床医生越来越强调评估淋巴结状态的重要性。事实上,PLN数目相同的胃癌患者预后具有异质性,即使pTNM相同的患者,其预后并不完全一致。PLN固然重要,可以为pTNM的划分提供主要依据,是胃癌预后最重要的预测因子,但NLNC的预后价值在胃癌患者中的作用同样不能忽视。
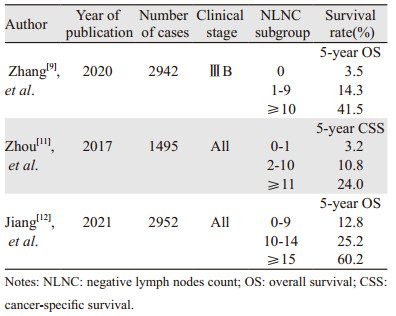
Zhang等[9]基于一项多中心数据的回顾性队列研究中证实了NLNC是Ⅲ期胃癌行根治性切除术后OS的独立预后因子,当NLNC数目为0、1~9和≥10枚时对应的5年OS分别为41.5%、14.3%和3.5%;同时也发现NLNC与PLN计数呈正相关,随着NLNC的增加可以提高PLN的检出率。Ⅳ期胃癌的标准推荐治疗方法是姑息性化疗,Min等[10]在一项对Ⅳ期胃癌的研究中证实了通过腹腔镜进行根治性切除术和转移灶切除术可能在Ⅳ期胃癌中有潜在作用。Ⅳ期胃癌区域淋巴结的临床重要性尚未完全被认识。Zhuo等[11]基于SEER数据库首次研究了在接受姑息性切除的Ⅳ期胃癌患者中标准的淋巴结清扫,确定了NLNC分组的最佳截断值为2和11,表明NLNC的增加是Ⅳ期胃癌姑息性切除术后的独立预后因素,在不同的病理N分期上也具有同样的效应。另外一项来自国内纳入了2 952例进展期胃癌患者的多中心回顾性队列研究中,通过生存分析发现,NLNC越多,生存率越高,但其不能作为预后的独立预测因子[12],与Zhang等[9, 11]的研究结果有差异,见表 1。
食管癌(esophageal squamous cell carcinoma, ESCC)患者的死亡率很高,其预后因素的确定对于预测预后和确定适当的治疗策略至关重要。目前胃癌第8版AJCC分期系统中定义了清扫最小淋巴结数目为16枚[13],但对于ESCC患者没有定义足够的淋巴结清扫所必需最小淋巴结数目,淋巴结转移同样是ESCC的重要预后指标[14]。切除淋巴结的程度可能影响病理分期,进而影响ESCC患者的预后。阳性淋巴结的数量往往受到许多因素的影响,如新辅助治疗以及送检的淋巴结数量。
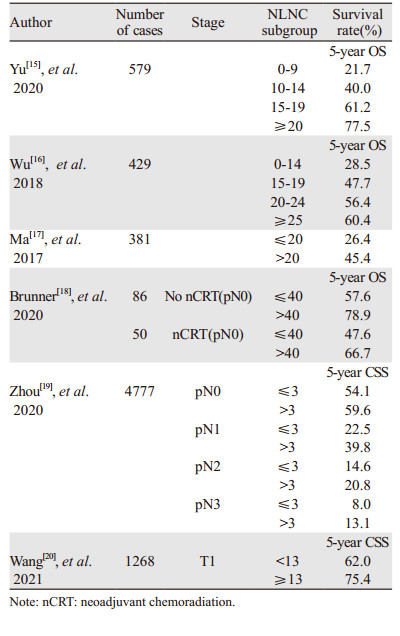
Yu等[15]将579例胸段ESCC患者送检的NLNC分为4组(0~9、10~14、15~19和≥20枚),证实了NLNC是治疗切除术后胸段ESCC患者存活的重要独立预后指标。随着NLNC的增加,患者的预后更好,在淋巴结转移阴性和淋巴结转移阳性两个亚组上具有同样的价值。Wu等[16]对NLNC在未发生淋巴结转移的ESCC患者预后价值的研究中,同样证实了NLNC是淋巴结阴性ESCC患者的独立预后因素。Ma等[17]对术前未接受放疗和化疗、淋巴结发生转移的ESCC患者预后研究中,基于NLNC平均值,将20确定为分析的截断值。NLNC代表了ESCC淋巴结清扫程度,结果也表明NLNC大于20时会明显改善ESCC患者的5年OS,尤其是那些淋巴结发生转移和进展期肿瘤的患者。近年来,多模式治疗,特别是新辅助放化疗(neoadjuvant chemoradiation, nCRT)已被证明可以改善预后,并用于局部晚期肿瘤患者。Brunner等[18]纳入了仅接受手术治疗和接受nCRT的患者共136例,结果只证实NLNC是原发性ESCC患者切除术后的独立预后因素,对接受新辅助化疗的患者预后没有差异。在Zhou等[19]的研究中,超过3个NLNC与ESCC患者更好生存有关,同时将阳性淋巴结数目(negative lymph nodes count, PLNC)也纳入了研究,证实了NLNC和PLNC的组合可以为ESCC患者提供更好的预后预测。Wang等[20]对T1期ESCC患者的研究中,证实了淋巴结清扫的范围与CSS相关,建议最少需要切除的淋巴结数为14个,T1期患者淋巴结清扫后NLNC也具有预后价值,进一步提出了用于改善T1期患者预后的NLNC的最小值为13,见表 2。
结肠直肠癌是人群中常见的恶性肿瘤之一。对于非转移性结肠癌,外科手术方法是去除区域淋巴结的结肠切除,并整体切除区域淋巴结[21]。到目前为止,仍然缺乏有效的手段对生存期进行准确的评估,淋巴结转移是术后分期和预后的主要指标,一些学者同样注意到NLNC在结直肠癌预后中的价值。Quan等[22]基于美国SEER数据库分析20 702例结肠癌患者的临床资料及NLNC与Ⅲ期结肠癌的预后关系,结果表明NLNC是Ⅲ期结肠癌右侧和pN1期患者的重要预后因素,而不是pN2期和左侧结肠癌患者的预后因素。He等[23]也同样证实NLNC是免疫应答的指标,并且NLNC的数目越多与结肠癌患者更好的预后有关,其机制可能是NLNC影响局部肿瘤微环境和全身炎性反应。超过12个NLNC与增加的血小板计数(PLT)和血清C-反应蛋白(CRP)水平相关,并且可以诱导中性粒细胞侵袭。Sun等[24]探讨了接受nCRT和根治性手术后直肠癌患者NLNC的预后意义,证实其是接受nCRT后新辅助化疗后病理N分期(ypN)+直肠癌患者DFS的独立预后因素,包含NLNC、肠系膜下动脉(inferior mesenteric artery, IMA)淋巴结转移、肿瘤分化和新辅助治疗后病理T分期(ypT)的列线图可以对不同DFS的直肠癌患者进行分层,有助于临床决策。Li等[25]报道NLNC可以为接受术前放疗的直肠癌患者提供准确的预后信息,证实NLNC是直肠癌患者独立的预后因素,并确定最佳截断值为9,亚组分析显示NLNC是ypⅡ和ypⅢ患者的独立预后因素。Cui等[26]研究证实纳入NLNC及其他一些淋巴结指标的新TNM分期系统更有助于评估直肠癌患者的预后,见表 3。在之前的研究中,Ogino等试图去揭示NLNC与结直肠癌预后的机制,NLNC与结直肠癌患者的生存率提高相关,与肿瘤分子改变(包括MSI、CIMP、LINE-1低甲基化和BRAF突变)和淋巴细胞反应无关[27]。然而到目前为止,还没有报道证实NLNC影响结直肠癌预后的机制。
胆囊癌(gallbladder cancer, GBC)是最常见的胆道恶性肿瘤,目前缺乏有效的治疗方法且预后不良,手术是唯一确定的治疗方法,即使在手术后,生存率仍然很低[28-29]。鲜有研究报告GBC中NLNC的预后意义。Lin等[30]一项基于SEER数据库的研究共纳入1 754例GBC患者,研究证实NLNC是胆囊癌患者术后的独立预后因素,且NLNC的最佳截断值为2。该值远低于其他肿瘤中所报道的最佳截断值,可能的原因是大多数GBC于晚期诊断,且胆囊没有黏膜下层,器官侵犯可能比其他癌症更容易发生,这意味着更多的淋巴结转移和更少的NLNC[31]。
1.5 肝门部周围胆管癌根据解剖位置,胆管癌分为肝内、肝门周围或远端恶性肿瘤。肝门周围胆管癌占所有胆管癌的50%以上。肝门周围胆管癌的最佳治疗方法是手术切除,5年OS仅为20%~45%[32]。Gao等[33]第一次研究了NLNC在肝门部胆管癌预后中的价值,单变量和多变量生存分析均显示,NLNC与患者的CSS显著相关。超过17个NLN的患者比NLN较少的患者有更好的CSS,在亚组Ⅰ期和Ⅱ期肿瘤患者中仍具有独立预后价值。
2 以淋巴结转移解剖部位进行病理分期的实体肿瘤 2.1 乳腺癌乳腺癌是全世界女性最常见的癌症,治疗方法包括手术、化疗、内分泌治疗、靶向治疗和放射治疗在内的多学科治疗。腋窝淋巴结转移是乳腺癌患者治疗中一直具有争议的领域。腋窝淋巴结状态在预测局部复发和长期生存方面具有重要作用。第8版AJCC和UICC TNM分期系统是基于PLNC转移的位置但不是NLNC。不同患者的腋窝淋巴结清扫程度都不可能完全一致,近几十年来,越来越多的乳腺癌患者接受了nCRT,因此,病理淋巴结状态可能受到nCRT的显著影响,不能准确评估预后。如果只使用PLN分期,相同N分期的乳腺癌患者的预后具有异质性,由于腋窝淋巴结解剖之后的总淋巴结由PLN和NLN组成,因此有必要将NLN纳入预后预测系统,为了提高乳腺癌预后预测的准确性,不仅要考虑PLNC,还要充分考虑NLNC。
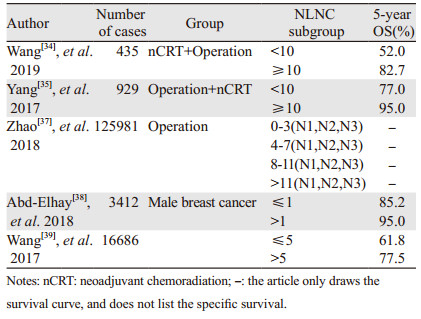
NLNC在乳腺癌中的作用仍不清楚,特别是在接受新辅助化疗和乳房切除术的患者中,Wang等[34]第一次证实了NLNC是5年DFS和5年OS的独立预测因子,更多NLNC显示出更好的预后。当NLNC取截断值为10时,NLNC≥10和NLNC < 10的患者对应的5年OS分别为82.7%和52.0%,表明彻底的腋窝淋巴结清扫和一定数量的NLN可以改善乳腺癌患者的预后。Yang等[35]报道了较高的NLNC可改善侵袭性乳腺癌患者的预后,并且将NLNC与淋巴结转移比(lymph node ratio, LNR)组合进行预后预测时有更好的区分能力。Wang等[36]对国内394例三阴性乳腺癌患者进行研究,证实患者DFS和OS的NLNC最佳截断值为6,较高的NLNC预后更好,并且建议未来将NLNC纳入当前的AJCC TNM分期系统。此截断值为6小于一些研究中报道的NLNC截断值为10[35],可能与该研究中送检淋巴结总数小于这些研究有关。
推荐适当的淋巴结评估,以获乳腺癌患者的最佳分期。NLN在N分期(N1、N2和N3)中的作用仍不清楚。Zhao等[37]是第一个使用基于群体的数据库评估NLNC在乳腺癌中的作用。Abd-Elhay等[38]研究NLNC在男性乳腺癌(male breast cancer, MBC)预后中的价值,MBC确诊时通常为晚期,因此具有比女性乳腺癌(female breast cancer, FBC)更差的预后,MBC相比FBC也更容易受到LN的影响,该研究也是基于SEER数据库的研究,结论证实NLN计数是MBC患者存活的强预测因子,其截断值为1。Wang等[39]在一项基于SEER数据库的研究结果表明,NLNC是接受术后放射治疗(postmastectomy radiotherapy, PMRT)的独立预后因素,并且较高数量的NLNC患者预后更好。分析NLNC与乳腺癌预后之间的相关性,我们认为更多NLNC可能会降低隐匿性病变的风险以及有助于确定精确的pTNM分期,然后用作改善存活的指标,见表 4。
肺癌是第二大最常见的癌症,也是癌症死亡的主要原因之一,约占诊断癌症例数的11.4%,死亡例数占18.0%[1]。精确的肿瘤分期在NSCLC患者的管理中起着至关重要的作用,包括选择患者辅助治疗方案和预测患者预后。淋巴结状态被认为是肺癌分期分类中的重要因素,淋巴结转移的患者更容易复发且存活率较低,其可以将患者分为不同类别并指导辅助治疗。目前,区域淋巴结转移的解剖位置是确定NSCLC患者TNM分期系统的重要标准。Zhou等[40]探讨了NLNC和生存之间的关联,表明NLNC是NSCLC患者的OS和肺癌特异性生存率(lung cancer specific survival, LCSS)的独立预后因子,当NLNC截断点为2和5时,其为NSCLC患者的LCSS和OS提供了独立的预后值。Liu等[41]的一项回顾性研究中,将转移性淋巴结(metastatic lymph nodes, MNS)、LNR、切除的淋巴结(resected lymph nodes, RNS)和NLNC的预测值与当前使用的病理淋巴结(pathologic nodal, PN)分段进行了比较,证实了PN和NLN类别均为患者存活的独立预测因子。基于解剖学的PN阶段分类和NLNC组别(NLNC < 8, NLNC≥8)的组合是可手术NSCLC患者的准确预后决定因素,其效能相当于第八版N分期。Wang等[42]将NLNC以10和30作为预测OS的最佳截断点,使用组合因子分层的生存分析表明,NLNC是Ⅱ/ⅢA期患者的OS和DFS的强烈预后因素,并为NSCLC患者与LNR相结合提供了有用的分类方案。
尽管淋巴结状态不影响当前国际妇产科联合会(international federation of gynecology and obstetrics, FIGO)的宫颈癌的分期系统,但是先前有研究证实LNR对宫颈癌患者的预后有影响,NLN在其他肿瘤中被证实与预后有关,因此,Lu等[43]第一次研究了宫颈癌患者行根治性手术后NLNC的预后价值,并且通过多元Cox分析证实了NLNC作为宫颈癌患者独立预后因素,在亚组分析中仍具有意义。Bao等[44]在一项对口腔癌患者的研究中却展示出与之前不同的结论,其关键发现是NLNC表现出与OS的非线性关系,当NLNC < 24时,NLNC越大,死亡风险越小,然而当NLNC > 40时其HR > 1,表明随NLNC增大时,预后越差。
3 总结与展望第8版AJCC/UICC pTNM分期系统已经成为全球范围内多种肿瘤治疗策略选择和预后评估的重要参考依据,但pTNM分期相同的肿瘤患者预后仍然有差异。淋巴结转移是多种肿瘤复发的主要原因,pN分类由PLNC转移的数目或解剖部位确定。NLNC与肿瘤患者预后关系的机制尚不清楚,几种潜在机制可以解释这一关系。
首先,转移性淋巴结通常通过HE染色检测,常规HE染色确定的淋巴结转移可能无法准确反映预后,因为存在LMMN[45-46],而微转移淋巴结应通过免疫组织化学染色[47]或分子检测进行评估。通过增加淋巴结的数量,在淋巴结内留下微转移的可能性可能会降低。由于送检淋巴结和NLNC不足导致的pN的分期不准确,患者预后将被低估,这种现象称为阶段迁移[6, 48]。从理论上讲,切除更多的淋巴结或NLN可降低隐匿病变的风险,从而增加存活率[33]。其次,NLNC增加的保护作用可能与肿瘤免疫有关,肿瘤周围存在两种肿瘤免疫,即抗肿瘤免疫和免疫耐受,随着癌症的发展,后者倾向于引起免疫耐受[49-50]。微卫星状态独立于PLN的存在影响NLNC,MSI-HGC被认为是胃癌的四个主要亚型之一,这是由于错配修复功能缺陷(dMMR),dMMR肿瘤中较高的突变率可能编码非自身免疫原性基因新表位,已知可诱导强烈的免疫反应和淋巴细胞募集[51]。Nakakubo等研究结果证实大量浸润的树突状细胞与较少的淋巴结转移相关[52]。此外George等[53]报道,结直肠癌患者NLNC的预后价值独立于淋巴细胞反应和肿瘤分子改变,如CpG岛甲基化表型(CIMP)、长散布元素1(LINE-1)低甲基化、MSI和BRAF突变。Bao等[44]在一项对口腔癌患者的研究中,指出NLNC并不是清扫越多越好,广泛淋巴结切除术的预后益处可能在一定程度上稳定下来,甚至可能引起更低的OS,这可能是由于广泛淋巴结切除术后并发症增加所致[54]。因此外科医生应注意淋巴结的转移,避免过度切除NLN。此外,未来的研究需要关注PLNC和NLNC之间的平衡。
尽管目前的研究大多是回顾性研究,且NLNC的分类仍然缺乏统一可靠的标准,不同的研究使用不同的分层和统计方法。但是现有的证据表明,NLNC可以减少分期迁移,且增加的NLNC与OS、CSS和DFS的显著改善有关,其可以作为多种实体肿瘤的预后预测指标,有望作为pTNM分期系统的补充。随着将来大量的前瞻性、多中心的临床试验的验证,我们将会更加深入地揭示NLNC与实体肿瘤患者预后的潜在机制。
作者贡献:
李金洲:论文设计与撰写
黄泽平、穆彦熹、姚亚龙:文献检索与整理
汪文杰、刘海鹏、刘杰、王舟:论文设计
陈晓:论文撰写与审查
| [1] |
Sung H, Ferlay J, Siegel RL, et al. Global Cancer Statistics 2020: GLOBOCAN Estimates of Incidence and Mortality Worldwide for 36 Cancers in 185 Countries[J]. CA Cancer J Clin, 2021, 71(3): 209-249. DOI:10.3322/caac.21660 |
| [2] |
Fang C, Wang W, Deng JY, et al. Proposal and validation of a modified staging system to improve the prognosis predictive performance of the 8th AJCC/UICC pTNM staging system for gastric adenocarcinoma: a multicenter study with external validation[J]. Cancer Commun (Lond), 2018, 38(1): 67. DOI:10.1186/s40880-018-0337-5 |
| [3] |
Huang CM, Lin JX, Zheng CH, et al. Effect of negative lymph node count on survival for gastric cancer after curative distal gastrectomy[J]. Eur J Surg Oncol, 2011, 37(6): 481-487. DOI:10.1016/j.ejso.2011.01.012 |
| [4] |
Shi RL, Chen Q, Ding JB, et al. Increased number of negative lymph nodes is associated with improved survival outcome in node positive gastric cancer following radical gastrectomy[J]. Oncotarget, 2016, 7(23): 35084-35091. DOI:10.18632/oncotarget.9041 |
| [5] |
Huang JY, Xu YY, Li M, et al. The prognostic impact of occult lymph node metastasis in node-negative gastric cancer: a systematic review and meta-analysis[J]. Ann Surg Oncol, 2013, 20(12): 3927-3934. DOI:10.1245/s10434-013-3021-7 |
| [6] |
Yamashita H, Deng J, Liang H, et al. Re-evaluating the prognostic validity of the negative to positive lymph node ratio in node-positive gastric cancer patients[J]. Surgery, 2017, 161(6): 1588-1596. DOI:10.1016/j.surg.2016.12.018 |
| [7] |
中华人民共和国国家卫生健康委员会. 胃癌诊疗规范(2018年版)[J]. 中华消化病与影像杂志(电子版), 2019, 9(3): 118-144. [National Health Commission of the People's Republic of China. Guidelines for the diagnosis and treatment of gastric cancer (2018 edition)[J]. Zhonghua Xiao Hua Bing Yu Ying Xiang Za Zhi (Dian Zi Ban), 2019, 9(3): 118-144. DOI:10.3877/cma.j.issn.2095-2015.2019.03.008] |
| [8] |
Hoshi H. Management of Gastric Adenocarcinoma for General Surgeons[J]. Surg Clin North Am, 2020, 100(3): 523-534. DOI:10.1016/j.suc.2020.02.004 |
| [9] |
Zhang N, Deng J, Wang W, et al. Negative lymph node count as an independent prognostic factor in stage Ⅲ patients after curative gastrectomy: A retrospective cohort study based on a multicenter database[J]. Int J Surg, 2020, 74: 44-52. DOI:10.1016/j.ijsu.2019.12.018 |
| [10] |
Min SH, Won Y, Lee K, et al. Laparoscopic gastrectomy and metastasectomy for stage Ⅳ gastric cancer[J]. Surg Endosc, 2021, 35(4): 1879-1887. DOI:10.1007/s00464-020-07592-7 |
| [11] |
Zhuo C, Ying M, Lin R, et al. Negative lymph node count is a significant prognostic factor in patient with stage Ⅳ gastric cancer after palliative gastrectomy[J]. Oncotarget, 2017, 8(41): 71197-71205. DOI:10.18632/oncotarget.17430 |
| [12] |
Jiang J, Chen J, Zhang H, et al. Combination of the ratio between metastatic and harvested lymph nodes and negative lymph node count as a prognostic indicator in advanced gastric cancer: a retrospective cohort study[J]. J Gastrointest Oncol, 2021, 12(5): 2022-2034. DOI:10.21037/jgo-21-212 |
| [13] |
In H, Solsky I, Palis B, et al. Validation of the 8th Edition of the AJCC TNM Staging System for Gastric Cancer using the National Cancer Database[J]. Ann Surg Oncol, 2017, 24(12): 3683-3691. DOI:10.1245/s10434-017-6078-x |
| [14] |
Sugawara K, Yamashita H, Uemura Y, et al. Numeric pathologic lymph node classification shows prognostic superiority to topographic pN classification in esophageal squamous cell carcinoma[J]. Surgery, 2017, 162(4): 846-856. DOI:10.1016/j.surg.2017.06.013 |
| [15] |
Yu L, Zhang XT, Guan SH, et al. The Number of Negative Lymph Nodes is Positively Associated with Survival in Esophageal Squamous Cell Carcinoma Patients in China[J]. Open Med (Wars), 2020, 15: 152-159. DOI:10.1515/med-2020-0023 |
| [16] |
Wu H, Liu C, Xu M, et al. Prognostic value of the number of negative lymph nodes in esophageal carcinoma without lymphatic metastasis[J]. Thorac Cancer, 2018, 9(9): 1129-1135. DOI:10.1111/1759-7714.12796 |
| [17] |
Ma M, Tang P, Jiang H, et al. Number of negative lymph nodes as a prognostic factor in esophageal squamous cell carcinoma[J]. Asia Pac J Clin Oncol, 2017, 13(5): e278-e283. DOI:10.1111/ajco.12567 |
| [18] |
Brunner M, Merkel S, Krautz C, et al. The Prognostic Value of the Number of Harvested Negative Lymph Nodes in Patients Treated by Esophagectomy With or Without Neoadjuvant Chemoradiation[J]. Anticancer Res, 2020, 40(5): 2833-2840. DOI:10.21873/anticanres.14257 |
| [19] |
Zhou L, Zhao Y, Zheng Y, et al. The Prognostic Value of the Number of Negative Lymph Nodes Combined with Positive Lymph Nodes in Esophageal Cancer Patients: A Propensity-Matched Analysis[J]. Ann Surg Oncol, 2020, 27(6): 2042-2050. DOI:10.1245/s10434-019-08083-3 |
| [20] |
Wang Y, Zhang X, Zhang X, et al. Prognostic value of the extent of lymphadenectomy for esophageal cancer-specific survival among T1 patients[J]. BMC Cancer, 2021, 21(1): 403. DOI:10.1186/s12885-021-08080-4 |
| [21] |
West NP, Hohenberger W, Weber K, et al. Complete mesocolic excision with central vascular ligation produces an oncologically superior specimen compared with standard surgery for carcinoma of the colon[J]. J Clin Oncol, 2010, 28(2): 272-278. DOI:10.1200/JCO.2009.24.1448 |
| [22] |
Quan Q, Zhu M, Liu S, et al. Positive impact of the negative lymph node count on the survival rate of stage Ⅲ colon cancer with pN1 and right-side disease[J]. J Cancer, 2019, 10(4): 1052-1059. DOI:10.7150/jca.23763 |
| [23] |
He WZ, Xie QK, Hu WM, et al. An increased number of negative lymph nodes is associated with a higher immune response and longer survival in colon cancer patients[J]. Cancer Manag Res, 2018, 10: 1597-1604. DOI:10.2147/CMAR.S160100 |
| [24] |
Sun Y, Zhang Y, Huang Z, et al. Prognostic Implication of Negative Lymph Node Count in ypN+ Rectal Cancer after Neoadjuvant Chemoradiotherapy and Construction of a Prediction Nomogram[J]. J Gastrointest Surg, 2019, 23(5): 1006-1014. DOI:10.1007/s11605-018-3942-3 |
| [25] |
Li X, Lu H, Xu K, et al. Negative lymph node count is an independent prognostic factor for patients with rectal cancer who received preoperative radiotherapy[J]. BMC Cancer, 2017, 17(1): 227. DOI:10.1186/s12885-017-3222-8 |
| [26] |
Cui J, Zhang L, Yang L, et al. The prognostic significance of the treatment response of regional lymph nodes and the refinement of the current TNM staging system in locally advanced rectal cancer after neoadjuvant chemoradiotherapy[J]. Cancer Med, 2020, 9(24): 9373-9384. DOI:10.1002/cam4.3553 |
| [27] |
Ogino S, Nosho K, Irahara N, et al. Negative lymph node count is associated with survival of colorectal cancer patients, independent of tumoral molecular alterations and lymphocytic reaction[J]. Am J Gastroenterol, 2010, 105(2): 420-433. DOI:10.1038/ajg.2009.578 |
| [28] |
Hickman L, Contreras C. Gallbladder Cancer: Diagnosis, Surgical Management, and Adjuvant Therapies[J]. Surg Clin North Am, 2019, 99(2): 337-355. DOI:10.1016/j.suc.2018.12.008 |
| [29] |
Krell RW, Wei AC. Gallbladder cancer: surgical management[J]. Chin Clin Oncol, 2019, 8(4): 36. DOI:10.21037/cco.2019.06.06 |
| [30] |
Lin JY, Bai DS, Zhou BH, et al. Positive relationship between number of negative lymph nodes and duration of gallbladder cancer cause-specific survival after surgery[J]. Cancer Manag Res, 2018, 10: 6961-6969. DOI:10.2147/CMAR.S187857 |
| [31] |
Hong EK, Kim KK, Lee JN, et al. Surgical outcome and prognostic factors in patients with gallbladder carcinoma[J]. Korean J Hepatobiliary Pancreat Surg, 2014, 18(4): 129-137. DOI:10.14701/kjhbps.2014.18.4.129 |
| [32] |
Conci S, Ruzzenente A, Sandri M, et al. What is the most accurate lymph node staging method for perihilar cholangiocarcinoma? Comparison of UICC/AJCC pN stage, number of metastatic lymph nodes, lymph node ratio, and log odds of metastatic lymph nodes[J]. Eur J Surg Oncol, 2017, 43(4): 743-750. DOI:10.1016/j.ejso.2016.12.007 |
| [33] |
Gao Y, Xu D, Wu YS, et al. Increasing negative lymph node count is independently associated with improved long-term survival in resectable perihilar cholangiocarcinomas[J]. Medicine (Baltimore), 2019, 98(15): e14943. DOI:10.1097/MD.0000000000014943 |
| [34] |
Wang X, Yin Z, Wang D, et al. Greater negative lymph node count predicts favorable survival of patients with breast cancer in the setting of neoadjuvant chemotherapy and mastectomy[J]. Future Oncol, 2019, 15(32): 3701-3709. DOI:10.2217/fon-2019-0439 |
| [35] |
Yang J, Long Q, Li H, et al. The value of positive lymph nodes ratio combined with negative lymph node count in prediction of breast cancer survival[J]. J Thorac Dis, 2017, 9(6): 1531-1537. DOI:10.21037/jtd.2017.05.30 |
| [36] |
Wang QX, Cai YF, Chen YY, et al. Additional Prognostic Value of Lymph Node Ratio (LNR) and Number of Negative Lymph Nodes (NLNs) in Chinese Patients with Triple Negative Breast Cancer[J]. Ann Clin Lab Sci, 2017, 47(1): 68-75. |
| [37] |
Zhao X, Wei J, Li X, et al. Increasing negative lymph node count predicts favorable OS and DSS in breast cancer with different lymph node-positive subgroups[J]. PLoS One, 2018, 13(3): e0193784. DOI:10.1371/journal.pone.0193784 |
| [38] |
Abd-Elhay FA, Elhusseiny KM, Kamel MG, et al. Negative Lymph Node Count and Lymph Node Ratio Are Associated With Survival in Male Breast Cancer[J]. Clin Breast Cancer, 2018, 18(6): e1293-e1310. DOI:10.1016/j.clbc.2018.07.003 |
| [39] |
Wang H, Zhang C, Kong L, et al. Better survival in PMRT of female breast cancer patients with > 5 negative lymph nodes: A population-based study[J]. Medicine (Baltimore), 2017, 96(4): e5998. DOI:10.1097/MD.0000000000005998 |
| [40] |
Zhou X, Wu C, Cheng Q. Negative Lymph Node Count Predicts Survival of Resected Non-small Cell Lung Cancer[J]. Lung, 2020, 198(5): 839-846. DOI:10.1007/s00408-020-00378-7 |
| [41] |
Liu H, Yan T, Zhang T, et al. Proposal of a new nodal classification for operable non-small cell lung cancer based on the number of negative lymph nodes and the anatomical location of metastatic lymph nodes[J]. Medicine (Baltimore), 2019, 98(20): e15645. DOI:10.1097/MD.0000000000015645 |
| [42] |
Wang S, Zhang B, Li C, et al. Prognostic value of number of negative lymph node in patients with stage Ⅱ and Ⅲa non-small cell lung cancer[J]. Oncotarget, 2017, 8(45): 79387-79396. DOI:10.18632/oncotarget.18154 |
| [43] |
Lu H, Guo R, Yang H, et al. The prognostic value of negative lymph node count for patients with cervical cancer after radical surgery[J]. Oncotarget, 2017, 9(2): 2810-2818. |
| [44] |
Bao X, Chen F, Qiu Y, et al. Log Odds of Positive Lymph Nodes is Not Superior to the Number of Positive Lymph Nodes in Predicting Overall Survival in Patients With Oral Squamous Cell Carcinomas[J]. J Oral Maxillofac Surg, 2020, 78(2): 305-312. DOI:10.1016/j.joms.2019.09.026 |
| [45] |
Morgagni P, Saragoni L, Scarpi E, et al. Lymph node micrometastases in early gastric cancer and their impact on prognosis[J]. World J Surg, 2003, 27(5): 558-561. DOI:10.1007/s00268-003-6797-y |
| [46] |
Kim JJ, Song KY, Hur H, et al. Lymph node micrometastasis in node negative early gastric cancer[J]. Eur J Surg Oncol, 2009, 35(4): 409-414. DOI:10.1016/j.ejso.2008.05.004 |
| [47] |
Mogoantă SŞ, Calotă F, Vasile I, et al. Histological and immunohistochemical study on sentinel lymph node in colorectal cancer-values and limitations[J]. Rom J Morphol Embryol, 2016, 57(1): 65-74. |
| [48] |
Gu P, Deng J, Wang W, et al. Impact of the number of examined lymph nodes on stage migration in node-negative gastric cancer patients: a Chinese multi-institutional analysis with propensity score matching[J]. Ann Transl Med, 2020, 8(15): 938. DOI:10.21037/atm-19-4727 |
| [49] |
Zhuo C, Xu Y, Ying M, et al. FOXP3+ Tregs: heterogeneous phenotypes and conflicting impacts on survival outcomes in patients with colorectal cancer[J]. Immunol Res, 2015, 61(3): 338-347. DOI:10.1007/s12026-014-8616-y |
| [50] |
Battaglia A, Buzzonetti A, Baranello C, et al. Metastatic tumour cells favour the generation of a tolerogenic milieu in tumour draining lymph node in patients with early cervical cancer[J]. Cancer Immunol Immunother, 2009, 58(9): 1363-1373. DOI:10.1007/s00262-008-0646-7 |
| [51] |
Cai Z, Ma J, Li S, et al. Impact of microsatellite status on negative lymph node count and prognostic relevance after curative gastrectomy[J]. J Surg Oncol, 2021, 123 Suppl 1: S15-S24. |
| [52] |
Nakakubo Y, Miyamoto M, Cho Y, et al. Clinical significance of immune cell infiltration within gallbladder cancer[J]. Br J Cancer, 2003, 89(9): 1736-1742. DOI:10.1038/sj.bjc.6601331 |
| [53] |
George S, Primrose J, Talbot R, et al. Will Rogers revisited: prospective observational study of survival of 3592 patients with colorectal cancer according to number of nodes examined by pathologists[J]. Br J Cancer, 2006, 95(7): 841-847. DOI:10.1038/sj.bjc.6603352 |
| [54] |
Canday-Alvarez A, Gil-Campos M, De la Torre-Aguilar MJ, et al. Early Modification in Drainage of Interleukin-1β and Tumor Necrosis Factor-α Best Predicts Surgical-Site Infection After Cervical Neck Dissection for Oral Cancer[J]. J Oral Maxillofac Surg, 2015, 73(6): 1189-1198. DOI:10.1016/j.joms.2014.12.023 |
 2022, Vol. 49
2022, Vol. 49