文章信息
- T1~T2期乳腺癌保乳术后化疗后程同步大分割放疗前瞻性Ⅰ期临床研究
- A Prospective Phase Ⅰ Clinical Study of Docetaxel with Concurrent Late-course Hyperfractionated Radiotherapy After Breast-conserving Surgery for Stage T1-T2 Breast Cancer
- 肿瘤防治研究, 2022, 49(10): 1054-1058
- Cancer Research on Prevention and Treatment, 2022, 49(10): 1054-1058
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2022.21.1295
- 收稿日期: 2021-11-09
- 修回日期: 2022-05-06
2. 430060 武汉,武汉大学人民医院肿瘤中心
2. Department of Oncology, Renmin Hospital of Wuhan University, Wuhan 430060, China
数据分析表明,与全乳切除术相比,早期乳腺癌保乳术生存更佳[1]。目前,保乳手术联合术后放疗是标准的局部区域治疗方式,术后放疗通常在术后化疗完成后进行[2]。我国当前普遍采用的乳腺癌术后常规分割放疗至少持续5~6周时间[3-4],周期长,费用高。越来越多高级别证据表明,同步放化疗局部控制疗效确切,在头颈部癌、肺癌、食管癌、宫颈癌及直肠癌等恶性肿瘤放疗相关指南中得到广泛推荐和临床运用,但尚未被推荐进入乳腺癌治疗相关指南,尽管其安全性和有效性已有报道[5-7]。湖北省肿瘤医院放疗中心开展了T1~T2期乳腺癌保乳术后化疗后程多西他赛同步大分割放疗的前瞻性研究(注册号:ChiCTR1800018363),旨在观察其初步效果及该方案的安全性、近期疗效及其卫生经济学价值。
1 资料与方法 1.1 纳入与排除标准纳入标准:(1)年龄≥18岁,且 < 70岁的女性患者;(2)身体状态ECOG评分0~2分或KPS≥70;(3)手术方式为保乳术;(4)经病理学诊断为浸润性乳腺癌;(5)术后需要进行化疗和放疗;(6)无主要器官的功能障碍,血常规、肝肾功能及心肺功能正常;(7)在放疗之前的化疗过程中,无四度骨髓抑制,或者出现三度骨髓抑制后升白治疗反应良好,无严重的肝功能损害,或者出现功能异常但护肝治疗5天后效果良好;(8)签署知情同意书,具有较好的依从性。排除标准:(1)未按计划进行术后化疗的患者;(2)患有严重的合并症或者其他疾病等不能耐受同步放化疗;(3)可能干扰试验结果或增加患者风险的任何病史;(4)患有严重的基础疾病;(5)在放疗之前的化疗过程中,出现严重不良反应,经过处理无法逆转或者逆转所需时间 > 1周者;(6)拒绝或不能签署参与试验的知情同意书者;(7)有远处转移或研究者认为不适合参加该试验的任何其他情况。本研究获湖北省肿瘤医院伦理委员会批准。
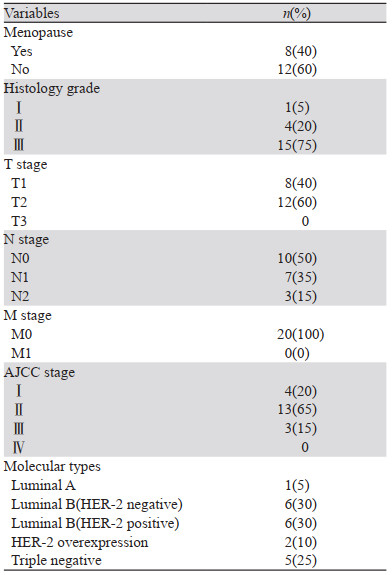
1.2 一般资料2018年8月—2019年12月间,共入组20例T1~T2期乳腺癌保乳术后患者,年龄30~63岁(平均年龄46.5±7.6岁);无特殊家族史及既往史;病理类型均为浸润性导管癌;3例术前化疗(15%)。病灶位于左乳11例,右乳9例,见表 1。
|
在乳腺癌术后化疗5个周期后开始进行放疗前评估,符合纳入标准的患者在末次化疗前开始放疗。化疗方案为术后标准辅助化疗方案:吡喃阿霉素+环磷酰胺或表阿霉素+环磷酰胺序贯多西他赛或多西他赛+赫赛汀(AC/EC→T/TH),后程多西他赛化疗剂量同术后辅助方案均为100 mg/m2[3-4]。放疗采用大分割方式,放疗区域为乳腺靶区(腋窝淋巴结有转移的患者包括锁骨上下区+/-内乳),第一阶段全乳+/-区域淋巴结照射(区域淋巴结包括锁骨上下区+/-内乳),每次2.66 Gy,共16次;第二阶段瘤床加量,每次2.9 Gy,共3次[3-4]。
1.4 观测指标主要指标:急性放射反应分级(RTOG分级)、治疗完成率;次要指标:无局部区域复发生存期、住院时间等。复查血常规、肝肾功能、心电图、心脏彩超、肺部CT,观察患者局部皮肤改变及美容效果。疗效评价标准参考RECIST1.1。
1.5 统计学方法描述性统计分析,生存时间统计从治疗结束之日起至2021年9月30日。
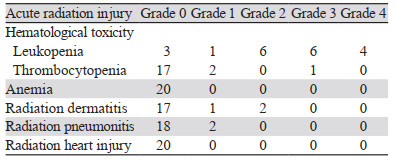
2 结果 2.1 急性放射反应使用RTOG分级系统评估与放疗相关的毒性,血液学毒性3级及以上11例(55%),其中白细胞减少达3级及以上有10例,血小板减少达3级及以上1例,无发热性中性粒细胞减少症发生。放射性皮炎1级患者1例,2级患者有2例,未观察到3级及以上患者。放射性肺炎1级患者2例,未观察到2级及以上放射性肺炎。无急性放射性心脏损伤病例,见表 2。
|
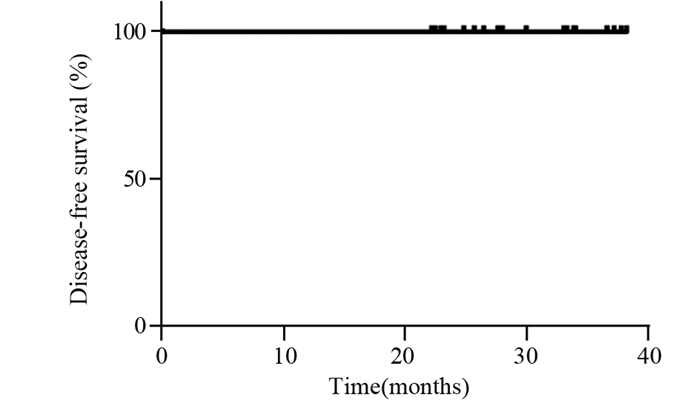
治疗结束后2年内每3个月随访1次,2~5年内每半年随访1次,5年后每年随访1次。对所有患者进行随访,截至2021年9月30日,随访率100%,随访时间21.3~37.1月,中位随访时间为30.1个月,21个月局部区域控制率、无病生存率均为100%,见图 1。随访期间患者肺部CT、心电图、心脏彩超均无2级及以上改变。随访期内,未观测到远期反应(如:皮肤纤维化、放射性肺炎、放射性心脏损伤等)。治疗完成率及乳房美容效果良好率达到100%。
|
| 图 1 保乳术后化疗后程同步大分割放疗患者的无病生存率 Figure 1 Disease-free survival rate of patients who received docetaxel with concurrent late-course hyperfractionated radiotherapy after breast-conserving surgery |
放疗开始时间提前于末次化疗时间为18.8±14.5(1~56)天,中位提前时间15.5天,将患者治疗时间提前,患者的住院时间相对缩短约2周。患者平均总放疗时间为4周,同步放化疗使得总治疗时间缩短约1.5个月。在化疗期间进行放疗定位和计划,节省住院时间1周;化疗和放疗同步进行,化疗当天停止放疗,节省住院时间10天,总住院时间缩短约0.5个月,总住院治疗费用节省约1万元。
3 讨论随着医学技术的进步和社会生活水平的提高,人们对肿瘤的治疗期望从以前“求生存”过渡到现在“求质量”。近年来我国正在快速完善的“两癌筛查”活动,使得早期乳腺癌的占比显著提高,促进了保乳手术的发展。乳腺癌的化疗及放疗技术也发生了深刻的变化,如何将放疗、化疗重新“排兵布阵”,与手术、靶向及免疫治疗等有机地融合在一起以获得最佳效果成为研究的热点[8-10]。其中放疗和化疗的抗肿瘤作用机制不同,放疗通过控制局部复发,可提高局控率,有学者认为保乳手术具有稳定肿瘤周围微环境的作用,放疗或可借此激发抗肿瘤免疫反应从而减少乳腺癌远处复发,延长生存期。化疗则主要消灭微小转移病灶,减少局部肿瘤负荷,减少全身肿瘤复发,降低复发率。保乳术后患者可选择放疗、化疗、同步或序贯放化疗。研究表明,Ⅰ~Ⅱ期乳腺癌保乳术后5年局部复发率为2.5%~8.5%,10年累积局部复发率为10%~15%[11]。无论是先化疗后放疗,还是三明治疗法(化疗+放疗+化疗),都会因治疗时间的延长,增加肿瘤复发的可能性。目前发现早期乳腺癌患者保乳术后序贯化疗较序贯放疗的生存更好,其8年无病生存率分别为90.4%和83.1%(P=0.005)[12]。而同步放化疗不仅可以缩短治疗时间,而且其增加肿瘤局部控制的疗效确切,使其在头颈部癌、肺癌、食管癌、宫颈癌及直肠癌等恶性肿瘤放疗相关指南中得到广泛推荐和临床运用[13-14]。放疗模式的改变也逐渐影响治疗方案的制定,大分割放疗与常规放疗相比,具有次数少,住院时间短及医疗费用低的优势,其疗效也不劣于常规放疗。例如欧洲指南将大分割放疗作为局部晚期的局限期小细胞肺癌的首选,大分割放疗正在逐渐取代常规放疗[15]。
对乳腺癌放疗联合化疗的治疗模式的研究进展并无头颈部癌、肺癌、食管癌、宫颈癌及直肠癌等肿瘤进展得顺利。虽然乳腺癌根治术后同步放化疗的研究较多,但国内保乳术后同步放化疗(常规分割)的研究报道较少。国外一项Ⅲ期随机对照研究显示早期乳腺癌术后序贯与同步放化疗对比,两组局部复发及远处转移差异无统计学意义,在无病生存和总生存方面差异也无统计学意义[16]。国内一项回顾性研究[17]显示,保乳术后同步放化疗及序贯放化疗两组在局部复发率、远处转移率及生存率方面差异无统计学意义,但在血液学毒性及放射性皮炎方面,同步组高于序贯组。显而易见,同步放化疗的缺点是治疗不良反应增加,患者耐受性下降;优点是在不降低治疗疗效的前提下,缩短了患者总治疗时间及总住院时间,从而降低患者的治疗费用,有较高的卫生经济学价值,但并不为指南所推荐。
因此,有必要探讨如何通过改变放疗模式达到降低不良反应的目的,大分割放疗同步化疗是否优于常规放疗同步化疗这种治疗模式。目前对于保乳手术后的早期乳腺癌患者,与常规放疗相比,大分割放疗降低了发生不良反应的风险[18],而且保乳术后放疗模式已经逐渐从常规放疗转变为大分割放疗[19],本研究也正是基于这一放射治疗技术的进步,采用大分割放疗,进一步起到非劣效性作用:即同步大分割放疗,可减少严重不良反应,如急性皮肤毒性、硬结、乳房萎缩和疼痛,且在不影响乳房美容效果的情况下[20],缩短治疗和住院时间,为每位进行该项治疗的乳腺癌患者减少约半个月住院时间,节省了国家医疗资源,提高卫生经济学价值。本文同步放化疗方案虽然出现较高概率的血液学毒性,但其不良反应可控。目前未观测到其对疗效的影响,该方案的长期生存数据有待后续随访及进一步扩大样本量。总之早期乳腺癌保乳术后化疗后程多西他赛同步大分割放疗的治疗模式值得进一步探讨。
作者贡献:
熊宇迪:采集数据、撰写文章
张学:采集及分析临床数据
邹宁、牟晶晶、李本辉、陈卫东:修改文章
廖玲霞、张九成:总体构思设计、文章审阅
| [1] |
Barnard K, Klimberg VS. An update on randomized clinical trials in breast cancer[J]. Surg Oncol Clin N Am, 2017, 26(4): 587-620. DOI:10.1016/j.soc.2017.05.013 |
| [2] |
Wallgren A, Bernier J, Gelber RD, et al. Timing of radiotherapy and chemotherapy following breast-conserving surgery for patients with node-positive breast cancer. International Breast Cancer Study Group[J]. Int J Radiat Oncol Biol Phys, 1996, 35(4): 649-659. DOI:10.1016/0360-3016(96)00186-1 |
| [3] |
中国抗癌协会乳腺癌专业委员会. 中国抗癌协会乳腺癌诊治疗指南与规范(2017年版)[J]. 中国癌症杂志, 2017, 27(9): 695-759. [Chinese Anti-Cancer Association Breast Cancer Professional Committee. Chinese Anti-Cancer Association Breast Cancer Diagnosis and Treatment Guidelines and Standards (2017)[J]. Zhongguo Ai Zheng Za Zhi, 2017, 27(9): 695-759.] |
| [4] |
中国抗癌协会乳腺癌专业委员会. 中国抗癌协会乳腺癌诊治指南与规范(2021年版)[J]. 中国癌症杂志, 2021, 31(10): 954-1040. [Chinese Anti-Cancer Association Breast Cancer Professional Committee. Chinese Anti-Cancer Association Breast Cancer Diagnosis and Treatment Guidelines and Standards(2021)[J]. Zhongguo Ai Zheng Za Zhi, 2021, 31(10): 954-1040.] |
| [5] |
Arcangeli G, Pinnaro P, Rambone R, et al. A phase iii randomized study on the sequencing of radiotherapy and chemotherapy in the conservative management of early-stage breast cancer[J]. Int J Radiat Oncol Biol Phys, 2006, 64(1): 161-167. DOI:10.1016/j.ijrobp.2005.06.040 |
| [6] |
Livi L, Saieva C, Borghesi S, et al. Concurrent cyclophosphamide, methotrexate, and 5-fluorouracil chemotherapy and radiotherapy for early breast carcinoma[J]. Int J Radiat Oncol Biol Phys, 2008, 71(3): 705-709. DOI:10.1016/j.ijrobp.2007.10.042 |
| [7] |
Ismaili N, Mellas N, Masbah O, et al. Concurrent chemoradiotherapy in adjuvant treatment of breast cancer[J]. Radiat Oncol, 2009, 4: 12. DOI:10.1186/1748-717X-4-12 |
| [8] |
Derks MGM, Bastiaannet E, Kiderlen M, et al. Variation in treatment and survival of older patients with non-metastatic breast cancer in five european countries: A population-based cohort study from the eurecca breast cancer group[J]. Br J Cancer, 2018, 119(1): 121-129. DOI:10.1038/s41416-018-0090-1 |
| [9] |
Harbeck N. Emerging strategies in neoadjuvant treatment of patients with her2-positive early breast cancer[J]. Breast, 2019, 48 Suppl 1: S97-S102. |
| [10] |
Mano MS, Oliveira LJC, Hanna SA. Integrating adjuvant radiation with post-neoadjuvant therapies in early breast cancer[J]. Curr Oncol Rep, 2021, 23(5): 58. DOI:10.1007/s11912-021-01050-w |
| [11] |
van der Hage JA, Putter H, Bonnema J, et al. Impact of locoregional treatment on the early-stage breast cancer patients: A retrospective analysis[J]. Eur J Cancer, 2003, 39(15): 2192-2199. DOI:10.1016/S0959-8049(03)00572-0 |
| [12] |
Chen SY, Tang Y, Wang SL, et al. Timing of Chemotherapy and Radiotherapy Following Breast-Conserving Surgery for Early-Stage Breast Cancer: A Retrospective Analysis[J]. Front Oncol, 2020, 10: 571390. DOI:10.3389/fonc.2020.571390 |
| [13] |
Sun H, Liu C, Zhang J, et al. Twice-daily thoracic radiotherapy by intensity-modulated radiation therapy (IMRT) compared with simultaneous integrated boost IMRT (SIB-IMRT) with concurrent chemotherapy for patients with limited-stage small cell lung cancer. A propensity-score matched analysis[J]. Radiother Oncol, 2022, 172: 140-146. DOI:10.1016/j.radonc.2022.01.022 |
| [14] |
Liu Y, Zheng Z, Li M, et al. Comparison of concurrent chemoradiotherapy with radiotherapy alone for locally advanced esophageal squamous cell cancer in elderly patients: A randomized, multicenter, phase ii clinical trial[J]. Int J Cancer, 2022, 151(4): 607-615. DOI:10.1002/ijc.34030 |
| [15] |
Saeed NA, Jin L, Sasse AW, et al. Hypofractionated vs. Standard radiotherapy for locally advanced limited-stage small cell lung cancer[J]. J Thorac Dis, 2022, 14(2): 306-320. DOI:10.21037/jtd-21-1566 |
| [16] |
Toledano A, Azria D, Garaud P, et al. Phase Ⅲtrial of concurrent or sequential adjuvant chemoradiotherapy after conservative surgery for early-stage breast cancer: Final results of the ARCOSEIN trial[J]. J Clin Oncol, 2007, 25(4): 405-410. DOI:10.1200/JCO.2006.07.8576 |
| [17] |
耿冬梅, 张良明, 隋洺骅. 乳腺癌保乳术后同步放化疗的临床研究[J]. 中外医学研究, 2013, 11(7): 14-16. [Geng DM, Zhang LM, Sui MH. Clinical study of concurrent chemoradiotherapy after breast conserving surgery for breast cancer[J]. Zhong Wai Yi Xue Yan Jiu, 2013, 11(7): 14-16.] |
| [18] |
Gu L, Dai W, Fu R, et al. Comparing hypofractionated with conventional fractionated radiotherapy after breast-conserving surgery for early breast cancer: A meta-analysis of randomized controlled trials[J]. Front Oncol, 2021, 11: 753209. |
| [19] |
Kang MM, Hasan Y, Waller J, et al. Has hypofractionated whole-breast radiation therapy become the standard of care in the united states? An updated report from national cancer database[J]. Clin Breast Cancer, 2022, 22(1): e8-e20. |
| [20] |
邓垒, 惠周光, 王淑莲, 等. 早期乳腺癌保乳术后大分割三维放疗Ⅱ期临床观察[J]. 中华放射肿瘤学杂志, 2013, 22(1): 1-4. [Deng L, Hui ZG, Wang SL, et al. Phase Ⅱ clinical trial of central hypofractionated three-dimensional radiotherapy for patients with early-stage breast cancer after breast-conserving surgery[J]. Zhonghua Fang She Zhong Liu Xue Za Zhi, 2013, 22(1): 1-4.] |
 2022, Vol. 49
2022, Vol. 49


