文章信息
- 甲磺酸阿帕替尼治疗晚期转移性腺泡状软组织肉瘤1例
- A Case Report of Apatinib Mesylate in Treatment of Advanced Alveolar Soft Part Sarcoma with Multiple Metastases
- 肿瘤防治研究, 2022, 49(6): 634-636
- Cancer Research on Prevention and Treatment, 2022, 49(6): 634-636
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2022.21.1236
- 收稿日期: 2021-11-01
- 修回日期: 2022-03-16
腺泡状软组织肉瘤(alveolar soft part sarcoma, ASPS)是一种十分罕见的软组织肉瘤,常见于青、少年,发病率仅占所有软组织肉瘤的1%[1]。ASPS的特点是肿瘤生长缓慢,因症状不明显而常被忽视。与其他类型肉瘤不同的是,ASPS极易发生转移,如肺转移(90%)、骨转移(26%)、脑转移(11%~19%)和其他部位转移(24%)[1]。治疗上以手术治疗为主,术后辅以放化疗,对于化疗不敏感,靶向药物联合化疗的综合治疗国内外较罕见。2013年7月我科收治1例大腿ASPS手术后复发伴双肺转移的患者,全身化疗后出现颅脑转移,继发癫痫,进而局部伽马刀治疗等一系列治疗无效,病情持续进展,在给予阿帕替尼联合替莫唑胺口服治疗后,肺部转移灶明显缩小,脑转移病灶基本稳定,且未再次出现癫痫发作,现报道如下。
1 临床资料患者,男,35岁,2013年2月因发现左侧大腿“肿块”,于当地县医院行肿块切除术,术后病检提示:腺泡肉瘤。后因“咳嗽”复查PET-CT提示:双肺转移。给予GT(吉西他滨1.2 g/m2,d1、d8;多西他赛120 mg,d1,静脉滴注)化疗3周期;因病情进展,于2013年7月就诊于我院给予异环磷酰胺联合顺铂化疗(IFO 2.0 g, d1~4, DDP 35 mg, d1~2)2周期。2016年2月因“头痛、癫痫”行颅脑MRI示:右侧顶叶脑肿瘤伴明显强化及水肿,给予颅脑伽马刀局部治疗(2 960 Gy,8次),仍有癫痫小发作。2016年7月22日复查胸部CT提示双肺病情进展,最大约4.7 cm×6.7 cm,见图 1-A1。颅脑MRI提示颅脑右侧额顶叶及两侧顶叶见多发肿块,最大位于右侧顶叶,大小约2.2 cm×2.0 cm,见图 1-A2。查体:神志清楚,体检配合,双肺呼吸音清,未闻及明显干湿性啰音,心律齐,未闻及杂音,腹部平软无压痛,肝脾肋下未及,左上肢肌力3级,左下肢肌力4级,双下肢无水肿。血常规、肝肾功能、电解质基本正常。于2016年11月18日开始给予甲磺酸阿帕替尼片500 mg,每天1次,替莫唑胺胶囊100 mg,每天1次,d1~5,28天/周期。口服治疗3月后,于2017年2月胸部CT示两肺多发转移瘤较前缩小,见图 1-B1。颅脑MRI提示右顶叶转移瘤较前明显缩小,见图 1-B2。口服1年后复查胸部CT及颅脑MRI提示,胸部病灶继续缩小,左肺病灶基本消退,疗效评估,部分缓解(partial response, PR),见图 1-C1,右侧顶叶转移瘤基本稳定,见图 1-C2。第1期口服过程出现轻度腹泻,2次/日,呈水样便,给予止泻补液治疗后,症状缓解。第2期出现手掌脚跟瘙痒及脱皮、疼痛,给予尿素软膏外擦、营养神经治疗后,手足部皮损及疼痛均明显缓解。2018年3月因“头晕、腹泻”入院,每日监测血压,收缩压最高145 mmHg,诊断为继发性高血压,口服伲福达每天20 mg,后血压基本维持正常。查大便常规:基本正常。复查胸部CT及颅脑MRI,肺部病灶及颅脑病灶基本稳定。出院建议:继续口服阿帕替尼500 mg,每天1次,替莫唑胺胶囊100 mg,每天1次,d1~5,28天/周期,定期复查。
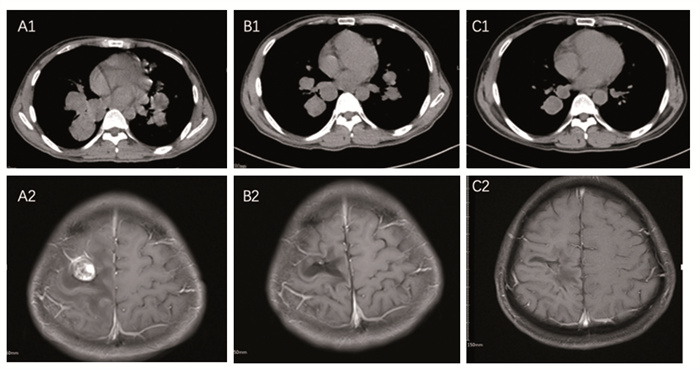
|
| A1: bilateral lung lesions(A1) and right parietal lobe mass(A2) before the oral medications; bilateral lung lesions(B1) and right parietal lobe mass(B2) three months after the oral medications; bilateral lung lesions(C1) and right parietal lobe mass(C2) 1-year after the oral medications. 图 1 双肺病灶CT及颅脑右顶叶病灶MRI表现 Figure 1 Bilateral lung lesions and right parietal lobe mass examined by CT and MRI |
ASPS是一种分化良好的脂肪肉瘤/非典型性脂肪瘤性肿瘤,在软组织肉瘤中发病率不到1%,并且对细胞毒性化疗药物治疗不敏感。ASPS首次被学者Christopherson在1952年进行描述[2],常发生在下肢,大部分发生在大腿及臂部。女性多于男性,年轻人和青少年多于老年人。ASPS生长缓慢,但容易发生转移,特别是在疾病早期。有时转移灶甚至早于原发灶被发现[3]。
近10年来,抗血管生成疗法(antiangiogenic therapies, AAT)的出现,改善了晚期转移性软组织肉瘤患者的总体生存,这些药物分别在Ⅱ期(REGOSARC[4])和Ⅲ期临床研究(PALETTE[5])中疗效显著,Ⅲ期帕唑帕尼的单药研究中,帕唑帕尼相较于安慰剂组,PFS延长了3月(4.6月vs. 1.6月, P < 0.0001), OS较安慰剂组延长了1.8月,但OS结果差异无统计学意义(12.5月vs. 10.7月, P=0.25)[5]。意大利Stacchiotti教授回顾性分析了30例接受帕唑帕尼治疗的ASPS患者,其中13例既往使用过抗血管治疗,随访19月,中位PFS为13.6月(1.6~32.3月),1年PFS率为59%,中位OS未达到,而接受烷化剂的患者,其中位PFS仅3.7月(0.7~109月),1年PFS率为13%,中位OS为9.1月[6]。舒尼替尼同样疗效显著,Stacchiottic教授指出,晚期进展期ASPS患者,使用舒尼替尼的ORR达到55.6%,9例患者中,5例达到了PR,3例SD,而总体PFS达到17月。对5例患者的冷冻标本进行了短时间的细胞增殖和生化实验,发现舒尼替尼能有效抑制ASPS细胞的生长,并且关闭了血小板衍生生长因子受体β(platelet-derived growth factor receptor beta, PDGFRB), 流式细胞学及共聚焦显微镜显示ASPS细胞的PDGFRB/VEGFR2和RET/VEGFR2存在共表达及相关性[7]。
作为新型VEGFR-2酪氨酸激酶抑制剂,2014年甲磺酸阿帕替尼被cFDA批准用于治疗既往接受过二种系统化疗后病情持续进展的晚期胃癌,可以选择性竞争血管内皮生长因子受体2(VEGFR-2)的ATP结合位点,阻断下游信号通路,抑制肿瘤血管生成[8-9]。这一机制为肉瘤提供了新的治疗选择,包括血管肉瘤、恶性纤维组织细胞瘤和黏液样/圆细胞型脂肪肉瘤[10-12]。体外研究提示阿帕替尼抑制VEGFR-2、c-kit和c-Src的激酶活性,同时抑制VEGFR-1、c-kit和PDGFRβ的磷酸化[13]。
目前,蒽环类化疗失败后的Ⅳ期软组织肉瘤(soft tissue sarcoma, STS)尚无标准治疗方案,2019年,一项纳入42例阿帕替尼单药治疗化疗失败后Ⅳ期STS的Ⅱ期临床研究中,38例可评估患者中,ORR和DCR分别达到23.68%和57.89%,中位PFS为7.87月,中位OS为17.55月,最常见的1~3级不良反应(adverse ekect, AE)包括高血压(42.86%)、手足综合征(35.71%)、厌食(30.95%)和蛋白尿(26.19%),无4级以上严重AE,该研究是目前为止国内最大的阿帕替尼单药治疗转移性STSⅡ期研究;与其他抗血管类药物,如帕唑帕尼、舒尼替尼、索拉非尼和安罗替尼相比,有效性数据方面更胜一筹,但是ASPS患者仅5例,且仅有1例SD[14]。一线治疗方面,有研究回顾性分析了阿帕替尼在转移性ASPS中的疗效及安全性,6例患者的中位PFS达到18.53月(95%CI: 12.23-NE),中位OS未达到。2年的PFS和OS率分别为50%和100%。最常见不良反应有胃肠道不适(66.7%)、头发色素减退(66.7%)和手足综合征(50%)[15]。除1例患者在阿帕替尼治疗前接受了GT化疗(吉西他滨1000 mg/m2,d1和多西他赛75 mg/m2, d8),余5例患者均为一线治疗[15]。与多线化疗耐药后相比,一线给予阿帕替尼,似乎具有更高的有效性及PFS和OS。
该病例中,在接受了多线全身化疗及伽马刀颅脑局部治疗后,胸部及颅脑影像学提示病情持续进展,且咳嗽加重,同时伴有左半身肌力减退,患者拒绝继续接受静脉化疗。随即给予阿帕替尼口服(每天500 mg)和替莫唑胺(每天100 mg,第1~5天)。口服治疗1月后,双肺病灶稍缩小,患者咳嗽明显减轻。3月后双肺病灶明显缩小,同时右顶叶转移瘤较前明显缩小,患者未再次出现癫痫发作,自觉左下肢肌力较前恢复。口服1年后,肺部病灶继续缩小,同时左肺病灶基本消退,疗效评估PR。与此同时,右颅脑病灶基本稳定。安全性方面,患者在刚开始口服半年内,仅出现轻度的腹泻及手足综合征,给予止泻、营养神经、尿素软膏外用涂擦后,腹泻、手足综合征症状明显缓解;口服1年后出现继发性高血压,口服伲福达降压处理后,基本维持正常,这些不良反应患者均可耐受,均未对患者生活造成不良影响。
新型的多靶点激酶抑制剂安罗替尼通过高亲和性结合靶点VEGFR-2, -3和FGFR-1, -2, -3, -4,从而抑制VEGF/VEGFR通路,同时选择性抑制PDGFRα/β、c-Kit、Ret、c-FMS和DDR1,达到抑制肿瘤生长的目的[16]。接受蒽环类化疗失败的复发转移性软组织肉瘤患者,继续口服安罗替尼的ORR为13%(95%CI: 7.6~18%),中位PFS和OS分别为5.6月和12月,亚组分析中,ASPS的ORR为77%,中位PFS为21月,中位OS尚未达到[17]。
患者于2019年5月因头痛加重,复查颅脑病灶进展,给予颅脑局部立体定向放疗联合阿帕替尼口服,颅脑病灶稍缩小,2020年6月再次因颅脑病灶进展入院,后改用安罗替尼口服治疗。后当地医院复查影像提示颅脑水肿消退,颅脑病灶基本稳定,持续安罗替尼单药口服至今。对于接受化疗后失败的晚期ASPS患者,目前以抗血管生成治疗为主,包括舒尼替尼、帕唑帕尼,安罗替尼也于2019年7月获批用于软组织肉瘤的二线治疗,而关于阿帕替尼用于一线或者二线以上ASPS的数据,因其低发病率,尚没有大规模的临床研究数据,仅为小样本回顾性研究,药物的可及性和经费问题,患者选择了阿帕替尼,从最近国内外的临床研究来看,二线使用单药阿帕替尼,患者总生存获益,且安全可靠,同时总费用明显低于其他抗血管生成类药物,利于患者长期口服。目前该报道为个案,缺少大规模随机对照研究,且阿帕替尼目前尚未获批在肉瘤中使用,具有一定的局限性,但是对于该患者,在靶向治疗的时代,因为新药的诞生,目前持续获益。
作者贡献:
朱贤敏:病例筛选、论文撰写
董爽:资料收集
汤静:资料整理
谢蓉:写作指导
钟易:查阅文献
吴辉菁:文章校对
胡胜:论文修改、指导研究方向
| [1] |
Paoluzzi L, Makir G. Diagnosis, Prognosis, and Treatment of Alveolar Soft-Part Sarcoma: A Review[J]. JAMA Oncol, 2019, 5(2): 254-260. DOI:10.1001/jamaoncol.2018.4490 |
| [2] |
Christopherson WM, Footef Jr F, Stewart FW. Alveolar soft-part sarcomas; structurally characteristic tumors of uncertain histogenesis[J]. Cancer, 1952, 5(1): 100-111. DOI:10.1002/1097-0142(195201)5:1<100::AID-CNCR2820050112>3.0.CO;2-K |
| [3] |
Singh A, Gupta S, Ghosh S, et al. Alveolar soft part sarcoma[J]. BMJ Case Rep, 2014, 2014: bcr2013203386. DOI:10.1136/bcr-2013-203386 |
| [4] |
Mir O, Brodowicz T, Italiano A, et al. Safety and efficacy of regorafenib in patients with advanced soft tissue sarcoma (REGOSARC): a randomised, double-blind, placebo-controlled, phase 2 trial[J]. Lancet Oncol, 2016, 17(12): 1732-1742. DOI:10.1016/S1470-2045(16)30507-1 |
| [5] |
van der Graaf WT, Blay JY, Chawla SP, et al. Pazopanib for metastatic soft-tissue sarcoma (PALETTE): a randomised, double-blind, placebo-controlled phase 3 trial[J]. Lancet, 2012, 379(9829): 1879-1886. DOI:10.1016/S0140-6736(12)60651-5 |
| [6] |
Stacchiotti S, Mir O, Le Cesne A, et al. Activity of Pazopanib and Trabectedin in Advanced Alveolar Soft Part Sarcoma[J]. Oncologist, 2018, 23(1): 62-70. DOI:10.1634/theoncologist.2017-0161 |
| [7] |
Stacchiotti S, Negri T, Zaffaroni N, et al. Sunitinib in advanced alveolar soft part sarcoma: evidence of a direct antitumor effect[J]. Ann Oncol, 2011, 22(7): 1682-1690. DOI:10.1093/annonc/mdq644 |
| [8] |
Ding J, Chen X, Gao Z, et al. Metabolism and pharmacokinetics of novel selective vascular endothelial growth factor receptor-2 inhibitor apatinib in humans[J]. Drug Metab Dispos, 2013, 41(6): 1195-1210. DOI:10.1124/dmd.112.050310 |
| [9] |
Li J, Zhao X, Chen L, et al. Safety and pharmacokinetics of novel selective vascular endothelial growth factor receptor-2 inhibitor YN968D1 in patients with advanced malignancies[J]. BMC Cancer, 2010, 10: 529. DOI:10.1186/1471-2407-10-529 |
| [10] |
Dong M, Bi J, Liu X, et al. Significant partial response of metastatic intra-abdominal and pelvic round cell liposarcoma to a small-molecule VEGFR-2 tyrosine kinase inhibitor apatinib: A case report[J]. Medicine(Baltimore), 2016, 95(31): e4368. |
| [11] |
Ji G, Hong L, Yang P. Successful treatment of advanced malignant fibrous histiocytoma of the right forearm with apatinib: a case report[J]. Onco Targets Ther, 2016, 9: 643-647. |
| [12] |
Ji G, Hong L, Yang P. Successful treatment of angiosarcoma of the scalp with apatinib: a case report[J]. Onco Targets Ther, 2016, 9: 4989-4992. DOI:10.2147/OTT.S110235 |
| [13] |
Tian S, Quan H, Xie C, et al. YN968D1 is a novel and selective inhibitor of vascular endothelial growth factor receptor-2 tyrosine kinase with potent activity in vitro and in vivo[J]. Cancer Sci, 2011, 102(7): 1374-1380. DOI:10.1111/j.1349-7006.2011.01939.x |
| [14] |
Liu X, Xu J, Li F, et al. Efficacy and safety of the VEGFR2 inhibitor Apatinib for metastatic soft tissue sarcoma: Chinese cohort data from NCT03121846[J]. Biomed Pharmacother, 2020, 122: 109587. DOI:10.1016/j.biopha.2019.109587 |
| [15] |
Wang Y, Min L, Zhou Y, et al. The efficacy and safety of apatinib in metastatic alveolar soft part sarcoma: a case series of six patients in one institution[J]. Cancer Manag Res, 2019, 11: 3583-3591. DOI:10.2147/CMAR.S198429 |
| [16] |
Sun Y, Niu W, Du F, et al. Safety, pharmacokinetics, and antitumor properties of anlotinib, an oral multi-target tyrosine kinase inhibitor, in patients with advanced refractory solid tumors[J]. J Hematol Oncol, 2016, 9(1): 105. DOI:10.1186/s13045-016-0332-8 |
| [17] |
Chi Y, Fang Z, Hong X, et al. Safety and Efficacy of Anlotinib, a Multikinase Angiogenesis Inhibitor, in Patients with Refractory Metastatic Soft-Tissue Sarcoma[J]. Clin Cancer Res, 2018, 24(21): 5233-5238. DOI:10.1158/1078-0432.CCR-17-3766 |
 2022, Vol. 49
2022, Vol. 49


