文章信息
- 转录组测序分析虾青素对肝癌HepG2细胞的抑制作用
- Transcriptome Analysis of Inhibitory Effect of Astaxanthin Against HepG2 Cell Lines
- 肿瘤防治研究, 2022, 49(6): 581-585
- Cancer Research on Prevention and Treatment, 2022, 49(6): 581-585
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2022.21.1231
- 收稿日期: 2021-11-01
- 修回日期: 2022-03-22
肝细胞癌(hepatocellular carcinoma, HCC)是最常见的原发性肝恶性肿瘤,是全世界癌症相关死亡的主要原因。在美国,HCC是癌症死亡的第九大原因。HCC在男性中发生频率高于女性(2.4:1),在东亚和南亚、中非和西非、美拉尼西亚和密克罗尼西亚/波利尼西亚发病率较高。中国是肝癌高发地区,尤其是男性的发病率和死亡率均处于较高水平[1]。
虾青素是一种叶黄素类胡萝卜素,存在于许多微生物、海洋动物、酵母和鸟类羽毛中,被认为是生物圈中分布最广泛的脂溶性叶黄素[2-3]。虾青素因其优越的抗氧化活性,在营养学和药剂行业得到了广泛应用,在防止紫外线光氧化、炎性反应、癌症、衰老和与年龄相关的黄斑变性或增强免疫反应、肝功能以及心脏、眼睛、关节和前列腺健康方面具有关键作用[2-3]。目前国内外虾青素与肝病相关研究集中于虾青素对酒精性脂肪肝的预防[4-5],有少量文献表明虾青素能显著抑制肝癌细胞的生长,但机制不明[6],对抑制HepG2细胞的机制研究鲜见报道。因此,本实验以HepG2细胞为模型,探讨虾青素对肝癌细胞生长抑制的机制,为虾青素在保健食品领域的应用提供理论依据。
二代RNA测序技术(RNA-seq)是近年新起的一种新型技术,可同时分析同一或不同标本中成千上万个基因转录水平的表达,是一种高通量、快速有效、高分辨率、高敏感度的基因表达分析方法,在研究细胞生理活动规律和生物代谢机制中发挥着重要的作用[7]。本研究主要采用转录组测序技术分析在虾青素作用下肝癌细胞系HepG2基因表达的情况,旨在揭示虾青素对肝癌细胞分子水平的变化,为阐明虾青素抑制肝癌细胞增殖、促进肝癌细胞凋亡的机制提供新的线索。
1 材料与方法 1.1 实验材料及样品采集虾青素油(质量分数19.64%)购自云南爱尔康生物技术有限公司,虾青素用1%的DMSO溶解,预实验采用不同浓度的虾青素(5、10、15、20和25 µg/ml)处理HepG2细胞24和48 h,以确认后续转录组处理的虾青素最适浓度及时间。根据结果,我们选取25 µg/ml虾青素为终浓度添加到HepG2细胞中,处理48 h;另添加等量1%DMSO作为溶剂对照组。肝癌HepG2细胞用含10%胎牛血清、100 u/ml青霉素和100 mg/ml链霉素的RPMI 1640培养基,37℃、5%CO2培养箱培养,用0.25%胰蛋白酶-0.02%EDTA消化传代。每组实验重复3次。用TRIzol法提取细胞总RNA,再反转录为cDNA。
1.2 Illumina测序文库的构建使用TRIzol试剂从细胞中分离出总RNA。使用Nanodrop 2000检测RNA的浓度和纯度,使用高糖凝胶电泳检查RNA的完整性。用Ribo-Zero磁性试剂盒和RNase R(美国Epicenter)来去除rRNA和线性RNA。纯化RNA用于使用TruSeqTMRNA sample Prep Kit(美国Illumina)构建配对端库,并根据说明书在HiSeq 4000平台上进行测序。
1.3 转录组数据分析测序序列读取使用FASTX V0.013预处理,以删除低质量碱基及读长短于20 bp的信息。HepG2人类基因组序列和注释信息从NCBI和TIGR综合微生物资源(CMR)下载(http://www.tigr.org/CMR)[8-9]。剩余读数使用具有默认参数的Bowtie2.0.0映射到人基因组。对于基因表达确定,根据公式对每百万次映射读数(RPKM)的读数基进行标准计算[10]:
Goatools用于GO富集功能(分子功能、细胞成分、生物过程),KOBAS用于KEGG通路富集和KEGG功能注释。
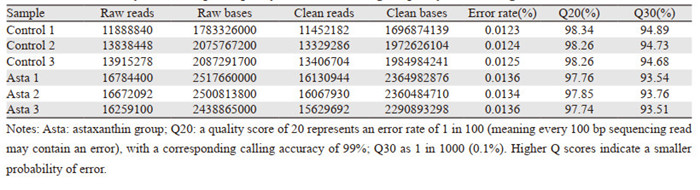
2 结果 2.1 测序数据质量情况汇总对HepG2细胞测序数据经组装、质量评估筛选、过滤等步骤处理后,各组得到的数据量均达1 400万条以上。对照组(Control 1, 2, 3)测序错误发生率低于0.1%(Q30)的碱基占总测序碱基数的比率分别为94.89%、94.73%、94.68%;虾青素处理组(Asta 1, 2, 3)Q30分别为93.54%、93.76%、93.51%,各组数据质量都超过90%,处于较高水平,见表 1。
|
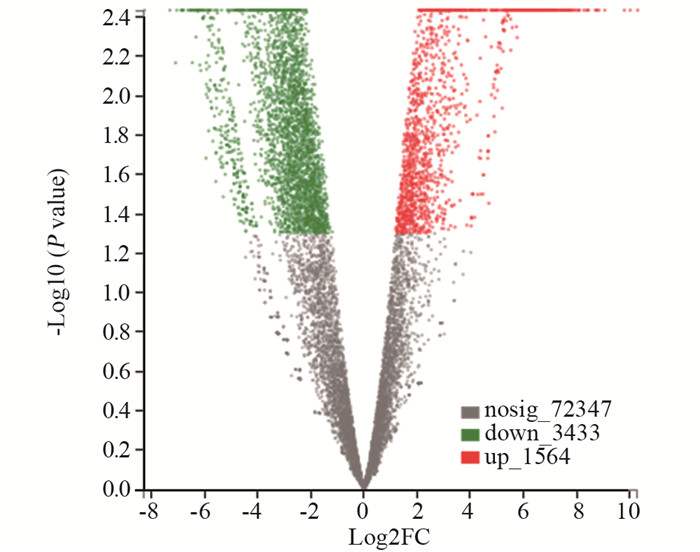
HepG2细胞经过虾青素处理组与对照组的基因差异表达情况,共获4 997个显著性差异表达基因,其中1 564个上调,3 433个下调。根据基因差异表达分析火山图可见,在虾青素的作用下,细胞HepG2差异表达基因表达下调与表达上调的数量相比,明显下调的基因数大大高于上调基因数,见图 1。
|
| 图 1 HepG2细胞虾青素处理条件下的差异基因表达火山图 Figure 1 Volcano plot of differentially-expressed genes in HepG2 cells treated with astaxanthin |
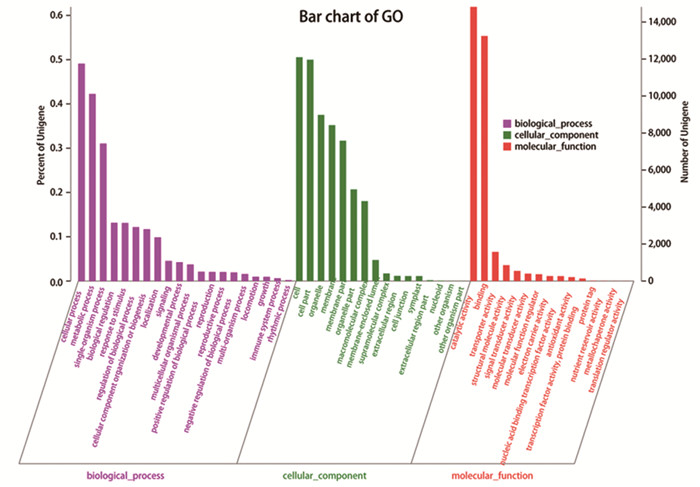
结合Gene Ontology数据库,对HepG2细胞中由于虾青素的作用表达量发生差异性变化的基因进行GO功能分类分析。结果显示,这些差异基因在功能预测中被归类到GO三大类别(生物学进程、细胞组分和分子功能)下的51个二级类别。其中生物学进程类别在三大类别中的总注释量最多(20个),多数基因主要富集在细胞加工、代谢过程和生物调节等方面;其次是细胞组分类别(16个),其中多数基因主要涉及细胞组分、细胞器、细胞器组分及细胞膜方面;而分子功能这一类别所占的总注释量较少(共15个,明显的有4个),其中多数基因主要与催化、结合功能以及转运功能相关,见图 2。
|
| 图 2 HepG2细胞虾青素处理条件下的差异基因表达GO功能预测 Figure 2 GO function prediction of differentiallyexpressed genes in HepG2 cells treated with astaxanthin |
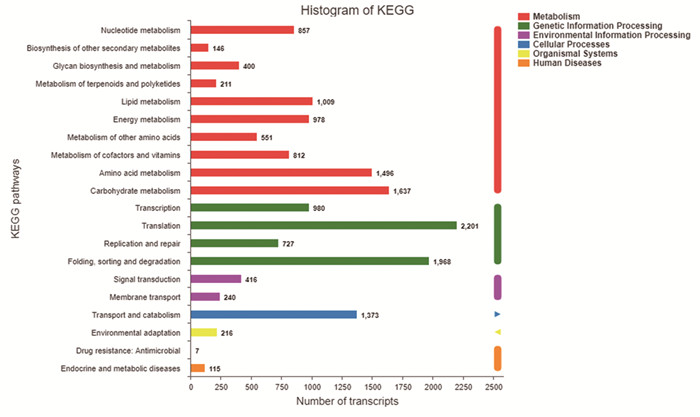
通过KEGG Pathway显著性富集分析可获知差异表达基因参与的生理生化途径。结果显示,差异表达基因富集分析涉及6条通路,分别是:代谢通路、遗传信息过程通路、环境信息过程通路、细胞过程、转运及异化作用等途径、环境适应、内分泌及代谢疾病。其中涉及翻译途径的差异表达基因最多,共2 201个;其次是折叠分拣降解通路,共1 968个;第三是碳水化合物途径,共1 637个,氨基酸代谢有1 496个,转运和异化作用则有1 373个。这几条通路的总注释量占全部注释量的60%以上,其结果也凸显了虾青素在体内作为抗氧化剂参与细胞翻译活动及碳水化合物等物质代谢的特性,主要影响肝癌细胞HepG2的主要通路及途径,见图 3。
|
| 图 3 HepG2细胞虾青素处理条件下的差异基因表达KEGG通路富集 Figure 3 KEGG enrichment analysis of differentially-expressed genes in HepG2 cells treated with astaxanthin |
根据翻译通路的大量差异基因富集,我们对差异表达基因进一步筛选,发现除了核糖体RNA、核糖体蛋白基因L29、L30、L7A、L12、L4le和LX等基因表达基本不变之外,其他126个相关基因都呈现下调。说明经虾青素处理后,HepG2细胞的翻译过程几乎完全被抑制,见图 4。
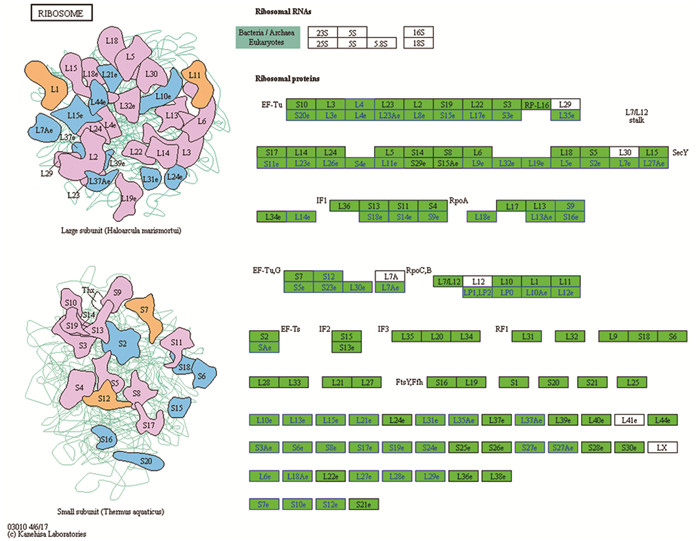
|
| 图 4 核糖体各组分基因的大幅度下调 Figure 4 Significantly down-regulated ribosome related genes |
此前有研究报道了5~50 µg/ml虾青素对肝癌细胞系增殖和凋亡的影响,MTT法检测了藻类虾青素的细胞毒性效应。研究显示虾青素处理细胞后,会干扰微管网络的正常重组,并抑制了在中期有丝分裂和细胞增殖所需正常纺锤体的形成,从而导致细胞周期被阻滞在G2/M阶段,并最终导致细胞凋亡[6]。我们的预实验也证实了虾青素对肝癌细胞的IC50是25 µg/ml,因此,本研究选择了25 µg/ml浓度下,处理肝癌HepG2细胞48 h,进行相关的机制研究。
在正常机体内,细胞凋亡与细胞增殖处于动态平衡状态,而肿瘤细胞中其生长繁殖不受正常生长调控系统的控制,能持续地分裂增殖,导致凋亡相对减少,两者平衡失调,进而形成肿瘤[11]。因此,找到一种有效抑制肿瘤细胞增殖的药物很有必要。肿瘤分子学研究中,最新的RNA测序技术已成功取代基因芯片技术,成为时下从全基因组水平探究基因表达的主流方法。相比于基因芯片技术而言,其具有更宽的动态范围以及更高的敏感度等优点,因此,本研究采用IlluminaTM HiSeq 4000测序技术研究了虾青素对肝癌细胞HepG2转录组的影响。
测序结果表明,在虾青素的作用下,细胞HepG2差异表达基因表达明显下调的基因数显著高于上调基因数,提示其对细胞主要是抑制作用;同时我们对HepG2细胞中虾青素作用的GO功能分类分析,结果显示:主要的功能预测中,生物学过程类别在三大类别中的总注释量最多,主要富集在细胞加工、代谢过程和生物调节等方面;其次是细胞组分,主要涉及细胞组分、细胞器、细胞器组分及细胞膜方面;而分子功能这一类别多数基因与催化、结合功能以及转运功能相关。差异表达基因富集分析涉及代谢通路,包括核苷酸、碳水化合物、氨基酸、脂类及能量代谢等途径;遗传信息过程包括翻译、折叠分拣及降解、转录、复制及修复等;环境信息过程包括信号转导和膜转运等;细胞过程涉及转运及异化作用等途径。其中涉及翻译途径的差异表达基因最多(共2 201个),说明虾青素在体内作为抗氧化剂参与细胞翻译活动及碳水化合物等物质代谢的特性。与前面提及的少数研究肝癌细胞的抑制或凋亡机制有所不同,如早期的研究表明,虾青素抑制肝癌细胞的原理可能跟细胞周期有关[6]。芍药内酯苷在体外实验中表现出对HepG2细胞的增殖抑制与降低侵袭作用,可能是通过调节信号转导、代谢活动、神经活性、钙离子跨膜转运等通路上的变化实现的[12];基因功能注释结果表明,三七总皂苷通过改变多个基因的表达,影响与肝癌细胞密切相关的生物学进程和信号通路[13];采用高通量测序技术IlluminaTM HiSeq 2000对肝癌BEL-7402细胞的α-硫辛酸处理组和对照组进行转录组测序,再进行系统的生物信息学分析并筛选出Bcl-2家族蛋白相关的差异表达基因。根据测序分析结果表明,α-硫辛酸可能通过调控Bcl-2家族相关的凋亡基因促进肝癌细胞凋亡[14]。本研究获得了大量的转录本信息,极大地丰富了HepG2细胞的基因组数据库。通过对测序结果的进一步分析,挖掘了虾青素作用于肝癌细胞的核糖体RNA及蛋白相关基因,为后续研究虾青素抑制肝癌细胞生长的分子机制提供线索。
虾青素作为自然界最强抗氧化剂[15-17],可以通过降低氧化应激抑制大鼠良性前列腺增生、抑制幽门螺杆菌感染的人胃上皮细胞基因表达以及促进肺癌人类肺泡基底上皮细胞A549的抗癌作用和溶酶体酸化作用而实现治疗效果;但本研究发现,在转录组层面上并没有发现氧胁迫、抗氧化相关的通路发生明显改变,说明虾青素抗癌机制的多样性及复杂性,还需要进一步对更多的细胞系进行对比分析。
综上,肝癌发生发展过程涉及多个生物学过程和信号通路的改变。本研究分析了虾青素对肝癌HepG2细胞基因表达的影响,探讨虾青素处理肝癌细胞后的基因表达差异,并对其进行生物学信息分析。有统计学差异表达基因4 997个,其中上调的基因1 564个,下调的基因3 433个。虾青素通过影响多个与代谢相关的生物学进程和信号通路,其中抑制翻译过程可能在虾青素调控肝癌的凋亡过程中发挥主要作用。本研究取样时间、细胞种类都有限,后续争取增加更多的肝癌模型细胞,结合转录组,进行更多的如蛋白质、代谢组学等,全面深入地探究虾青素抑制肝癌细胞的分子机制。
作者贡献:
徐欢:实验构思与设计,文章撰写与修改
王广丽、李庭明:实验实施
王玮:数据分析
董丹丹:实验构思与设计,文章修改
| [1] |
刘乐恒, 赵艳, 张茜, 等. 肠道菌群紊乱与肝癌的研究进展[J]. 肿瘤防治研究, 2019, 46(12): 1136-1140. [Liu LH, Zhao Y, Zhang Q, et al. Progress of intestinal flora disorder and hepatocellular cancer[J]. Zhong Liu Fang Zhi Yan Jiu, 2019, 46(12): 1136-1140. DOI:10.3971/j.issn.1000-8578.2019.19.0462] |
| [2] |
Oslan SNH, Tan JS, Oslan SN, et al. Haematococcus pluvialis as a potential source of astaxanthin with diverse applications in industrial sectors: current research and future directions[J]. Molecules, 2021, 26(21): 6470. DOI:10.3390/molecules26216470 |
| [3] |
Villaró M, Ciardi A, Morillas-EspaÖa A, et al. Microalgae Derived Astaxanthin: Research and Consumer Trends and Industrial Use as Food[J]. Foods, 2021, 10(10): 2303. DOI:10.3390/foods10102303 |
| [4] |
曹秀明, 杨贵群, 杨菲菲. 虾青素对过氧化氢所致细胞线粒体氧化损伤及生存能力下降的保护作用[J]. 中国海洋药物, 2010, 29(5): 26-32. [Cao XM, Yang GQ, Yang FF. Protective effect of astaxanthin on oxidative mitochondrial damage and decreased viability in cells caused by hydrogen peroxide[J]. Zhongguo Hai Yang Yao Wu, 2010, 29(5): 26-32.] |
| [5] |
刁翠茹, 王静, 闫勇, 等. 虾青素对高脂HepG2细胞及高脂膳食饲喂C57BL/6J小鼠血脂代谢的影响[J]. 食品科学, 2020, 41(17): 139-144. [Diao CR, Wang J, Yan Y, et al. Effect of astaxanthin on lipid metabolism in HepG2 cells and in C57BL/6J mice fed with high-fat diet[J]. Shi Pin Ke Xue, 2020, 41(17): 139-144. DOI:10.7506/spkx1002-6630-20190802-045] |
| [6] |
Nagaraj S, Rajaram MG, Arulmurugan P, et al. Antiproliferative potential of astaxanthin-rich alga Haematococcus pluvialis Flotow on human hepatic cancer (HepG2) cell line[J]. Biomed Prev Nutrition, 2012, 2(3): 149-153. DOI:10.1016/j.bionut.2012.03.009 |
| [7] |
Silva W, Fabián AH, Kelly S, et al. Transcriptome Analysis Using RNA-seq and scRNA-seq[M]//Passos GA Transcriptomics in Health and Disease. Switzerland: Springer, Cham, 2022: 73-107.
|
| [8] |
Caron A, Baraboi ED, Laplante M, et al. DEP domain-containing mTOR-interacting protein in the rat brain: Distribution of expression and potential implication[J]. J Comp Neurol, 2015, 523(1): 93-107. DOI:10.1002/cne.23668 |
| [9] |
Peterson JD, Umayam LA, Dickinson T, et al. The Comprehensive Microbial Resource[J]. Nucleic Acids Res, 2001, 29(1): 123-125. DOI:10.1093/nar/29.1.123 |
| [10] |
Szabo L, Morey R, Palpant NJ, et al. Statistically based splicing detection reveals neural enrichment and tissue-specific induction of circular RNA during human fetal development[J]. Genome Biol, 2015, 16(4): 126. |
| [11] |
宋晓冬, 王美蓉, 张瑾锦, 等. 虾青素对大鼠肝癌CBRH-7919细胞骨架和nm23蛋白的影响[J]. 滨州医学院学报, 2010, 33(5): 321-324. [Song XD, Wang MR, Zhang JJ, et al. Effect of astaxanthin on cytoskeleton and nm23 protein in rat hepatocellular carcinoma CBRH-7919 cells[J]. Binzhou Yi Xue Yuan Xue Bao, 2010, 33(5): 321-324. DOI:10.3969/j.issn.1001-9510.2010.05.001] |
| [12] |
周雅婷, 罗志强, 张彬彬, 等. 基于转录组学的芍药内酯苷抗肝癌的作用机制研究[J]. 中南药学, 2021, 19(6): 1074-1079. [Zhou YT, Luo ZQ, Zhang BB, et al. Mechanism of albiflorin against hepatocellular carcinoma based on transcriptomics[J]. Zhong Nan Yao Xue, 2021, 19(6): 1074-1079.] |
| [13] |
申文豪, 杨颂, 姜敏, 等. 三七总皂苷诱导下的肝癌细胞HepG2细胞转录组测序分析[J]. 泰州职业技术学院学报, 2020, 20(6): 61-63. [Shen WH, Yang S, Jiang M, et al. Transcriptometric analysis of HepG2 cells induced by Panax Notoginseng Saponin[J]. Taizhou Zhi Ye Ji Shu Xue Yuan Xue Bao, 2020, 20(6): 61-63. DOI:10.3969/j.issn.1671-0142.2020.06.019] |
| [14] |
张满桥, 文娅, 陆菁潇, 等. α-硫辛酸作用肝癌细胞的转录组分析及验证[J]. 基因组学与应用生物学, 2020, 39(8): 3672-3680. [Zhang MQ, Wen Y, Lu JX, et al. Transcriptome analysis and validation of hepatoma cells treated with alpha-lipoic acid[J]. Ji Yin Zu Xue Yu Ying Yong Sheng Wu Xue, 2020, 39(8): 3672-3680.] |
| [15] |
Semenov AL, Gubareva EA, Ermakova, E D, et al. Astaxantin and Isoflavones Inhibit Benign Prostatic Hyperplasia in Rats by Reducing Oxidative Stress and Normalizing Ca/Mg Balance[J]. Plants (Basel), 2021, 10(12): 2735. |
| [16] |
Kim SH, Hyeyoung Kim. Inhibitory Effect of Astaxanthin on Gene Expression Changes in Helicobacter pylori-Infected Human Gastric Epithelial Cells[J]. Nutrients, 2021, 13(12): 4281. DOI:10.3390/nu13124281 |
| [17] |
Ramamoorthy K, Raghunandhakumar S, Anand RS, et al. Anticancer effects and lysosomal acidification in A549 cells by Astaxanthin from Haematococcus lacustris[J]. Bioinformation, 2020, 16(11): 965-973. DOI:10.6026/97320630016965 |
 2022, Vol. 49
2022, Vol. 49


