文章信息
- 基于TCGA数据库筛选肺腺癌顺铂耐药的分子标志物及功能验证
- Screening of Molecular Markers of Cisplatin Resistance in Lung Adenocarcinoma and Functional Verification Based on TCGA Database
- 肿瘤防治研究, 2022, 49(6): 569-574
- Cancer Research on Prevention and Treatment, 2022, 49(6): 569-574
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2022.21.1181
- 收稿日期: 2021-10-18
- 修回日期: 2022-01-05
2. 443002 宜昌,三峡大学医学院病理学系;
3. 445000 恩施,恩施市中心医院妇科
2. Department of Pathology, China Three Gorges University Medical College, Yichang 443002, China;
3. Department of Gynaecology, Enshi Center Hospital, Enshi 445000, China
据2020年世卫组织全球癌症统计,肺癌发病数占癌症总病例数的11.4%,占癌症总死亡病例数的18.0%,是最主要的癌症死亡原因[1]。肺癌在组织病理学上主要分为非小细胞肺癌(non-small cell lung cancer, NSCLC)和小细胞肺癌(small cell lung cancer, SCLC)两类。非小细胞肺癌是肺癌中最常见的类型,约占每年新发肺癌患病总例数的80%~85%[2]。肺腺癌(lung adenocarcinoma, LUAD)约占NSCLC所有类型的80%。近年来与非吸烟相关的女性肺腺癌患者呈逐年上升趋势,化疗是其主要的治疗方法,可以显著改善患者的预后[3-4]。
顺铂(cisplatin, DDP)是一种作用较强的细胞周期非特异性阻断药物,其作用基础是与癌细胞DNA结合形成DNA-铂加合物,破坏DNA合成和有丝分裂,诱导癌细胞凋亡。顺铂被广泛应用于肺癌、卵巢癌、结直肠癌、宫颈癌、胃癌、头颈部癌等多种癌症的治疗[5-6]。但是除了睾丸癌之外,其他恶性肿瘤细胞因逐渐产生耐药性而对顺铂的敏感度降低。因此深入探讨顺铂的耐药机制对于提高肺癌患者的生存率具有重要意义。本研究旨在基于TCGA癌症基因信息数据库筛选肺腺癌顺铂耐药的分子标志物,为肺腺癌顺铂耐药的治疗和逆转提供可能的靶点。
1 材料与方法 1.1 试剂与仪器人肺腺癌细胞株A549(三峡大学肿瘤微环境与免疫治疗湖北省重点实验室保存),人肺腺癌顺铂耐药株A549/DDP(购自武汉普诺赛公司),顺铂(美国Sigma公司,PBS配置,-80℃避光保存),DMEM培养基粉末、F-12K培养基、胎牛血清(美国Gibco公司),TRIzol裂解液、反转录试剂盒(美国Thermo公司),引物合成(上海生工生物公司),CXCL10 ELISA试剂盒(武汉,Elabscience公司),实时荧光定量PCR仪(美国ABI公司),siRNA由苏州吉玛生物公司设计合成。
1.2 实验方法 1.2.1 细胞培养人肺腺癌细胞系A549采用DMEM培养液培养。人肺腺癌顺铂耐药细胞系A549/DDP采用F-12K培养液培养,顺铂维持浓度为1.5 μg/ml。两种细胞系均加入10%血清,1%青霉素和链霉素,置于37℃、5%CO2的细胞培养箱中培养,取其处于对数生长期细胞待用,且A549/DDP细胞脱药培养后用于实验。
1.2.2 数据的获取从TCGA数据库(https://portal.gdc.cancer.gov/)中下载已处理的肺腺癌原始mRNA表达数据,一共收集到肺腺癌标本535份。
1.2.3 药物敏感度分析基于最大的药物基因组学数据库—GDSC癌症药物敏感度基因组学数据库(https://www.cancerrxgene.org/),使用R软件包“pRRophetic”预测每个肺腺癌肿瘤样本的化疗敏感度,线性回归分析得到顺铂药物治疗的IC50估计值,将样本区分为顺铂敏感组和耐药组,并用GDSC训练集进行10次交叉验证检验回归和预测精度。所有参数都选择默认值,包括去除批处理效应的“combat”以及取重复基因表达的平均值。
1.2.4 差异表达分析根据患者的IC50中位值划分为高低两组,探讨两组患者的表型差异。利用limma包对下载的mRNA level 3的FPKM数据进行整合和标准化,分析差异表达基因及其表达水平,差异基因筛选条件为|LogFC| > 1且P < 0.05。
1.2.5 GO功能富集分析和KEGG信号通路分析为了获得与疾病发生发展所涉及的生物学功能和信号通路,使用Metascape数据库(www.metascape.org)进行注释和可视化,对特定基因进行基因本体(GO)分析和京都基因组百科全书(KEGG)通路分析。Min overlap≥3 & P≤0.01为差异有统计学意义。
1.2.6 差异基因的PPI构建及基因模块分析使用STRING在线数据库11.0(https://string-db.org)探讨突变基因的PPI网络,并将置信度得分 > 0.4作为截点标准。进一步通过Cytoscape软件可视化生成的PPI网络,分析突变在肺腺癌顺铂耐药发生发展中的作用,探讨突变与基因表达的相关性。
1.2.7 Hub基因的聚类分析通过Cytoscape软件的MCODE插件对差异基因进行聚类,分析Hub基因与肿瘤的关系。
1.2.8 MTT法检测细胞增殖情况待检测细胞用0.25%胰蛋白酶消化,以5 000个/孔的浓度加入到96孔板中,加入200 μl的培养基至细胞贴壁,弃去孔内培养基,加入含有不同药物浓度的培养基培养48 h,每孔加入20 μl MTT(5 mg/ml)溶液混匀,孵育4 h后终止培养;每孔加入二甲基亚砜(DMSO)150 μl混匀,室温培养15 min;酶标仪检测490 nm处的吸光度值(OD值),计算细胞增殖抑制率,抑制率=(1-实验组OD值)/对照组OD值×100%。每组设3个复孔,实验重复3次。
1.2.9 qRT-PCR检测收集细胞后置于冰上,加入TRIzol裂解液冰上静止裂解细胞,提取细胞总RNA,反转录试剂盒反转录为cDNA,以cDNA为模板进行qRT-PCR,反应体系为10 μl:SYBR®Premix 5 μl,5×cDNA 2.5 μl,上下游引物各0.25 μl,ROX 0.2 μl,H2O 1.8 μl;反应程序为95℃ 15 s;95℃ 3 s;60℃ 30 s,循环40次;95℃ 15 s;60℃ 1 min;72℃ 10 min。引物序列:CXCL10:Forward: 5"-CCACGTGTTGAGATCATTGCT-3’,Reverse: 5’-TGCATCGATTTTGCTCCCCT-3’;GAPDH:Forward: 5’-GGGAGCCAAAAGGGTCAT-3’,Reverse: 5’-GAGTCCTTCCACGATACCAA-3’。以GAPDH为内参基因。
1.2.10 细胞转染及分组取传代培养的A549/DDP细胞,按照4×103万个/孔接种于96孔板,按说明书配置转染试剂,转染细胞48 h后换成含有DDP的培养基,DDP浓度梯度为:0、1、2、4、8、16、32、64 μg/ml,处理72 h后MTT法检测细胞增殖情况。转染CXCL10 siRNA的细胞作为siCXCL10组,转染NC(阴性对照)的细胞作为NC组。siCXCL10序列为sense: 5’-GGAGUACCUCUCUCUAGAATT-3’,antisense: 5’-UUCUAGAGAGAGGUACUCCTT-3’,NC为无效干扰序列。
1.2.11 ELISA法检测细胞上清液中CXCL10蛋白的表达收集待测的细胞上清液,4℃、1 000 g离心20 min,除去杂质及细胞碎片,然后根据试剂盒说明书进行ELISA法检测。
1.3 统计学方法使用软件SPSS26.0进行数据分析,GraphPad Prism8.0进行统计图绘制。两组间比较采用t检验。P < 0.05为差异有统计学意义。
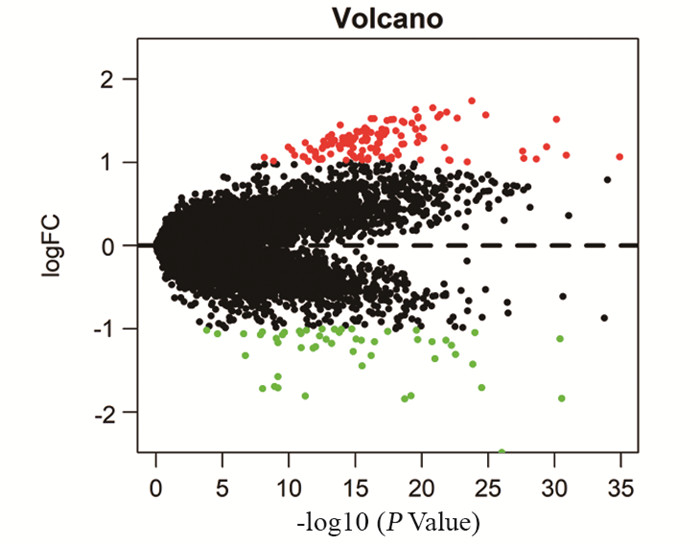
2 结果 2.1 筛选顺铂敏感组和耐药组的差异表达基因根据分析结果绘制差异基因的火山图,共筛选获得178个差异基因,与顺铂敏感组相比,耐药组表达上调的基因有127个,表达下调的基因有51个,见图 1。
|
| Comparison between cisplatin sensitive group and drug resistant group, red was up-regulation, green was down-regulation, and black was without significantly differential expression. 图 1 差异表达基因的火山图 Figure 1 Volcano map of differentially-expressed genes |
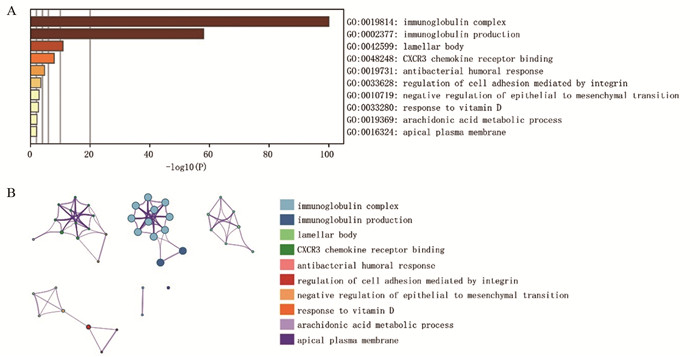
GO分析结果表明,差异表达基因的分子功能主要表现在免疫相关反应、板层小体、趋化因子受体结合、上皮间充质转化、整合素介导的细胞黏附调控、花生四烯酸代谢过程等方面。KEGG通路分析结果表明,差异基因主要富集的通路包括免疫球蛋白复合物(immuoglobulin complex)、免疫球蛋白生成(immunoglobulin production)、板层小体(lamellar body)、CXCR3趋化因子受体结合(CXCR3 chemokine receptor binding)、免疫相关反应(antibacterial humoral response)等信号通路,提示免疫相关反应可能参与肺腺癌患者对顺铂的耐药性,见图 2。
|
| 图 2 差异表达基因的GO(A)和KEGG(B)富集分析 Figure 2 GO(A) and KEGG(B) enrichment analyses of differentiallyexpressed genes |
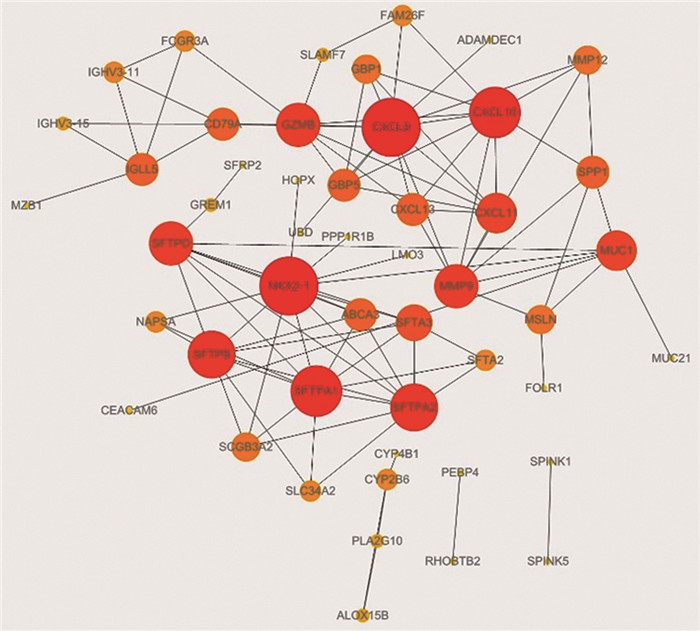
PPI网络分析一共获得11个Hub基因:CXC基序趋化因子9(C-X-C motif chemokine 9, CXCL9)、CXC基序趋化因子10(C-X-C motif chemokine 10, CXCL10)、NKX同源框-1基因(NKX homeobox-1 gene, NKX2-1)、肺泡表面活性物质相关蛋白A1(Pulmonary surfactant-associated protein A1, SFTPA1)、肺泡表面活性物质相关蛋白B(Pulmonary surfactant-associated protein B, SFTPB)、肺泡表面活性物质相关蛋白A2(Pulmonary surfactant-associated protein A2, SFTPA2)、肺泡表面活性物质相关蛋白D(Pulmonary surfactant-associated protein D, SFTPD)、颗粒酶B(Granzyme B, GZMB)、基质金属蛋白酶9(Matrix metalloproteinase-9, MMP9)、CXC基序趋化因子11(C-X-C motif chemokine 11, CXCL11)和黏蛋白-1(Mucin-1, MUC1),见图 3。
|
| 图 3 差异表达基因的蛋白质互作网络图 Figure 3 Protein interaction network diagram of differentially-expressed genes |
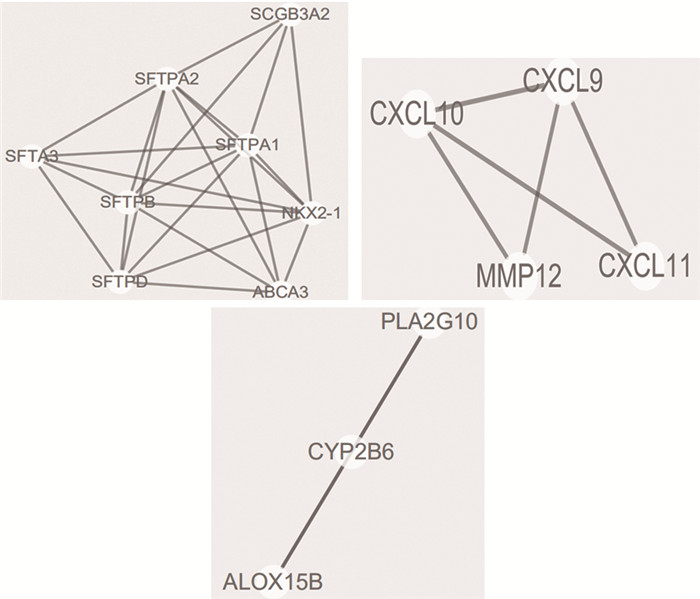
通过Cytoscape的MCODE插件对差异基因进行聚类,共划分成3个基因模块,见图 4。
|
| 图 4 差异表达基因连接紧密度较高的3个基因模块 Figure 4 Differentially-expressed three genes modules with high connectivity |
MTT法检测结果显示:顺铂对A549细胞作用48 h的IC50为3.47±0.95 μg/ml,顺铂对A549/DDP细胞作用48 h的IC50为24.27±5.52 μg/ml,见表 1。经计算耐药指数(RI)值为7.0。
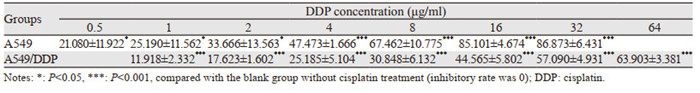
|
qRT-PCR检测结果显示,A549/DDP细胞中CXCL10的表达水平显著高于A549细胞(10.544±1.338 vs. 1.000±0.000, P < 0.001),与生物信息学分析结果一致。ELISA结果显示,A549/DDP细胞上清液中CXCL10蛋白的表达量高于A549细胞(278.126±13.923 vs. 142.463±8.951, P < 0.001),与生物信息学预测结果一致。
2.7 转染siCXCL10对A549/DDP细胞中CXCL10 mRNA表达及上清液中CXCL10蛋白表达的影响qRT-PCR结果显示,siCXCL10组CXC10 mRNA表达水平明显低于NC组(0.115±0.013 vs. 1.000±0.000, P < 0.001)。ELISA结果显示,siCXCL10组CXC10蛋白表达水平明显低于NC组(119.242±11.699 vs. 247.647±15.680, P < 0.001)。
2.8 DDP对NC、siCXCL10转染A549/DDP细胞后72 h增殖的抑制作用转染NC及siCXCL10序列48 h后DDP处理72 h,NC组IC50为8.75±0.41 μg/ml,siCXCL10组IC50为5.00±0.31 μg/ml,见表 2。与NC组相比,siCXCL10组对DDP的敏感度增加。
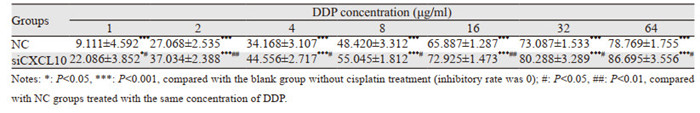
|
肺癌治疗手段多样化,以顺铂为基础的化疗方式是其主要治疗手段之一,但顺铂耐药性问题使治疗效果降低,因此研究顺铂的耐药机制刻不容缓。本研究从TCGA数据库中下载535例肺腺癌患者表达谱,通过GDSC癌症药物敏感度基因组学数据库对其进行顺铂耐药性划分,得到顺铂敏感组和耐药组各267例。使用R语言筛选两组之间的差异表达基因,并对差异表达基因进行GO分析发现,差异基因涉及分子功能的变化主要表现在免疫相关反应、板层小体、趋化因子受体结合、上皮间充质转化、整合素介导的细胞黏附调控、花生四烯酸代谢过程等方面。为了阐明这些差异基因对信号通路的调节进行了KEGG通路分析,差异基因主要在免疫相关反应、趋化因子受体结合等相关通路富集。通过进一步基因模块分析,结果显示共有四个基因连接度大于10,分别是CXCL9、NKX2-1、SFTPA1以及CXCL10。这些基因涉及趋化因子受体结合、甲状腺稳态调控、肺表面相关调控等。然后通过肺腺癌细胞A549及肺腺癌顺铂耐药细胞A549/DDP初步验证生物信息学挖掘的数据结果,并沉默A549/DDP细胞中CXCL10 mRNA的表达水平后发现其对DDP敏感度增加。
CXCL10是半胱氨酸-X氨基酸-半胱氨酸(CXC)亚家族细胞因子中的一种小分子分泌型蛋白,通过与CXCR3受体结合并传递信号,在介导白细胞转运、获得性免疫、炎性反应和血管生成等多种生物学过程中发挥着重要作用[7]。研究表明,由肿瘤或免疫细胞产生的CXCL10可以招募与肿瘤抑制相关的CXCR3+肿瘤浸润性T细胞和NK细胞,从而抑制肿瘤的发生发展[8]。但是也有研究报道CXCL10能够增强多种癌细胞的迁移、侵袭、增殖和细胞外基质黏附[9]。研究发现,趋化因子在多种癌症中可以通过自分泌轴促进肿瘤的生长和转移,并且与细胞自噬及凋亡等途径相关[10-11]。在胰腺癌的研究中,CXCL10被胰腺癌细胞诱导并招募免疫抑制的CXCR3+T细胞至癌细胞处,以阻断抗原细胞对T效应细胞的刺激或直接抑制效应T细胞和NK细胞,促进胰腺肿瘤的生长和发展[12]。与正常组织相比,CXCL10在肺腺癌中高表达并且发挥重要作用[13]。在最新的关于程序性死亡受体1(PD-1)/程序性死亡受体配体1(PD-L1)免疫检查点抑制剂的研究中发现,CXCL10是肺癌患者抗PD-1/PD-L1治疗和预后信息的潜在预测标志物[14]。
Ling等[15]发现,相比接受大体积肝移植的患者,小体积肝移植术后肝癌患者的复发率更高,并且在肿瘤内部以及血浆中伴随着更高浓度的内皮祖细胞(EPC)以及CXCL10;体外研究发现高浓度的CXCL10可以以剂量方式或者CXCR3依赖的方式招募EPC,并具有直接诱导EPC活化、分化以及血管形成的作用,这可能给接受肝移植的肝癌患者提供一个复发及转移的环境,从而导致肿瘤的发展。Dimberg等[16]发现CXCL10在直肠癌组织中的水平比癌周组织的水平更高,并且与局限性肿瘤相比,转移性肿瘤的CXCL10水平也更高,这表明CXCL10与直肠癌的进展也有关系。CXCL10在肿瘤发生中的双重作用取决于相应的CXCR3受体的剪接变体。据报道,CXCR3-A可与Gai相互作用,激活p38/MARK、ERK1/2、PI3K/Akt和JNK通路,诱导细胞增殖或趋化;CXCR3-B可以与Gas偶联,激活腺苷酸环化酶,抑制增殖和迁移[17-18]。Wu等[19]研究发现CXCL10可以促进乳腺癌细胞MCF7雌激素依赖性和非依赖性增殖,并且抑制CXCL10可以恢复乳腺癌对他莫昔芬的敏感度。但是目前对于CXCL10与肺腺癌顺铂耐药的关系尚无研究报道。
综上所述,本研究通过生物信息学的方法筛选出可能参与肺腺癌顺铂耐药过程的4个连接度大于10的基因:CXCL9、NKX2-1、SFTPA1以及CXCL10。然后通过qRT-PCR实验验证CXCL10基因在A549/DDP细胞中的mRNA表达量显著高于A549细胞,与分析结果一致,最后沉默CXCL10的表达后发现A549/DDP细胞对DDP的敏感度增加。说明CXCL10基因在肺腺癌顺铂耐药中起到一定的调控作用,可能是潜在的耐药机制,但仍需要实验室和临床的进一步研究验证。本实验只是选择了其中的一个关键基因进行实验验证,后续会继续验证其他几个关键基因的表达情况及作用。
作者贡献
王霖:实验操作,数据统计分析,论文撰写
黄紫弦、谭顺梓:提供建议并进行实验操作的协助
尤程程、黄利鸣:提供主要参考方案、指导实验及论文撰写
黄益玲:指导研究设计与实施
| [1] |
Sung H, Ferlay J, Siegel RL, et al. Global Cancer Statistics 2020: GLOBOCAN Estimates of Incidence and Mortality Worldwide for 36 Cancers in 185 Countries[J]. CA Cancer J Clin, 2021, 71(3): 209-249. DOI:10.3322/caac.21660 |
| [2] |
Ruiz-Cordero R, Devine WP. Targeted Therapy and Checkpoint Immunotherapy in Lung Cancer[J]. Surg Pathol Clin, 2020, 13(1): 17-33. DOI:10.1016/j.path.2019.11.002 |
| [3] |
Ye T, Deng L, Xiang J, et al. Predictors of Pathologic Tumor Invasion and Prognosis for Ground Glass Opacity Featured Lung Adenocarcinoma[J]. Ann Thorac Surg, 2018, 106(6): 1682-1690. DOI:10.1016/j.athoracsur.2018.06.058 |
| [4] |
Siegel RL, Miller KD, Fuchs HE, et al. Cancer statistics, 2022[J]. CA Cancer J Clin, 2022, 72(1): 7-33. DOI:10.3322/caac.21708 |
| [5] |
Yang Y, Adebali O, Wu G, et al. Cisplatin-DNA adduct repair of transcribed genes is controlled by two circadian programs in mouse tissues[J]. Proc Natl Acad Sci U S A, 2018, 115(21): E4777-E4785. |
| [6] |
Dasari S, Tchounwou PB. Cisplatin in cancer therapy: molecular mechanisms of action[J]. Eur J Pharmacol, 2014, 740: 364-378. DOI:10.1016/j.ejphar.2014.07.025 |
| [7] |
Chen J, Chen QL, Wang WH, et al. Prognostic and predictive values of CXCL10 in colorectal cancer[J]. Clin Transl Oncol, 2020, 22(9): 1548-1564. DOI:10.1007/s12094-020-02299-6 |
| [8] |
Wennerberg E, Kremer V, Childs R, et al. CXCL10-induced migration of adoptively transferred human natural killer cells toward solid tumors causes regression of tumor growth in vivo[J]. Cancer Immunol Immunother, 2015, 64(2): 225-235. DOI:10.1007/s00262-014-1629-5 |
| [9] |
Lee JH, Kim HN, Kim KO, et al. CXCL10 promotes osteolytic bone metastasis by enhancing cancer outgrowth and osteoclastogenesis[J]. Cancer Res, 2012, 72(13): 3175-3186. DOI:10.1158/0008-5472.CAN-12-0481 |
| [10] |
Tokunaga R, Zhang W, Naseem M, et al. CXCL9, CXCL10, CXCL11/CXCR3 axis for immune activation-A target for novel cancer therapy[J]. Cancer Treat Rev, 2018, 63: 40-47. DOI:10.1016/j.ctrv.2017.11.007 |
| [11] |
Meng Q, Zhang Y, Hu LG. Targeting Autophagy Facilitates T Lymphocyte Migration by Inducing the Expression of CXCL10 in Gastric Cancer Cell Lines[J]. Front Oncol, 2020, 10: 886. DOI:10.3389/fonc.2020.00886 |
| [12] |
Billottet C, Quemener C, Bikfalvi A. CXCR3, a double-edged sword in tumor progression and angiogenesis[J]. Biochim Biophys Acta, 2013, 1836(2): 287-295. |
| [13] |
Mahmood TB, Chowdhury AS, Hossain MU, et al. Evaluation of the susceptibility and fatality of lung cancer patients towards the COVID-19 infection: A systemic approach through analyzing the ACE2, CXCL10 and their co-expressed genes[J]. Curr Res Microb Sci, 2021, 2: 100022. |
| [14] |
Wang Y, Chen H, Zhang T, et al. Plasma cytokines interleukin-18 and C-X-C motif chemokine ligand 10 are indicative of the anti-programmed cell death protein-1 treatment response in lung cancer patients[J]. Ann Transl Med, 2021, 9(1): 33. DOI:10.21037/atm-20-1513 |
| [15] |
Ling CC, Ng KTP, Shao Y, et al. Post-transplant endothelial progenitor cell mobilization via CXCL10/CXCR3 signaling promotes liver tumor growth[J]. J Hepatol, 2014, 60(1): 103-109. DOI:10.1016/j.jhep.2013.08.017 |
| [16] |
Dimberg J, Skarstedt M, Löfgren S, et al. Protein expression and gene polymorphism of CXCL10 in patients with colorectal cancer[J]. Biomed Rep, 2014, 2(3): 340-343. DOI:10.3892/br.2014.255 |
| [17] |
Saahene RO, Wang J, Wang ML, et al. The role of CXC chemokine ligand 4/CXC chemokine receptor 3-B in breast cancer progression[J]. Biotech Histochem, 2019, 94(1): 53-59. DOI:10.1080/10520295.2018.1497201 |
| [18] |
Reynders N, Abboud D, Baragli A, et al. The Distinct Roles of CXCR3 Variants and Their Ligands in the Tumor Microenvironment[J]. Cells, 2019, 8(6): 613. DOI:10.3390/cells8060613 |
| [19] |
Wu X, Sun A, Yu W, et al. CXCL10 mediates breast cancer tamoxifen resistance and promotes estrogen-dependent and independent proliferation[J]. Mol Cell Endocrinol, 2020, 512: 110866. DOI:10.1016/j.mce.2020.110866 |
 2022, Vol. 49
2022, Vol. 49


