文章信息
- 代谢综合征及低水平高密度脂蛋白胆固醇与前列腺癌根治术后不良病理特征的相关性
- Correlation of Metabolic Syndrome and Low-level High-density Lipoprotein Cholesterol with Adverse Pathological Features of Prostate Cancer After Radical Prostatectomy
- 肿瘤防治研究, 2022, 49(5): 459-463
- Cancer Research on Prevention and Treatment, 2022, 49(5): 459-463
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2022.21.1112
- 收稿日期: 2021-09-30
- 修回日期: 2021-12-16
代谢综合征(metabolic syndrome, MetS)是一种多种代谢异常的集群。随着生活水平的提高,我国肥胖人群不断壮大,MetS的发病率也呈上升趋势,给社会经济带来了沉重的负担[1]。研究表明其与多种癌症的发生相关[2],近年来,有关流行病学、组织病理学、分子病理学及临床的多项研究有力地证明了MetS及其各项指标可能在前列腺癌的发病机制中发挥一定的作用[3-4]。
前列腺癌(prostate cancer, PCa)是威胁人类健康的重要问题,随着人口老龄化增长,这一问题也越来越凸显。PCa属于慢性疾病,具有发病早、发展缓慢的特点,始发于单一的小结节性增生,经过早期和晚期癌前组织的畸变发展成肿瘤。PCa在世界范围内男性恶性肿瘤发病率位居第二,仅次于皮肤癌。在美国,PCa发病率已超过肺癌,成为第一位危害男性健康的肿瘤[5]。我国前列腺癌的发病率低于欧美国家,近年来呈明显上升趋势,死亡率占全球5%[6]。
近年来,有研究报道MetS与PCa侵袭性标志物的相关性,并可能影响癌症发展进程[7-9]。基于前列腺活检结果的PCa诊断,可能由于低估病理学特征而造成误差[10]。针对根治性前列腺切除术(radical prostatectomy, RP)样本的研究能够对PCa分级和分期提供可靠的评估[10-11]。本研究采用前瞻性多中心研究方法,探究MetS及低水平HDL-C对RP样本不良病理特征的预测性。
1 资料与方法 1.1 患者信息对2015年1月—2020年12月于郑州人民医院泌尿外科接受治疗的232例诊断为前列腺癌并行前列腺癌根治术的患者进行前瞻性多中心研究,参与该项目的患者均签署书面知情同意书。术前收集有关患者的统计学、生物学及临床数据:年龄、前列腺癌家族史、前列腺活检结果、前列腺磁共振影像(MRI)结果、前列腺特异性抗原(PSA)、总胆固醇(TC)、高甘油三酯(TG)、HDL-cholesterol(HDL-C)、空腹血糖(FBG)、血压(BP)、腰臀比(waist-to-hip ratio, WHR),以及RP样本的病理学特征。
1.2 MetS及其各项指征根据美国国家胆固醇教育计划成人治疗批南Ⅲ(NCEP-ATPⅢ),将MetS定义为同时出现以下5个风险指征中的3项或以上:(1)中心性肥胖,腰臀比是中心性肥胖特异性检测指标,WHR≥0.9为中心性肥胖;(2)高血压,BP > 130/85 mmHg或正在服用抗高血压药物;(3)高血糖,以空腹血糖为检测指标,FBG≥110 mg/dl,或已接受相应治疗,或此前诊断为2型糖尿病;(4)高甘油三酯,TG≥150 mg/dl,或已接收相应治疗;(5)低水平高密度脂蛋白胆固醇,HDL-C < 40 mg/dl,或已接收相应治疗。将伴有MetS的患者设为MetS组(MetS),无MetS的患者为非MetS组(No MetS)。
1.3 PCa分级及分期局部侵袭性癌症为pT-分期≥3;采用国际泌尿外科病理(International Society of Urological Pathology, ISUP)协会Gleason分级进行病理分级。
1.4 定性和定量分析定性与定量实验采用卡方检验和Wilcoxon检验进行分析;MetS及其各项指标与病理数据的相关性采用回归分析进行评估。所有评估中采用单变量分析的参数均纳入多变量分析,以避免由于各变量间复杂的相互作用造成的不可预见的偏差。
1.5 统计学分析所有实验数据均用统计软件SPSS22.0处理,P < 0.05为差异有统计学意义。
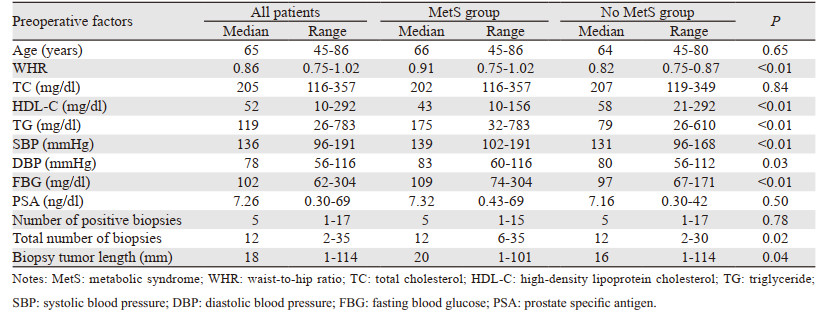
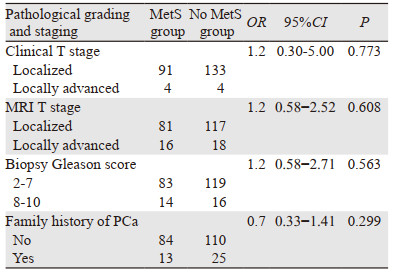
2 结果 2.1 患者术前风险指征与MetS相关性参与研究的232例接受RP治疗的PCa患者中,平均年龄为65.3(45~86)岁,其中97例患者(41.8%)伴有MetS,与No MetS相比,伴有MetS的患者WHR值、总胆固醇水平、TG水平、BP值、FBG水平以及HDL-C水平均更高(均P < 0.01)。两组患者在术前PSA、临床T-分期、MRI T-分期、活检Gleason评分方面并无显著差异,见表 1~2。
|
|
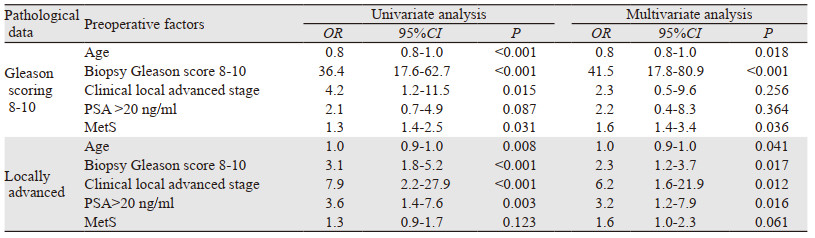
在单一变量分析中,MetS与更高风险的Gleason评分≥4显著相关(优势比(OR)=1.3;95%CI: 1.4~2.5; P=0.031)。同时,将MetS、年龄、活检Gleason评分、临床T-分期及PSA对RP样本病理特征的影响通过多变量分析进行评估,见表 3。结果表明MetS是影响RP术后Gleason评分≥8的独立风险因素(OR=1.6; 95%CI: 1.4~3.4; P=0.036)。
|
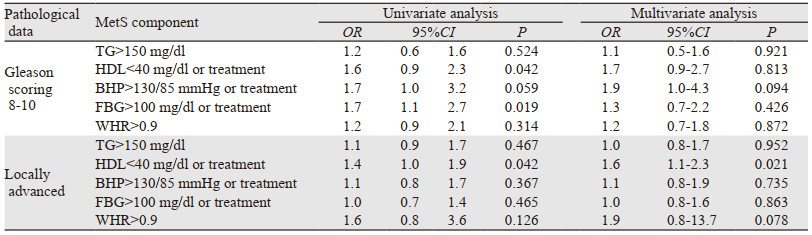
单变量分析结果表明,HDL-C < 40 mg/dl或接受血脂异常治疗的患者具有高风险的Gleason评分≥8及局部晚期PCa(OR=1.6, 95%CI: 0.9~2.3, P=0.042; OR=1.4, 95%CI: 1.0~1.9, P=0.042)。FBG > 110 mg/dl或接受糖尿病治疗与高风险的Gleason评分≥8显著相关(OR=1.7, 95%CI: 1.1~2.7, P=0.019);多变量分析结果表明,与所有MetS指标矫正后,低水平HDL-C是影响局部晚期PCa的独立因素(OR=1.6, 95%CI: 1.1~2.3, P=0.021),见表 4。
|
随着患者MetS指征项数的增多,ORs逐步增大,出现不良病理特征的风险增加;特别是当患者具备4个或以上MetS指征时,与高风险的Gleason评分≥8发生率显著相关(OR=1.9, 95%CI: 1.1~3.6, P < 0.001),见表 5。
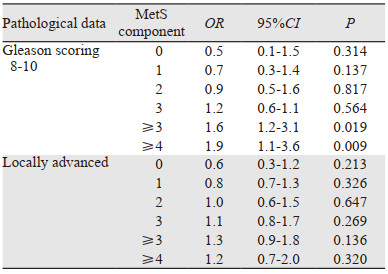
|
本研究旨在探究MetS与高危性PCa的RP样本的不良病理特征之间的相关性。我们发现接受RP手术的患者中有41.8%伴有MetS。这一结果与已有报道相符[12-13]。尽管MetS不影响医生对RP的判断,但由于MetS在所研究人群中的高发使得MetS成为临床中不可忽视的评估指标之一。
多变量分析包括了术前PSA、年龄、组织活检Gleason评分、临床T-分期,结果表明MetS是影响RP术后Gleason评分≥8的独立风险因素。与之前有关MetS于RP病例数据相关性报道的结果一致[14]。
单独考察每个MetS指标,结果表明在MetS各项指征中,低水平HDL-C与局部晚期PCa、高分级PCa相关。多变量分析结果表明低水平HDL-C是一项预测局部晚期PCa的独立指标。流行病学研究指出高水平血清胆固醇与PCa侵袭性呈正相关,且对具有降低晚期PCa风险的他汀类药物有保护作用[3]。此外,已有报道证实HDL-C水平与高风险PCa或高分期疾病呈负相关[15]。细胞内胆固醇作为合成雄激素的底物并通过调控AKT信号通路促进PCa发展[14]。然而,由于HDL-C能够将胆固醇从细胞运输到肝脏,可能通过减少前列腺组织中有害的胆固醇从而发挥阻碍疾病发展的作用。除了反向运输胆固醇发挥作用外,HDL-C还具有抗炎和抗氧化的作用[16]。对于MetS指标累计数量的影响,≥3项指征和≥4指征与更高风险ISUP分级≥4显著相关。随着MetS指征数目的增长,ORs递增。在基于前列腺活检结果的研究中,Sourbeer小组于2015年报道了与高风险高分期PCa与MetS显著相关,但未发现与MetS指标数量的相关性[17]。De Nunzio小组报道了MetS指标数量与高分期PCa显著相关,但未发现单独的MetS指标与PCa的相关性[18]。
本研究的优势在于其对前瞻性和多变量的设计,可以有效地评估MetS对预测侵袭性PCa不良病理特征的预测价值,包括Gleason评分、临床T分期等。但本研究也存在局限性:首先,未考察复发率及存活率;然后,未收集可能影响患者MetS和PCa预后的因素,例如体力活动及饮食方面的信息[19];最后,由于涉及多参数研究,可能有多个比较偏差,所以P值很重要。
随着全球范围内MetS发生率的增长,针对MetS对癌症预影响的研究及应对策略显得尤为重要。本研究发现MetS、低水平HDL-C及MetS指征累计数量是高分期PCa,局部晚期PCa的独立风险因素。除增加心脑血管疾病的风险外,MetS还可能增加恶性肿瘤的发病率与死亡率[1]。因此,我们设想采用合并治疗MetS可能提高PCa得到治疗效果。
总之,本研究发现MetS是侵袭性PCa的独立预测指标之一。MetS多项指标中,低水平HDL-C与局部晚期PCa及高分期PCa相关。
作者贡献:
韩俊岭:执行实验、整理分析数据、撰写文章
陈昆:提供病理阅片资料
翟晓磊、韩前河:病理技术操作
单中杰:论文指导
| [1] |
Saklayen MG. The Global Epidemic of the Metabolic Syndrome[J]. Curr Hypertens Rep, 2018, 20(2): 12. DOI:10.1007/s11906-018-0812-z |
| [2] |
梁桐, 刘华杰, 达明绪. 代谢综合征与胃癌发病风险的Meta分析[J]. 肿瘤防治研究, 2021, 48(3): 268-273. [Liang T, Liu HJ, Da MX. Metabolic Syndrome and Risk of Gastric Cancer: A Meta-analysis[J]. Zhong Liu Fang Zhi Yan Jiu, 2021, 48(3): 268-273. DOI:10.3971/j.issn.1000-8578.2021.20.0957] |
| [3] |
Dawson JK, Dorff TB, Todd Schroeder E, et al. Impact of resistance training on body composition and metabolic syndrome variables during androgen deprivation therapy for prostate cancer: a pilot randomized controlled trial[J]. BMC cancer, 2018, 18(1): 368. DOI:10.1186/s12885-018-4306-9 |
| [4] |
Hammarsten J, Damber JE, Haghsheno MA, et al. A stage-dependent link between metabolic syndrome components and incident prostate cancer[J]. Nat Rev Urol, 2018, 15(5): 321-333. DOI:10.1038/nrurol.2018.8 |
| [5] |
Schatten H. Brief Overview of Prostate Cancer Statistics, Grading, Diagnosis and Treatment Strategies[J]. Adv Exp Med Biol, 2018, 1095: 1-14. |
| [6] |
韩俊岭, 陈昆, 马杰锋, 等. 沉默LMTK2对去势抵抗性前列腺癌PC3细胞增殖的影响[J]. 中国肿瘤, 2019, 28(1): 63-68. [Han JL, Chen K, Ma JF, et al. The effect of silencing LMTK2 on the proliferation of castration-resistant prostate cancer PC3 cells[J]. Zhongguo Zhong Liu, 2019, 28(1): 63-68.] |
| [7] |
Caliskan S, Kaba S, Özsoy E, et al. The effect of metabolic syndrome on prostate cancer final pathology[J]. J Cancer Res Ther, 2019, 15(Supplement): S47-S50. |
| [8] |
De Nunzio C, Brassetti A, Simone G, et al. Metabolic syndrome increases the risk of upgrading and upstaging in patients with prostate cancer on biopsy: a radical prostatectomy multicenter cohort study[J]. Prostate Cancer Prostatic Dis, 2018, 21(3): 438-445. DOI:10.1038/s41391-018-0054-9 |
| [9] |
Liu W, Li W, Wang Z, et al. Metabolically Abnormal Obesity Increases the Risk of Advanced Prostate Cancer in Chinese Patients Undergoing Radical Prostatectomy[J]. Cancer Manag Res, 2020, 12: 1779-1787. DOI:10.2147/CMAR.S242193 |
| [10] |
Morlacco A, Dal Moro F, Rangel LJ, et al. Impact of metabolic syndrome on oncologic outcomes at radical prostatectomy[J]. Urol Oncol, 2018, 36(12): 528. e1-528. e6. DOI:10.1016/j.urolonc.2018.10.003 |
| [11] |
Epstein JI, Amin MB, Fine SW, et al. The 2019 Genitourinary Pathology Society (GUPS) White Paper on Contemporary Grading of Prostate Cancer[J]. Arch Pathol Lab Med, 2021, 145(4): 461-493. DOI:10.5858/arpa.2020-0015-RA |
| [12] |
Bhindi B, Xie WY, Kulkarni GS, et al. Influence of metabolic syndrome on prostate cancer stage, grade, and overall recurrence risk in men undergoing radical prostatectomy[J]. Urology, 2016, 93: 77-85. DOI:10.1016/j.urology.2016.01.041 |
| [13] |
De Nunzio C, Simone G, Brassetti A, et al. Metabolic syndrome is associated with advanced prostate cancer in patients treated with radical retropubic prostatec- tomy: results from a multicentre prospective study[J]. BMC Cancer, 2016, 16: 407. DOI:10.1186/s12885-016-2442-7 |
| [14] |
Pandey M, Cuddihy G, Gordon JA, et al. Inhibition of Scavenger Receptor Class B Type 1 (SR-B1) Expression and Activity as a Potential Novel Target to Disrupt Cholesterol Availability in Castration-Resistant Prostate Cancer[J]. Pharmaceutics, 2021, 13(9): 1509. DOI:10.3390/pharmaceutics13091509 |
| [15] |
Salgado-Montilla J, Soto Salgado M, Surillo Trautmann B, et al. Association of serum lipid levels and prostate cancer severity among Hispanic Puerto Rican men[J]. Lipids Health Dis, 2015, 14: 111. DOI:10.1186/s12944-015-0096-0 |
| [16] |
Kumar N, Mandal CC. Cholesterol-Lowering Drugs on Akt Signaling for Prevention of Tumorigenesis[J]. Front Genet, 2021, 12: 724149. |
| [17] |
Sourbeer KN, Howard LE, Andriole GL, et al. Metabolic syndrome-like components and prostate cancer risk: results from the Reduction by Dutasteride of Prostate Cancer Events (REDUCE) study[J]. BJU Int, 2015, 115(5): 736-743. DOI:10.1111/bju.12843 |
| [18] |
De Nunzio C, Presicce F, Lombardo R, et al. Physical activity as a risk factor for prostate cancer diagnosis: a prospective biopsy cohort analysis[J]. BJU Int, 2016, 117(6B): E29-35. |
 2022, Vol. 49
2022, Vol. 49


