文章信息
- IGF1受体的β亚基突变体对人骨肉瘤细胞增殖、迁移和凋亡的影响
- Effect of IGF1Rβ Subunit Mutants on Proliferation, Migration and Apoptosis of Human Osteosarcoma Cells
- 肿瘤防治研究, 2022, 49(5): 390-395
- Cancer Research on Prevention and Treatment, 2022, 49(5): 390-395
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2022.21.1104
- 收稿日期: 2021-09-28
- 修回日期: 2022-03-01
2. 410008 长沙,国家老年疾病临床医学研究中心(湘雅医院);
3. 412007 株洲,株洲市中心医院院感科
2. National Clinical Research Center for Geriatric Disorders (Xiangya Hospital), Changsha 410008, China;
3. Department of Hospital-Acquired Infection Control, Zhuzhou Central Hospital, Zhuzhou 412007, China
骨肉瘤是儿童和青少年人群最常见的原发性恶性骨肿瘤[1-2]。随着骨肉瘤治疗方式的不断进步,患者的生存时间与生存质量均大幅提升,但骨肉瘤患者5年无病生存率仍维持在60%~70%,其治疗进入平台期[2-5]。
胰岛素样生长因子1受体(insulin-like growth factor 1 receptor, IGF-1R)与骨肉瘤的发生发展关系密切,以往研究多以阻断胞内信号转导或直接针对IGF-1或IGF-1R设计抗体药物[6-8],但是现有的临床研究结果不理想[4, 9-21],归其原因是IGF-1R与胰岛素受体的同源性。运用抗IGF1R的单克隆抗体常易引起高血糖症与高胰岛素血症,此外,IGF1R受体被单克隆抗体阻断之后,机体会代偿性分泌大量的IGF1因子和生长激素,使两者在身体循环中的水平大幅提升,易诱导患者出现胰岛素抵抗。这常被视为IGF受抑制之后机体对IGF缺乏的一种补偿。因此,抗IGF1R的单克隆抗体存在有效性不足与可能引起代谢紊乱的不良反应[10-13, 22]。研究表明,通过设计IGF1R可溶性肽段来竞争性抑制OS生物学行为是可行的[23],而至今尚没有单独针对IGF1R的β亚基是否可以抑制骨肉瘤细胞增殖和转移,并促进骨肉瘤细胞凋亡的研究。
本研究针对IGF1Rβ亚基的分泌段(s)和跨膜段(m),分别设计sb-IGF1R、ma-IGF1R两个可溶性突变体。观察两者对骨肉瘤143B细胞生物学行为的影响。明晰其在骨肉瘤中是否具有抑制骨肉瘤生长和转移,从而为骨肉瘤的防治寻找新的有效策略。
1 材料与方法 1.1 主要材料 1.1.1 细胞株人骨肉瘤细胞系143B购自美国ATCC公司。
1.1.2 质粒piggyBac转座系统与AdEasy系统均由芝加哥大学医学中心骨科分子肿瘤学实验室自创。
1.1.3 主要试剂与仪器MTT、TRIzol试剂购自美国Thermo Fisher Scientific公司;活体动物成像技术Xenogen试剂购自美国Xenogen公司;Hoechst试剂购自美国BioLab实验室;结晶紫试剂购自美国Sigma公司;Real-time PCR试剂盒购自中国翊圣生物科技有限公司。流式细胞仪(ALTRA)、定量PCR仪(5700型)、超低温冰箱均购自美国Thermo Fisher Scientific公司;紫外/可见光分光光度仪(DU-640)购自美国Beckman公司;荧光显微镜购自德国Leica公司;PCR基因扩增仪(9600型)购自美国PE公司。
1.2 研究方法 1.2.1 骨肉瘤细胞的培养取生长状态良好的骨肉瘤143B细胞,应用常规高糖DMEM培养基+10%胎牛血清+1%青链霉素(美国Gibco公司),置于含5%CO2、37℃培养箱中培养。
1.2.2 质粒的构建根据IGF1R结构,见图 1A,对β亚基的分泌段(s)和β亚基跨膜段(m)分别设计了一个可溶性肽段sb-IGF1R(741-936aa)和可附着于膜外的(membrane-anchored)ma-IGF1R(741-959aa),见图 1B。将设计好的两种针对IGF1Rβ亚基的可溶性肽段通过PCR扩增获得sb-IGF1R与ma-IGF1R的片段,利用AdEasy系统,按照经典分子克隆方法进酶切、沉淀、连接等步骤将目的片段克隆进穿梭质粒pAdTrace中。将电转产物涂抹到含有卡那霉素的LB培养板培养,挑选阳性克隆,通过PCR筛选,酶切鉴定,PCR鉴定,测序之后,将正确克隆扩增,抽提质粒保存。
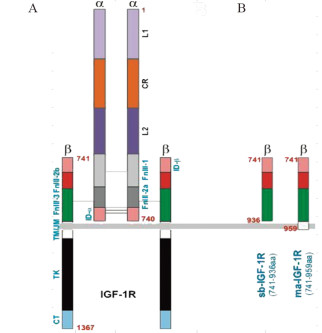
|
| 图 1 IGF1R结构示意图(A)以及针对β亚基设计的两个可溶性肽段sb-IGF1R和ma-IGF-1R(B) Figure 1 Structure diagram of IGF1(A) and design of sbIGF1R and ma-IGF1R(B) |
将带有不同目的片段的pAdTrace质粒进行EcoRⅠ酶切反应,然后电转到BJ-AdEasy1细菌中进行重组,将重组质粒提取后转染到普通HEK293细胞,包装成腺病毒,裂解并收集第一轮病毒,经3~4轮扩增后得到较高滴度、可用于实验的腺病毒液Ad-sbIGF1R和Ad-maIGF1R组。构建IGF1R的RNA干扰腺病毒Ad-GFP,作为验证Ad-sbIGF1R和Ad-maIGF1R有效性的阴性对照组。
1.2.4 实时定量PCR实验采用TRIzol及酚-氯仿法提取制备总RNA,反转录成cDNA之后于-20℃保存。采用iQ5 Real-time PCR检测系统。反应条件:95℃变性5 min;95℃变性10 s,60℃退火30 s,72℃延伸1 min,共扩增35个循环。最后72℃延伸5 min。反应结束后统计每个样本反应的Ct值。GAPDH引物序列:上游引物:5’-AGCCGAAGCAGGAACACC-3’;下游引物:5’-TCAGCCTCGTGGTTGCAG-3’。
1.2.5 骨肉瘤细胞增殖、凋亡和迁移能力实验MTT实验检测骨肉瘤细胞增殖,将培养细胞接种于培养板中,各组经不同条件处理后,弃上清液,按试剂盒说明进行操作。过表达的两组Ad-sbIGF1R、Ad-maIGF1R腺病毒分别处理骨肉瘤143B细胞,48和72 h后行Hoechst染色,荧光显微镜观察各组细胞形态变化,每个时间点分别重复三次。培养的细胞经消化、收集重悬后用70%酒精固定,流式细胞术检测细胞凋亡情况。细胞划痕实验检测各组骨肉瘤143B细胞迁移能力,各组感染率均在60%左右,用移液器枪头划痕,分别在0、24和48 h针对同一视野摄像,观察细胞的迁移能力。用Image J软件分析各组细胞迁移面积。
1.2.6 裸鼠皮下荷瘤实验采用4周雄性裸鼠制作肿瘤模型。所有动物饲养和处理程序均由中南大学湘雅三医院机构动物护理和使用委员会批准。收集对数生长期不同种类的骨肉瘤细胞,于小鼠四肢根部及胸部行皮下注射,第6、9、12天用直尺测量肿瘤体积,在第12天对小鼠进行活体成像,观察肿瘤在小鼠皮下的生长和定植情况。定量分析采用Xenogen公司的活成像V2.50.1软件。待观察结束,在第12天处死小鼠,收集肿瘤组织,用HE染色观察病理形态。
1.2.7 病理学分析组织切片HE染色:新鲜组织从小鼠体内分离后迅速放入4%多聚甲醛中,4℃固定过夜,梯度酒精脱水,二甲苯透明,石蜡包埋,切片。经脱蜡水合后可用于化学染色。
1.3 统计学方法采用GraphPad5软件进行数据整理和统计分析,计量资料以(x±s)表示,P < 0.05为差异有统计学意义。两两之间比较采用双尾Student’s t检验。
2 结果 2.1 构建后的Ad-sbIGF1R、Ad-maIGF1R在骨肉瘤143B细胞中的表达结果结果显示,Ad-sbIGF1R和Ad-maIGF1R两种可溶性肽段成功转染骨肉瘤143B细胞,见图 2A。对转染的骨肉瘤细胞株143B进行半定量RT-PCR分析,结果显示,与对照组Ad-GFP相比,Ad-sbIGF1R和Ad-maIGF1R在骨肉瘤细胞中明显呈高表达(P < 0.001),见图 2B。
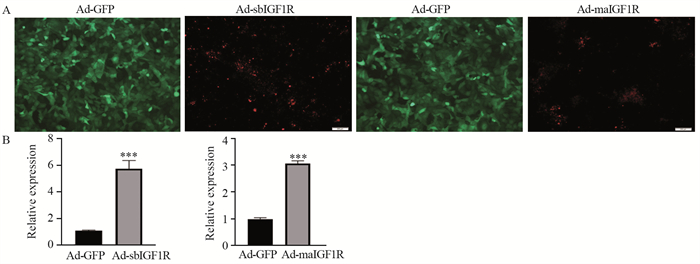
|
| ***: P < 0.001, compared with the Ad-GFP group. A: Ad-sbIGF1R and AdmaIGF1R were successfully transfected into osteosarcoma cell 143B; B: expression of recombinant adenovirus Ad-sbIGF1R and Ad-maIGF1R in osteosarcoma cells. 图 2 Ad-sbIGF1R和Ad-maIGF1R对骨肉瘤细胞143B细胞的转染情况 Figure 2 Transfection of osteosarcoma cells by Ad-sbIGF1R and Ad-maIGF1R |
划痕实验结果显示,与Ad-GFP对比,Ad-sbIGF1R和Ad-maIGF1R组骨肉瘤细胞的迁移受到抑制。与Ad-GFP对照组相比,Ad-sbIGF1R和Ad-maIGF1R组的骨肉瘤细胞愈合率均下降,差异有统计学意义(均P < 0.01),见图 3。
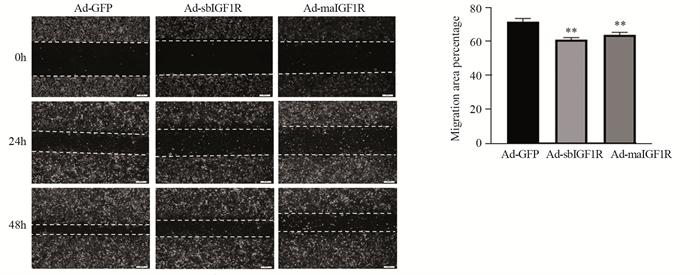
|
| **: P < 0.01, compared with Ad-GFP group. 图 3 胰岛素样生长因子1受体的β亚基突变体对骨肉瘤143B细胞迁移能力的影响 Figure 3 Effect of Ad-sbIGF1R and Ad-maIGF1R on migration of osteosarcoma 143B cells |
MTT实验结果表明,在低血清(1%FBS)或无血清培养条件下,Ad-sbIGF1R、Ad-maIGF1R对骨肉瘤细胞的增殖均具有抑制作用。其中,Ad-sbIGF1R效果最显著。收集无血清培养组的细胞,裂解后,分光光度计检测细胞的吸光度值,在分别处理24、48、72 h后,与Ad-IGF相比,Ad-sbIGF1R明显抑制骨肉瘤细胞143B增殖,差异有统计学意义(P < 0.05),见图 4。
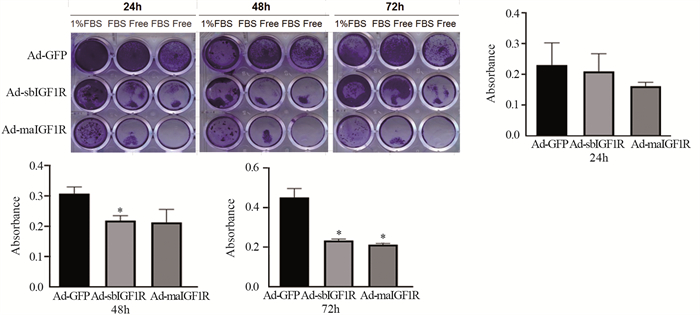
|
| *: P < 0.05, compared with Ad-GFP. 图 4 Ad-sbIGF1R、Ad-maIGF1R对骨肉瘤细胞143B增殖能力的影响 Figure 4 Effect of Ad-sbIGF1R and AdmaIGF1R on proliferation of osteosarcoma 143B cells |
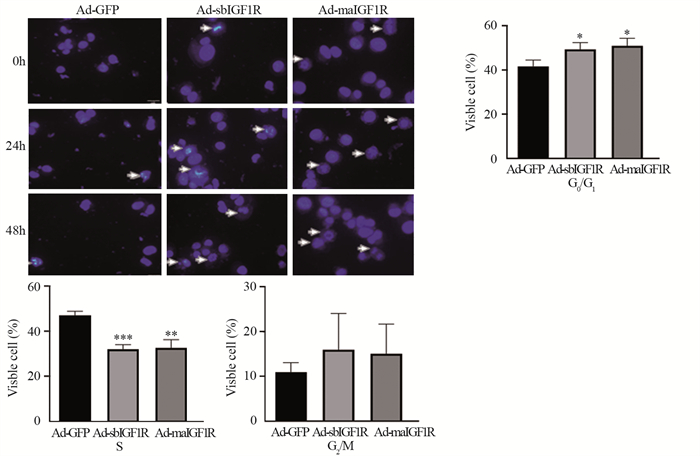
与对照组相比,Ad-sbIGF1R、Ad-maIGF1R组分别在处理骨肉瘤143B细胞48和72 h后,可见两组细胞核及细胞形态变化明显,两组凋亡细胞所呈现的核固缩、溶解、碎裂更多,如图 5中箭头所示,细胞膜及细胞器膜相对完整,但细胞体积变小。细胞周期分析结果显示:与空白对照组相比,Ad-sbIGF1R和Ad-maIGF1R组的G0/G1期细胞数明显增加(P < 0.05),S期细胞数明显降低(P < 0.01),其中Ad-sbIGF1R组的S期细胞数降低最明显(P < 0.001),见图 5。
|
| *: P < 0.05; **: P < 0.01; ***: P < 0.001, compared with Ad-GFP group. 图 5 Ad-sbIGF1R,Ad-maIGF1R对骨肉瘤细胞凋亡的影响 Figure 5 Effect of Ad-sbIGF1R and AdmaIGF1R on apoptosis of osteosarcoma cells |
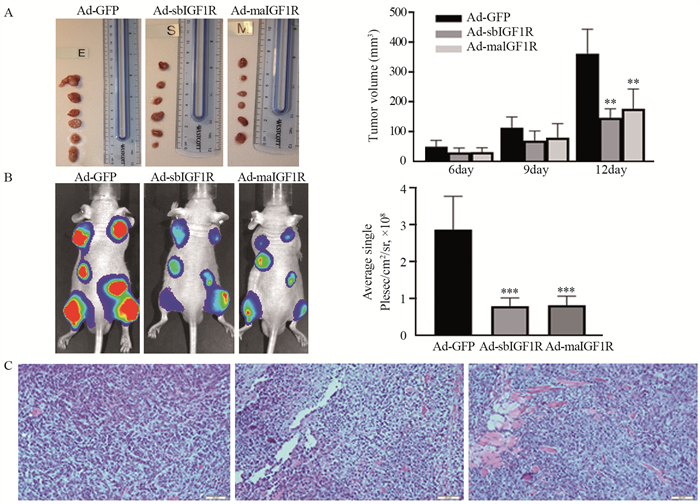
荷瘤实验结果显示,Ad-sbIGF1R、Ad-maIGF1R两组突变体有效抑制了种植在裸鼠皮下的骨肉瘤细胞生长;Ad-sbIGF1R、Ad-maIGF1R转染的143B细胞,注射4周后观察裸鼠皮下肿瘤大体观,可见Ad-sbIGF1R、Ad-maIGF1R组裸鼠平均肿瘤体积明显小于Ad-GFP对照组,差异有统计学意义(P < 0.01),见图 6A。
|
| **: P < 0.01, ***: P < 0.001, compared with Ad-GFP group. A: subcutaneous tumor growth in nude mice 4 weeks after injection of Ad-sbIGF1R and Ad-maIGF1R infected osteosarcoma cells; B: in vivo performance of the technique was affected after two weeks of subcutaneous injection; C: microscopic appearance of tumor masses in each group was stained by HE. 图 6 Ad-sbIGFIR和Ad-maIGF1R抑制骨肉瘤在小鼠体内的生长 Figure 6 Ad-sbIGFIR and Ad-maIGF1R inhibited osteosarcoma growth in mice |
活体成像显示,在皮下注射12天后的突变体与对照组相比,两个突变体组成像信号明显较低,表明肿瘤生长明显抑制;量化分析活体成像的数据,结果显示差异有统计学意义(P < 0.001),见图 6B;HE染色结果显示,各组肿瘤在显微镜下表现为典型的骨肉瘤,且两种IGF1Rβ亚基突变体诱导的肿块坏死明显,增殖细胞明显减少,见图 6C。
3 讨论IGF信号在正常骨的生长和发育过程中发挥关键作用,其主要信号分子IGF1和IGF2以多肽的形式通过内分泌、旁分泌和自分泌的方式发挥作用,它们的受体IGF1R可以形成同源二聚体,也可以与胰岛素受体(insulin receptor, IR)一起形成IR/IGF1R杂交受体。两类受体都能被IGF1与IGF2所激活,并触发IGF1R自身的磷酸化以及下游的信号转导,包括PI3K/AKT和Ras/Raf/ERK信号通路,而这些通路被广泛认为与癌症发生密切相关[20-21, 24]。IGF1R通路在肿瘤的恶性转化过程中被认为是不可或缺的,其在体内的表达水平与癌症发生密切相关。儿童及青少年最常发生的骨肉瘤部位是长骨的干骺端,此处也是IGFs水平最高的区域。而在IGF信号缺失的情况下,癌症的发生率也将降低。Kuijjer等运用全基因组表达分析技术发现高级骨肉瘤活检标本与细胞系中,IGF1R均高表达,而与之相反,其上游的抑制因子表达却下调[20]。与此同时,也有研究发现IGF信号通路参与骨肉瘤的生长、转移等生物学行为,激活后的IGF1R触发下游的分子事件,促使肿瘤细胞表现出更强的增殖、抗凋亡和转移能力[22]。
IGF1R是一种四聚体结构,由1 367个氨基酸组成的大分子结构,其拥有4个亚基,膜外2个α亚基和跨膜的两个β亚基。本研究提出了一种全新设计的阻断骨肉瘤IGF信号的策略,即针对IGF1Rβ亚基设计的两个“显性负性”可溶性突变体,分别为针对β亚基的sb-IGF1R(包括aa741-936)和根据β亚基跨膜段设计可锚定于膜上的ma-IGF1R(包括aa741-959)。这一设计避免了单克隆抗体治疗策略对胰岛素通路的“误伤”,能更加精确的作用于IGF通路,因此,分子量较小的IGF1R胞外可溶性短肽具有高度的特异性、有效性和体内负作用更小的优势。本研究将Ad-sbIGF1R、Ad-maIGF1R两种突变体成功转染骨肉瘤143B细胞后,结果显示细胞增殖、迁移均显著抑制,同时能诱导骨肉瘤细胞凋亡。MTT结果表明,Ad-sbIGF1R能更早抑制骨肉瘤细胞增殖,且抑制增殖效果更明显;并且Ad-sbIGF1R组的S期细胞数降低最明显,这可能是因为β亚基的分泌段(s)能更快接受到IGF配体。另外,Ad-sbIGF1R和Ad-maIGF1R似乎对G2/M期影响不大,两者可能是通过增加G0/G1期和减少S期抑制OS细胞进展。
综上所述,无论体外实验还是体内实验都提示可溶性突变体可能通过竞争性结合大部分胰岛素样受体配体来抑制骨肉瘤的增殖和转移,以及促进骨肉瘤细胞的凋亡。这种改良后的IGF1R受体,可能为临床治疗的应用提供了一种全新的思路,减少对生理性胰岛素通路的影响。后续工作中,将进一步探讨Ad-sbIGF1R和Ad-maIGF1R影响骨肉瘤细胞及小鼠肿瘤生长的分子机制。
作者贡献:
文中驰:实验实施、数据整理、结果分析及论文撰写
何洪波:指导实验技术及论文写作
章灿:实验数据及结果分析
刘育鹏:指导实验技术
廖瞻:提供基金支持、指导实验设计及论文写作、修改和审核
曾莉怡:指导实验设计、数据审核及文章修改
| [1] |
Miller KD, Fidler-Benaoudia M, Keegan TH, et al. Cancer statistics for adolescents and young adults[J]. CA Cancer J Clin, 2020, 70(6): 443-459. DOI:10.3322/caac.21637 |
| [2] |
Letaief F, Khrouf S, Yahiaoui Y, et al. Prognostic factors in High-Grade Localized Osteosarcoma of the Extremities: The Tunisian Experience[J]. J Orthop Surg (Hong Kong), 2020, 28(3): 2309499020974501. |
| [3] |
Longhi A, Bielack SS, Grimer R, et al. Extraskeletal osteosarcoma: A European Musculoskeletal Oncology Society study on 266 patients[J]. Eur J Cancer, 2017, 74: 9-16. DOI:10.1016/j.ejca.2016.12.016 |
| [4] |
Paapsi K, Baburin A, Mikkel S, et al. Childhood cancer incidence and survival trends in Estonia (1970-2016): a nationwide population-based study[J]. BMC Cancer, 2020, 20(1): 30. DOI:10.1186/s12885-019-6510-7 |
| [5] |
Miller KD, Nogueira L, Mariotto AB, et al. Cancer treatment and survivorship statistics, 2019[J]. CA Cancer J Clin, 2019, 69(5): 363-385. DOI:10.3322/caac.21565 |
| [6] |
Tian Z, Niu X, Yao W. Receptor Tyrosine Kinases in Osteosarcoma Treatment: Which Is the Key Target?[J]. Front Oncol, 2020, 10: 1642. DOI:10.3389/fonc.2020.01642 |
| [7] |
Luk F, Yu Y, Walsh WR, et al. IGF1R-targeted therapy and its enhancement of doxorubicin chemosensitivity in human osteosarcoma cell lines[J]. Cancer Invest, 2011, 29(8): 521-532. DOI:10.3109/07357907.2011.606252 |
| [8] |
Hua H, Kong Q, Yin J, et al. Insulin-like growth factor receptor signaling in tumorigenesis and drug resistance: a challenge for cancer therapy[J]. J Hematol Oncol, 2020, 13(1): 64. DOI:10.1186/s13045-020-00904-3 |
| [9] |
Biermann JS, Chow W, Reed DR, et al. NCCN Guidelines Insights: Bone Cancer, Version 2.2017[J]. J Natl Compr Canc Netw, 2017, 15(2): 155-167. DOI:10.6004/jnccn.2017.0017 |
| [10] |
Cao Y, Roth M, Piperdi S, et al. Insulin-like growth factor 1 receptor and response to anti-IGF1R antibody therapy in osteosarcoma[J]. PLoS One, 2014, 9(8): e106249. DOI:10.1371/journal.pone.0106249 |
| [11] |
Fettig LM, Yee D. Advances in insulin-like growth factor biology and -directed cancer therapeutics[J]. Adv Cancer Res, 2020, 147: 229-257. |
| [12] |
Kuijjer ML, Peterse EF, van den Akker BE, et al. IR/IGF1R signaling as potential target for treatment of high-grade osteosarcoma[J]. BMC Cancer, 2013, 13: 245. DOI:10.1186/1471-2407-13-245 |
| [13] |
Singh P, Alex JM, Bast F. Insulin receptor (IR) and insulin-like growth factor receptor 1 (IGF-1R) signaling systems: novel treatment strategies for cancer[J]. Med Oncol, 2014, 31(1): 805. DOI:10.1007/s12032-013-0805-3 |
| [14] |
Bano N, Hossain MM, Bhat AQ, et al. Analyzing structural differences between insulin receptor (IR) and IGF1R for designing small molecule allosteric inhibitors of IGF1R as novel anti-cancer agents[J]. Growth Horm IGF Res, 2020, 55: 101343. DOI:10.1016/j.ghir.2020.101343 |
| [15] |
Beltran PJ, Chung YA, Moody G, et al. Efficacy of ganitumab (AMG 479), alone and in combination with rapamycin, in Ewing' s and osteogenicsarcoma models[J]. J Pharmacol Exp Ther, 2011, 337(3): 644-654. DOI:10.1124/jpet.110.178400 |
| [16] |
Li YS, Liu Q, He HB, et al. The possible role of insulin-like growth factor-1 in osteosarcoma[J]. Curr Probl Cancer, 2019, 43(3): 228-235. DOI:10.1016/j.currproblcancer.2018.08.008 |
| [17] |
Hua H, Kong Q, Yin J, et al. Insulin-like growth factor receptor signaling in tumorigenesis and drug resistance: a challenge for cancer therapy[J]. J Hematol Oncol, 2020, 13(1): 64. DOI:10.1186/s13045-020-00904-3 |
| [18] |
Cao J, Yee D. Disrupting Insulin and IGF Receptor Function in Cancer[J]. Int J Mol Sci, 2021, 22(2): 555. DOI:10.3390/ijms22020555 |
| [19] |
Rigiracciolo DC, Nohata N, Lappano R, et al. IGF-1/IGF-1R/FAK/YAP Transduction Signaling Prompts Growth Effects in Triple-Negative Breast Cancer (TNBC) Cells[J]. Cells, 2020, 9(4): 1010. DOI:10.3390/cells9041010 |
| [20] |
Kuijjer ML, Peterse EF, van den Akker BE, et al. IR/IGFIR signaling as potential target for treatment of high-grade osteosarcoma[J]. BMC Cancer, 2013, 13: 245. DOI:10.1186/1471-2407-13-245 |
| [21] |
Prager D, Li HL, Asa S, et al. Dominant negative inhibition of tumorigenesis in vivo by human insulin-like growth factor I receptor mutant[J]. Proc Natl Acad Sci U S A, 1994, 91(6): 2181-2185. DOI:10.1073/pnas.91.6.2181 |
| [22] |
Kansara M, Teng MW, Smyth MJ, et al. Translational biology of osteosarcoma[J]. Nat Rev Cancer, 2014, 14(11): 722-735. DOI:10.1038/nrc3838 |
| [23] |
Cao D, Lei Y, Ye Z, et al. Blockade of IGF/IGF-1R signaling axis with soluble IGF-1R mutants suppresses the cell proliferation and tumor growth of human osteosarcoma[J]. Am J Cancer Res, 2020, 10(10): 3248-3266. |
| [24] |
Fujita M, Ieguchi K, Cedano-Prieto DM, et al. An integrin binding-defective mutant of insulin-like growth factor-1 (R36E/R37E IGF1) acts as a dominant-negative antagonist of the IGF1 receptor (IGF1R) and suppresses tumorigenesis but still binds to IGF1R[J]. J Biol Chem, 2013, 288(27): 19593-19603. DOI:10.1074/jbc.M113.470872 |
 2022, Vol. 49
2022, Vol. 49


