文章信息
- Sema6D对人骨肉瘤细胞增殖、迁移、侵袭及血管形成能力的影响及机制
- Effect of Sema6D on Proliferation, Migration, Invasion and Angiogenesis-promoting Ability of Human Osteosarcoma Cells and Its Mechanism
- 肿瘤防治研究, 2022, 49(4): 314-321
- Cancer Research on Prevention and Treatment, 2022, 49(4): 314-321
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2022.21.0957
- 收稿日期: 2021-08-26
- 修回日期: 2022-01-05
2. 430071 武汉,武汉大学中南医院骨科
2. Department of Orthopaedics, Zhongnan Hospital of Wuhan University, Wuhan 430071, China
骨肉瘤(osteosarcoma, OS)恶性程度高,是最常见的原发性恶性骨肿瘤。新辅助化疗联合手术是骨肉瘤一线治疗方案,靶向治疗是目前骨肉瘤诊疗探索的新方向[1-2]。信号素(semaphorin, Sema)家族成员含有共同的Sema结构域以及与此相连的丛蛋白-信号蛋白-整合素区(plexin semaphorin integrin, PSI)。随着研究不断深入,信号素家族目前已有20多种亚型,在神经再生、血管生成、骨代谢、免疫代谢及肿瘤发生等过程中发挥重要作用[3-4]。信号素6D(Sema6D)是信号素Ⅵ家族的一员,有研究表明其在胃癌血管生成中发挥作用[5],但Sema6D在骨肉瘤中的作用尚不明确,因此本研究采用RNA干扰技术观察Sema6D对骨肉瘤细胞生物学行为的影响及其作用机制,为骨肉瘤的靶向治疗提供理论基础。
1 材料与方法 1.1 临床资料6例骨肉瘤及瘤旁组织均来源于武汉大学中南医院2020年9月—2021年9月病理诊断明确的骨肉瘤患者,所有组织来源均获得武汉大学中南医院医学伦理委员会批准。
1.2 主要试剂及仪器 1.2.1 细胞培养人成骨细胞hfob1.19和人骨肉瘤细胞系143B、MG63、U2OS购自中科院上海细胞库,人脐静脉内皮细胞HUVEC及人骨肉瘤细胞系HOS购自ATCC。高糖DMEM培养液、DMEM/F12培养液购自美国Gibco公司,MEM/EBSS培养液、Mycco’5A培养液购自美国Hyclone公司。所有细胞均添加10%FBS(Gibco,美国)和1%青/链霉素双抗(Biosharp,中国)培养。
1.2.2 主要仪器试剂RT-PCR仪(Bio-Rad,美国),酶标仪(Molecular Devices,美国),ECL发光成像(Tannon,中国)。RIPA裂解液(碧云天,中国),ECL反光液、TRIzol试剂(Vazyme,中国),反转录试剂盒(艾科瑞,中国),Western blot凝胶试剂盒(雅酶,中国),CCK-8试剂(美仑,中国),人Sema6D ELISA试剂盒(酶免,中国),Lipofectamine 3000 (Invitrogen,美国),Matrigel基质胶、Transwell小室(Corning,美国)。anti-Sema6D(Abcam,英国),anti-P-PI3K/ERK/p-ERK/p-mTOR(ZENBIO,中国),anti-GAPDH/AKT/p-AKT/mTOR(Proteintech,中国)。
1.3 实验方法 1.3.1 骨肉瘤细胞及组织中Sema6D mRNA表达情况检测骨肉瘤患者标本离体后及时液氮保存。按不同条件培养人成骨细胞hfob1.19及骨肉瘤细胞系143B、MG63、HOS和U2OS后收集一定数量细胞沉淀。TRIzol法提取组织及细胞中总RNA,逆转录后进行实时荧光定量PCR检测Sema6D mRNA表达。特异性引物序列如表 1所示,由北京擎科生物公司合成。
收集细胞后PBS洗涤两次,PIPA裂解提取总蛋白,BCA法测定浓度。取25 μg总蛋白进行SDS-PAGE凝胶电泳,恒流湿转法(275 mA,90 min)将蛋白转移到PVDF膜上。脱脂牛奶室温封闭1 h,加入1:1000稀释的Sema6D、GAPDH抗体,4℃摇床孵育过夜。次日用TBST漂洗(每次5 min,共5次),漂洗完成后加入辣根过氧化物酶标记的二抗室温孵育2 h,TBST再次漂洗后进行ECL发光显影,Image J软件分析结果。
1.3.3 si-RNA的合成及转染靶向siRNA序列及阴性对照由苏州吉玛基因公司设计合成,干扰序列见表 1。选取143B、MG63两种细胞进行实验,将生长状态良好的143B、MG63细胞分别加入含10%FBS的MEM、高糖DMEM培养基,放于37℃、5%CO2恒温箱中培养,按时更换培养基、传代。在转染前一夜,将细胞以1×106/ml接种于6孔板,融合度达50%~60%后使用脂质体LipofectamineTM 3000转染,24 h后收集细胞提取RNA,48 h后收集蛋白。细胞分为si-NC、si-1、si-2三组。
1.3.4 CCK-8细胞增殖实验转染48 h后,消化收集三组细胞计数重悬,按每孔100 μl均匀铺在96孔板中,800个细胞/孔。待贴壁后每孔加入CCK-8试剂10 μl,37℃孵育2 h至培养基颜色发生明显改变,使用酶标仪测定450 nm处细胞吸光度值,之后每间隔24 h检测一次,共测量5次。记录数据绘制细胞增殖曲线图。
1.3.5 划痕实验转染48 h后,消化收集三组细胞以一定密度铺至6孔板中,使孔中细胞24 h后长至完全融合为宜。选取200 μl无菌枪头从上到下均匀划线,PBS冲洗干净掉落细胞,每孔加入2 ml含5%血清的培养基继续培养24 h后使用倒置显微镜观察,并测量记录,划痕愈合率=(划痕面积0h–划痕面积24h)/划痕面积0h×100%。
1.3.6 细胞侵袭实验转染48 h后,消化收集三组细胞用PBS洗涤一遍后无血清培养基重悬,每组细胞按每孔20 000个均匀铺在预先铺好Matrigel基质胶(1:8稀释)的Transwell小室的上室中,下室加入15%FBS培养基继续培养。48 h后取出小室,弃去上室液体并用棉签擦拭,4%的多聚甲醛室温固定30 min后用0.05%的结晶紫染色,1 h后倒置显微镜观察并记录被染色的细胞数量。
1.3.7 体外血管形成实验转染24 h后,更换无血清培养基继续培养三组细胞48 h后收集细胞培养上清液,5000 r/min离心20 min留取上清液制成肿瘤条件培养基,按人Sema6D ELISA试剂盒定量测定TCM中Sema6D含量,剩余TCM放置-20℃保存备用。将生长状态良好的人脐静脉内皮细胞HUVECs按照一定密度均匀铺在6孔板中,待细胞融合度为50%~60%后弃去旧培养基,PBS清洗1次,使用不同TCM继续培养48 h。消化收集HUVECs,按照20 000个/孔均匀铺在预先铺有Matrigel基质胶(不稀释)的96孔板中,5 h后使用倒置显微镜观察并记录成管情况。
1.3.8 下游相关通路蛋白表达情况检测转染48 h后,收集三组细胞并用PBS洗涤1~2次,使用PIPA裂解提取细胞总蛋白,BCA法定量。取25 μg蛋白进行Western blot实验,方法同上。分别检测三组细胞中mTOR/ p-mTOR、AKT/p-AKT、ERK/p-ERK、p-PI3K蛋白表达情况,Image J软件进行灰度值分析。
1.4 统计学方法所有实验均独立重复3次。GraphPad Prism 8.0软件进行统计学分析,实验数据用均数±标准差(x±s)呈现,多组间选用单因素方差分析,两两比较采用LSD-t检验,P < 0.05为差异有统计学意义。
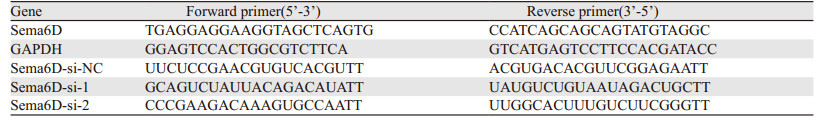
2 结果 2.1 骨肉瘤组织及细胞系中表达情况PCR结果显示在6名骨肉瘤患者中,5名患者肿瘤组织中Sema6D mRNA表达高于瘤旁组织(均P < 0.05),四种人骨肉瘤细胞中Sema6D表达均高于人成骨细胞hfob(均P < 0.05)。Western blot结果显示HOS细胞中Sema6D蛋白表达水平与hfob细胞差异无统计学意义(P=0.999),余三种骨肉瘤细胞Sema6D蛋白表达水平高(均P < 0.01),见图 1。选择Sema6D表达水平较高的143B和MG63细胞进行后续实验。
|
| P1-P6: Patients 1-6; *: P < 0.05; **: P < 0.01; ***: P < 0.001; ****: P < 0.0001, compared with hfob group. 图 1 人骨肉瘤组织(A)、人成骨细胞和骨肉瘤细胞系(B, C, D)中Sema6D的表达水平 Figure 1 Expression of Sema6D in human osteosarcoma tissues(A), human osteoblasts and osteosarcoma cell lines(B, C, D) |
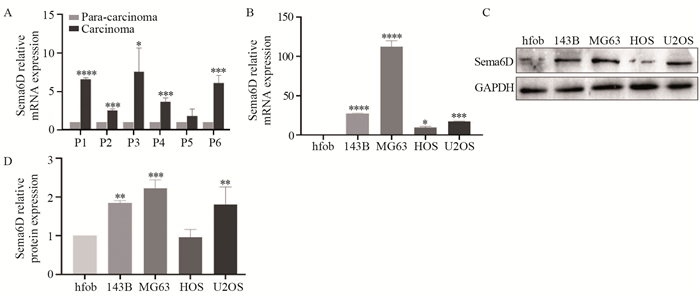
PCR结果显示,在143B和MG63中,si-1和si-2组Sema6D的mRNA表达明显低于si-NC组(均P < 0.001),见图 2A。Western blot结果显示,在143B和MG63中,si-1和si-2组Sema6D的蛋白表达明显低于si-NC组(均P < 0.001),见图 2B。以上结果表明两条siRNA均能有效降低143B及MG63细胞中Sema6D的表达。
|
| ***: P < 0.001, ****: P < 0.0001, compared with si-NC group. 图 2 siRNA转染后143B和MG63细胞中Sema6D mRNA(A)和蛋白(B)的表达水平 Figure 2 Expression of Sema6D mRNA(A) and protein(B) in 143B and MG63 cells after siRNA transfection |
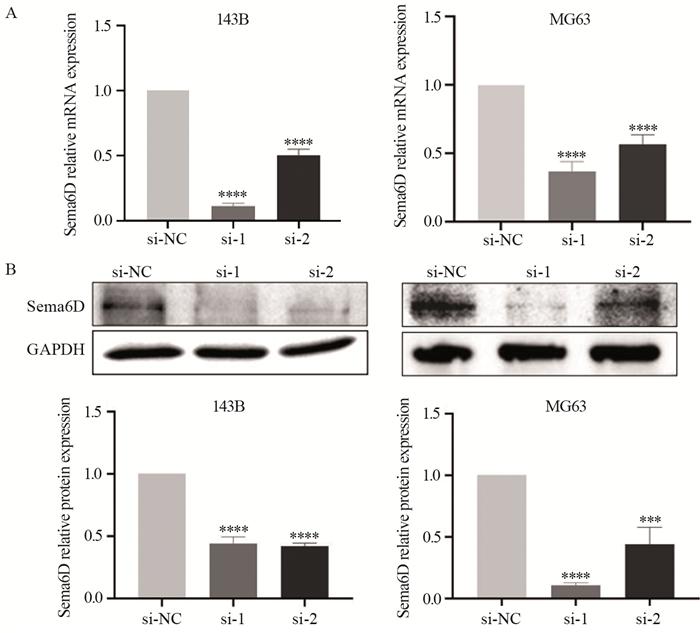
用CCK-8法分别检测si-NC、si-1和si-2三组细胞在0、24、48、72、96 h的OD值,并绘制生长曲线。结果显示转染si-1和si-2的143B细胞增殖能力明显低于si-NC组(96 h时均P < 0.001)。转染si-1和si-2的MG63细胞组的增殖能力与si-NC组差异有统计学意义(96 h时均P < 0.001),见图 3。
|
| ***: P < 0.001, compared with si-NC group. 图 3 敲低Sema6D对143B(A)和MG63(B)细胞增殖能力的影响 Figure 3 Effect of Sema6D knockdown on proliferation of 143B(A) and MG63(B) cells |
细胞划痕实验结果显示,划线24 h后,143B-si-NC组细胞划痕愈合比例(47±4)%大于143B-si-1组(17±5)%和143B-si-2(19±2)%(P < 0.01和P < 0.05)。MG63-si-NC、MG63-si-1、MG63-si-2三组细胞划痕愈合比例分别为(65±5)%、(34±5)%、(47±4)%,抑制Sema6D表达后MG63的迁移能力明显降低(均P < 0.001),见图 4。Transwell体外侵袭实验结果显示143-si-NC组细胞穿过小室被固定染色的细胞数目(382±52个)多于143B-si-1组(238±18个)和143B-si-2组(178±60个)(P < 0.05和P < 0.01)。同样,三组MG63细胞穿过小室被固定的细胞数分别为310±8个、157±34个、159±38个,敲低组细胞数明显减少(均P < 0.01),见图 5。上述结果表明,Sema6D敲低抑制143B、MG63骨肉瘤细胞的迁移和侵袭。
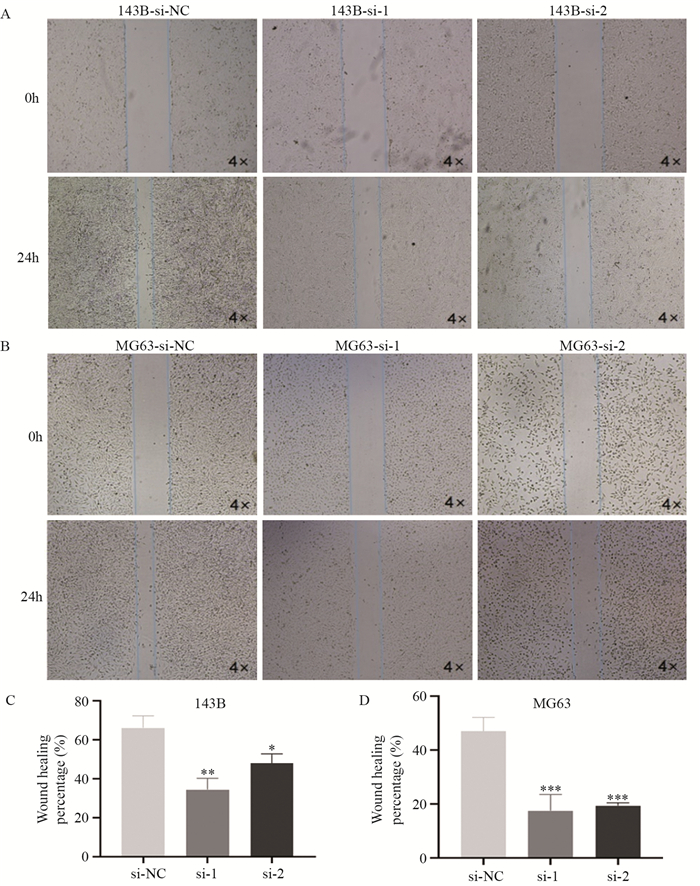
|
| *: P < 0.05, **: P < 0.01, ***: P < 0.001, compared with si-NC group. 图 4 敲低Sema6D对143B(A, C)和MG63(B, D)细胞迁移能力的影响 Figure 4 Effect of Sema6D knockdown on migration of 143B(A, C) and MG63(B, D) cells |
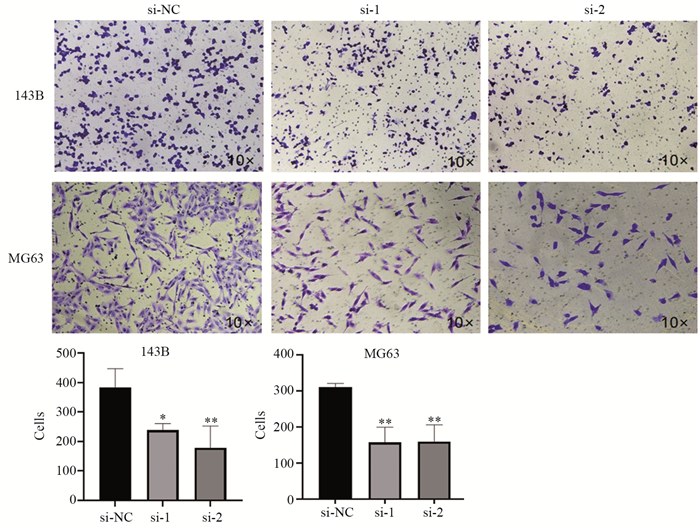
|
| *: P < 0.05, **: P < 0.01, compared with si-NC group. 图 5 敲低Sema6D对143B和MG63细胞侵袭能力的影响 Figure 5 Effect of Sema6D knockdown on invasion of 143B and MG63 cells |
ELISA结果显示143B-si-NC、143B-si-1、143B-si-2三组细胞上清液中Sema6D的含量分别为24.21±0.75、8.16±2.67和0.84±0.41 pg/ml。与对照组相比,143B敲低组细胞培养上清液中Sema6D的含量明显下降(P < 0.0001和P < 0.001)。MG63-si-1组(15.76±0.1 pg/ml)和MG63-si-2组(19.12±0.11 pg/ml)细胞上清液中Sema6D的含量明显低于MG63-si-NC组(38.25±6.27 pg/ml)(均P < 0.01),见图 6A。将HUVECs铺在包被有Matrigel基质胶的96孔板中5 h后可以在镜下观察管样结构的形成,143B-si-NC组TCM处理后血管形成数目(52±7个)多于143B-si-1组(19±4个)和143B-si-2组(25±5个)(P < 0.001和P < 0.01)。三组MG63细胞TCM处理后成管数目分别为55±7个、33±4个和21±4个,与MG63-si-NC组相比,敲低组血管形成数目减少(P < 0.01和P < 0.001),见图 6B~C。上述结果表明骨肉瘤细胞来源的Sema6D可以促进HUVECs的体外血管形成能力。
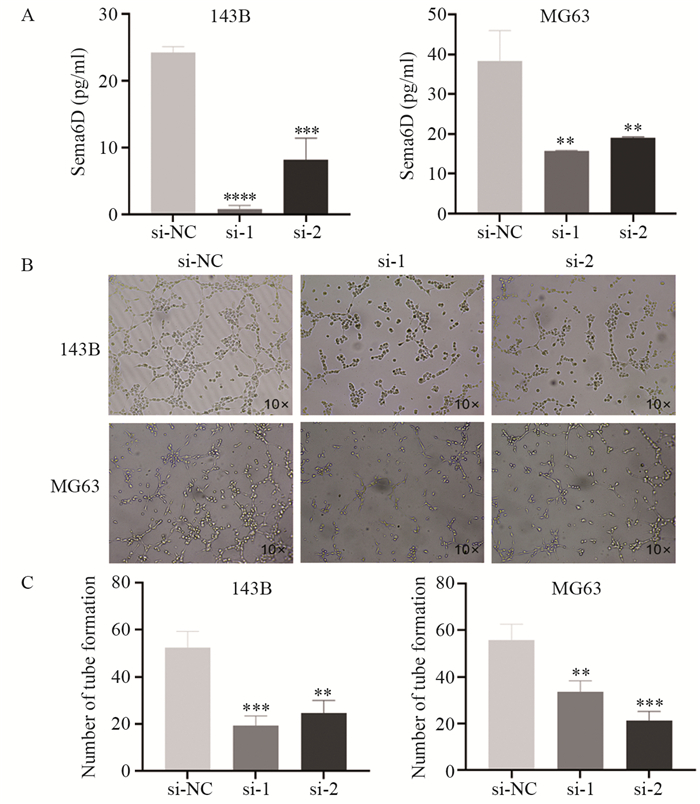
|
| **: P < 0.01, ***: P < 0.001, ****: P < 0.0001, compared with si-NC group. 图 6 敲低Sema6D对HUVECs体外血管形成能力的影响 Figure 6 Effect of Sema6D knockdown on tube formation ability of HUVECs |
与143B-si-NC组相比,143B-si-1和143B-si-2两组细胞p-PI3K、p-mTOR、mTOR和p-ERK四种蛋白表达水平下降,差异有统计学意义(均P < 0.05);p-AKT表达水平仅在143B-si-1组中下降(P < 0.01);ERK表达水平仅在143B-si-2组中下降(P < 0.01);而AKT表达水平在三组间差异无统计学意义(P > 0.05)。在MG63细胞中,敲低Sema6D后,p-AKT、p-mTOR、mTOR、p-ERK和ERK五种蛋白表达水平明显下降(均P < 0.05);p-PI3K表达水平仅在MG63-si-1组下调(P < 0.01);而AKT表达水平在三组间差异无统计学意义(P > 0.05),见图 7。
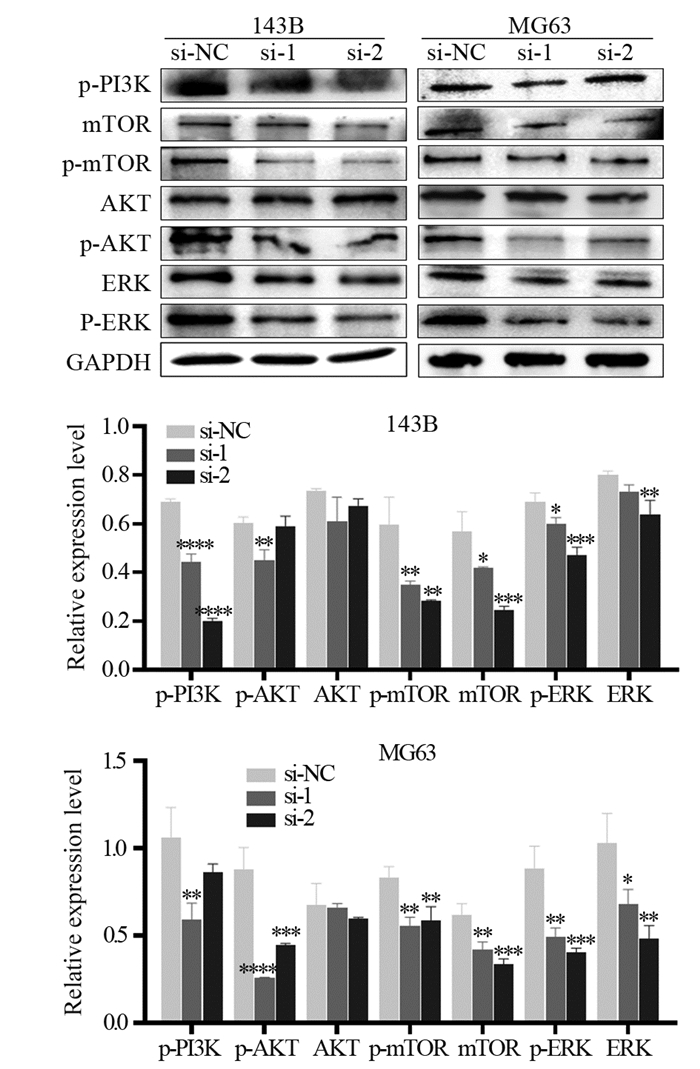
|
| *: P < 0.05, **: P < 0.01, ***: P < 0.001, ****: P < 0.0001, compared with si-NC group. 图 7 敲低Sema6D对143B和MG63细胞下游信号通路蛋白的影响 Figure 7 Effect of Sema6D knockdown on downstream signal pathway proteins of 143B and MG63 cells |
骨肉瘤好发于儿童及青少年血运丰富的干骺端[6]。骨肉瘤恶性程度高,局部呈侵袭性生长,肺转移发生率高,因此早期行肿瘤切除治疗是改善患者生存的最佳方法[1, 3, 7]。新辅助化疗的出现使骨肉瘤患者的5年总生存率明显升高,但耐药性的存在以及肺转移率的增加使骨肉瘤的治疗仍处于困境。近年来针对TP53、RB1、BRCA2、VEGF及MDM2等骨肉瘤癌基因异常相关的研究越来越多,但目前研究成果距离临床应用仍有一定距离[8-11]。
Sema家族成员分子结构相似,多为跨膜蛋白,在肿瘤发生、神经血管再生及免疫调节等多方面发挥作用[4, 12]。Sema4D、Sema7A、Sema3C等被证明在骨肉瘤、胃癌、非小细胞肺癌中能够调节微环境,介导肿瘤的发生发展[4, 13-15]。目前发现Ⅵ家族共有Sema6A~Sema6D四种类型,其中研究较多的是Sema6D[1, 16-17]。Neufeld等[4]提出Sema6D在恶性胸膜间皮瘤中诱导细胞转移,影响生存,且在三阴性乳腺癌发生发展中扮演重要作用[18]。除此之外,曲思璇、赵向阳等[19-20]通过免疫组织化学检测出Sema6D在胃癌组织中高表达并与其恶性程度相关。在血管生成方面,Lu等[5]指出Sema6D能够与PlexinA1直接结合从而激活VEGFR2介导的信号转导通路参与血管形成。Gong等[21]提出Sema6D在CircUBAP2调节下参与骨肉瘤顺铂耐药。在骨微环境中,Sema6D由破骨细胞分泌,可溶性Sema6D能够结合PlexinA1促进破骨细胞活动[22]。
骨肉瘤病因复杂,其发生涉及胞内多种信号转导通路的改变,其中PI3K/AKT/mTOR和ERK通路在其中扮演重要角色[23-24],多项研究表明二者可以通过调节多种效应分子如凋亡相关蛋白如Bax/Bcl-2、细胞周期依赖性蛋白激酶-2(CDK-2)、缺氧诱导因子-1α(HIF-1α)、血管内皮生长因子(VEGF)等参与骨肉瘤细胞增殖、凋亡、自噬及血管形成等生物学行为,通过阻断PI3K/AKT/mTOR和ERK信号级联反应可降低骨肉瘤细胞的恶性程度[25-27]。
本研究通过RT-PCR和Western blot方法证明Sema6D在人骨肉瘤组织以及细胞系中高表达,因此推测其可能作为促癌基因在骨肉瘤发生发展中发挥作用。之后通过RNA干扰技术降低骨肉瘤细胞系143B和MG63中Sema6D的表达,通过体外增殖及侵袭迁移实验发现,沉默Sema6D能够抑制骨肉瘤细胞增殖、迁移及侵袭能力。利用HUVECs与TCM共培养的方法证明骨肉瘤细胞系来源的Sema6D可以促进HUVECs体外血管形成。通过Western blot检测下游相关信号通路的表达情况,发现PI3K/AKT/mTOR及ERK可能是Sema6D发挥上述作用的重要信号转导通路。
综上所述,Sema6D在骨肉瘤中扮演促癌基因的作用,通过PI3K/AKT/mTOR和ERK通路调控骨肉瘤恶性生物学行为,但其具体机制仍需进一步研究。在不断完善现有研究成果的基础上积极探索新的靶向基因以制备特异性靶向药物,从而更好地为骨肉瘤临床疗效服务,这是目前骨肉瘤研究的目标和重点之一。
作者贡献:
刘艺欣:研究设计、细胞实验和论文撰写
徐添姿、宁彪:细胞实验和数据分析
雷军、魏永长:实验指导和论文审校
| [1] |
Ritter J, Bielack SS. Osteosarcoma[J]. Ann Oncol, 2010, 21 Suppl 7: vii320-vii325. |
| [2] |
Bhattasali O, Vo AT, Roth M, et al. Variability in the reported management of pulmonary metastases in osteosarcoma[J]. Cancer Med, 2015, 4(4): 523-531. DOI:10.1002/cam4.407 |
| [3] |
Meazza C, Scanagatta P. Metastatic osteosarcoma: a challenging multidisciplinary treatment[J]. Expert Rev Anticancer Ther, 2016, 16(5): 543-556. DOI:10.1586/14737140.2016.1168697 |
| [4] |
Neufeld G, Mumblat Y, Smolkin T, et al. The semaphorins and their receptors as modulators of tumor progression[J]. Drug Resist Update, 2016, 29: 1-12. DOI:10.1016/j.drup.2016.08.001 |
| [5] |
Lu YJ, Xu Q, Chen L, et al. Expression of semaphorin 6D and its receptor plexin-A1 in gastric cancer and their association with tumor angiogenesis[J]. Oncol Lett, 2016, 12(5): 3967-3974. DOI:10.3892/ol.2016.5208 |
| [6] |
Mirabello L, Troisi RJ, Savage SA. International osteosarcoma incidence patterns in children and adolescents, middle ages and elderly persons[J]. Int J Cancer, 2009, 125(1): 229-234. DOI:10.1002/ijc.24320 |
| [7] |
喻紫晨. 骨肉瘤肺转移手术后的生存预测因素分析[J]. 实用癌症杂志, 2016, 1(1): 73-75. [Yu ZC. Factors Predicting Survival of Osteosarcoma with Pulmonary Metastasis after Surgery[J]. Shi Yong Ai Zheng Za Zhi, 2016, 1: 73-75. DOI:10.3969/j.issn.1001-5930.2016.01.022] |
| [8] |
Wedekind MF, Wagner LM, Cripe TP. Immunotherapy for osteosarcoma: Where do we go from here?[J]. Pediatr Blood Cancer, 2018, 65(9): e27227. DOI:10.1002/pbc.27227 |
| [9] |
Harrison DJ, Geller DS, Gill JD, et al. Current and future therapeutic approaches for osteosarcoma[J]. Expert Rev Anticancer Ther, 2018, 18(1): 39-50. DOI:10.1080/14737140.2018.1413939 |
| [10] |
Harting MT, Blakely ML. Management of osteosarcoma pulmonary metastases[J]. Semin Pediatr Surg, 2006, 15(1): 25-29. DOI:10.1053/j.sempedsurg.2005.11.005 |
| [11] |
Rickel K, Fang F, Tao J. Molecular genetics of osteosarcoma[J]. Bone, 2017, 102: 69-79. DOI:10.1016/j.bone.2016.10.017 |
| [12] |
Neufeld G, Kessler O. The semaphorins: versatile regulators of tumour progression and tumour angiogenesis[J]. Nat Rev Cancer, 2008, 8(8): 632-645. DOI:10.1038/nrc2404 |
| [13] |
侯丽艳, 贾如江, 任利兵, 等. 干扰Sema4D基因表达对胰腺癌细胞生物学特征的影响[J]. 临床肝胆病杂志, 2018, 34(2): 350-353. [Hou YL, Jia RJ, Ren LB, et al. Effect of interference of Sema4D expression on cell biological characteristics in pancreatic cancer[J]. Lin Chuang Gan Dan Bing Za Zhi, 2018, 34(2): 350-353. DOI:10.3969/j.issn.1001-5256.2018.02.026] |
| [14] |
Sun ZZ, Yan KX, Liu S, et al. Semaphorin 3A promotes the osteogenic differentiation of rat bone marrow-derived mesenchymal stem cells in inflammatory environments by suppressing the Wnt/beta-catenin signaling pathway[J]. J Mol Histol, 2021, 52(6): 1245-1255. DOI:10.1007/s10735-020-09941-1 |
| [15] |
Kang SJ, Nakanishi Y, Kioi Y, et al. Semaphorin 6D reverse signaling controls macrophage lipid metabolism and anti-inflammatory polarization[J]. Nat Immunol, 2018, 19(6): 561-570. DOI:10.1038/s41590-018-0108-0 |
| [16] |
Zhao JX, Tang HT, Zhao H, et al. SEMA6A is a prognostic biomarker in glioblastoma[J]. Tumor Biol, 2015, 36(11): 8333-8340. DOI:10.1007/s13277-015-3584-y |
| [17] |
Ge CQ, Li QF, Wang LP, et al. The role of axon guidance factor semaphorin 6B in the invasion and metastasis of gastric cancer[J]. J Int Med Res, 2013, 41(2): 284-292. DOI:10.1177/0300060513476436 |
| [18] |
Chen DQ, Li YF, Wang LZ, et al. SEMA6D Expression and Patient Survival in Breast Invasive Carcinoma[J]. Int J Breast Cancer, 2015, 2015: 539721. |
| [19] |
曲思璇, 杨兆丽, 陶洪迪, 等. 脑信号蛋白6D(SEMA6D)与Snail蛋白在胃癌组织高表达且与恶性临床病理指标呈正相关[J]. 细胞与分子免疫学杂志, 2019, 35(10): 932-937. [Qu SX, Yang ZL, Tao HD, et al. Semaphorin 6D and Snail are highly expressed in gastric cancer andpositively correlated with malignant clinicopathological indexes[J]. Xi Bao Yu Fen Zi Mian Yi Xue Za Zhi, 2019, 35(10): 932-937.] |
| [20] |
赵向阳, 陈凛, 许倩, 等. Sema6D与受体PlexinA1在胃癌中的表达及其临床病理意义[J]. 中华实验外科杂志, 2008, 25(4): 416-419. [Zhao XY, Chen L, Xu Q, et al. The expression of Sema6D and Its receptor PlexinA1 in gastric carcinoma and their clinicopathologic significance[J]. Zhong Hua Shi Yan Wai Ke Za Zhi, 2008, 25(4): 416-419. DOI:10.3321/j.issn:1001-9030.2008.04.002] |
| [21] |
Gong XL, Li W, Dong L, et al. CircUBAP2 promotes SEMA6D expression to enhance the cisplatin resistance in osteosarcoma through sponging miR-506-3p by activating Wnt/beta-catenin signaling pathway(vol 56, pg 313, 2020)[J]. J Mol Histol, 2020, 51(4): 329-340. DOI:10.1007/s10735-020-09883-8 |
| [22] |
Verlinden L, Vanderschueren D, Verstuyf A. Semaphorin signaling in bone[J]. Mol Cell Endocrinol, 2016, 432: 66-74. DOI:10.1016/j.mce.2015.09.009 |
| [23] |
Liu F, Yang X, Geng M, et al. Targeting ERK, an Achilles' Heel of the MAPK pathway, in cancer therapy[J]. Acta Pharm Sin B, 2018, 8(4): 552-562. DOI:10.1016/j.apsb.2018.01.008 |
| [24] |
Li XD, Huang QS, Wang SL, et al. HER4 promotes the growth and metastasis of osteosarcoma via the PI3K/AKT pathway[J]. Acta Biochim Biophys Sin(Shanghai), 2020, 52(4): 345-362. |
| [25] |
Li W, Li Y, Tian W, et al. 2-methylbenzoyl berbamine, a multi-targeted inhibitor, suppresses the growth of human osteosarcoma through disabling NF-kappaB, ERK and AKT signaling networks[J]. Aging (Albany NY), 2020, 12(14): 15037-15049. |
| [26] |
Peng N, Gao S, Guo X, et al. Silencing of VEGF inhibits human osteosarcoma angiogenesis and promotes cell apoptosis via VEGF/PI3K/AKT signaling pathway[J]. Am J Transl Res, 2016, 8(2): 1005-1015. |
| [27] |
Niveditha D, Sharma H, Majumder S, et al. Transcriptomic analysis associated with reversal of cisplatin sensitivity in drug resistant osteosarcoma cells after a drug holiday[J]. BMC Cancer, 2019, 19(1): 1045. DOI:10.1186/s12885-019-6300-2 |
 2022, Vol. 49
2022, Vol. 49