文章信息
- HSP90抑制剂AUY-922逆转人神经母细胞瘤细胞ALK抑制剂耐药的机制
- Mechanism of HSP90 Inhibitor AUY-922 Reversing ALK Inhibitor Resistance in Human Neuroblastoma Cells
- 肿瘤防治研究, 2022, 49(4): 294-298
- Cancer Research on Prevention and Treatment, 2022, 49(4): 294-298
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2022.21.0949
- 收稿日期: 2021-08-24
- 修回日期: 2022-01-06
神经母细胞瘤是一种起源于交感神经系统的神经内分泌肿瘤,其中90%的肿瘤发生于10岁以下的儿童[1-2]。目前在神经母细胞瘤细胞中已经发现了多种基因改变,包括MYCN基因的扩增、间变性淋巴瘤激酶ALK基因的突变和染色体变化[3-7]。ALK基因的胚系突变和体系突变是罕见的家族性神经母细胞瘤和散发性高危神经母细胞瘤的主要驱动因素,其突变类型主要包括G1128A、R1192P、R1275Q、F1174L和F1245C等。这些突变导致了ALK激酶活性的结构性激活,致使ALK-RAS-MAPK/ALK-PI3K信号通路级联放大,这一特征是神经母细胞瘤复发的主要因素,致使患者的存活率显著降低[8-9]。针对ALK激酶的突变激活,ALK一代和二代抑制剂的成功研发实现了对神经母细胞瘤的精准治疗。与其他小分子酪氨酸激酶抑制剂一样,临床上在使用ALK抑制剂治疗神经母细胞瘤时出现治疗效果差,产生耐药性问题[10-12]。因此,克服这种耐药机制是当前提高由ALK基因突变驱动的神经母细胞瘤患者的生存质量和生存时间所亟需解决的关键问题。
热休克蛋白90(HSP90)是一种分子伴侣蛋白,帮助蛋白质进行正确的折叠和组装,防止蛋白质聚集和降解[13-14]。HSP90在多种癌症中均有高表达,增加了多种恶性表型,与不良预后密切相关[15-16]。HSP90抑制剂已在多种肿瘤中显示出抗肿瘤作用,并能克服多种激酶抑制剂耐药[17-20]。但HSP90抑制剂AUY922克服人神经母细胞瘤对ALK抑制剂耐药的研究未见报道。本研究以携有ALK F1174L突变的人神经母细胞瘤细胞为模型,探讨AUY-922逆转人神经母细胞瘤SH-SY5Y和KELLY细胞对二代ALK抑制剂TAE684耐药的作用,为临床应用提供理论依据。
1 材料与方法 1.1 试剂与仪器TAE684(批号S1108,纯度99.64%)、AUY-922(批号S1069,纯度99.08%)均购自上海蓝木化工有限公司。四甲基偶氮唑蓝(MTT)(批号M2128,纯度98%)和二甲基亚砜(DMSO)(批号D2650,纯度99.7%)均购自德国默克Sigma公司。人神经母细胞瘤细胞株SH-SY5Y(美国ATCC细胞库)及KELLY(德国DSMZ细胞库);胎牛血清(美国Gibco公司)、RPMI1640培养基(批号10-040-CVR,美国Corning公司);碘化丙啶(批号ST511)、RNase A(批号ST576)、BCA蛋白定量测定试剂盒(批号P0010S)、RIPA裂解液(批号P0013B)均购自中国碧云天生物技术有限公司;蛋白酶抑制剂混合片剂(批号04693132001,瑞士Roche公司);抗兔ALK抗体(批号3633)、抗兔p-Cdc2抗体(批号4539)、抗鼠CDC2抗体(批号9116)、抗兔p-Akt抗体(批号4060)、抗兔Akt抗体(批号4685)、抗兔p-Erk1/2抗体(批号4370)、抗兔Erk1/2抗体(批号4695)、抗兔p-Stat3抗体(批号9145)、抗鼠Stat3抗体(批号9139)、抗兔GAPDH抗体(批号5174)均购自美国Cell Signal Technology公司;兔二抗(批号111-035-003)、鼠二抗(批号115-035-003)均购自美国Jackson公司;ECL plus试剂(Picece,美国Thermofisher Scientific公司)。可调波长式微孔板酶标仪(Spectra-MAX190,美国Molecular Devices公司);流式细胞仪(FACSCalibur,美国BD公司);凝胶成像系统(ChemiDoc imaging system,美国Bio-Rad公司)。
1.2 化合物溶液的配制TAE684和AUY-922均以二甲基亚砜为溶剂,溶解至10 mmol/L,在-20℃下保存。临用前,再稀释至所需浓度。
1.3 细胞培养SH-SY5Y和KELLY细胞株在含100 μg/ml链霉素、100 u/ml青霉素、10%胎牛血清的RPMI1640培养基、37℃、5%CO2条件下培养。
1.4 MTT法检测AUY-922对SH-SY5Y和KELLY细胞增殖的影响将SH-SY5Y和KELLY细胞分别按照1.5×103和6×103个/孔接种于96孔板内,过夜贴壁后分别给予化合物TAE684(0.001、0.01、0.1、1、5和10 μmol/L)和AUY-922(0.001、0.01、0.1、1、5和10 μmol/L)作用72 h,并设阴性对照(control组),每组3个复孔。每孔加入MTT 20 μl孵育4 h,于酶标仪波长490 nm处测吸光度值。计算各浓度药物的抑制率(inhibition rate, IR),IR= [(OD对照组-OD化合物组)/OD对照组]×100%。采用四参数法拟合浓度-反应曲线,计算IC50值。实验独立重复3次。
1.5 流式细胞仪检测AUY-922对SH-SY5Y和KELLY细胞周期的影响将处于对数生长期的SH-SY5Y和KELLY细胞按1×105个/孔接种于12孔板中,贴壁生长过夜后,在SH-SY5Y细胞中分别加入0.125、0.25、0.5 μmol/L的AUY-922,在KELLY细胞中分别加入0.05、0.1、0.2 μmol/L的AUY-922。作用24 h后,胰酶消化并收集细胞,4℃固定过夜;用含有RNase A(10 μg/ml)和PI(20 μg/ml)的PBS重悬,37℃孵育15 min,200目筛网过滤,流式细胞仪检测细胞中DNA含量,每组样品分析1×105个细胞。实验结果用软件Flowjo7.6进行分析。
1.6 Western blot法检测AUY-922对Cdc2和ALK蛋白的表达及信号通路的影响将处于对数生长期的SH-SY5Y和KELLY细胞接种于6孔板,贴壁生长过夜后,在SH-SY5Y细胞中分别加入0.125、0.25、0.5 μmol/L的AUY-922,在KELLY细胞中分别加入0.05、0.1、0.2 μmol/L的AUY-922。作用24 h后,每孔细胞加入100 μl的RIPA裂解液,冰上裂解30 min,离心,收集上清液。BCA法定量,计算样品蛋白浓度,置于-20℃冰箱保存备用。取50 μg蛋白上清液进行SDS-PAGE电泳,半干转膜,于3%脱脂奶粉中室温封闭1 h。然后分别孵育一抗溶液ALK(1:1 000)、p-Cdc2(1:1 000)、Cdc2(1:1 000)、p-Akt(1:1 000)、Akt(1:1 000)、p-Erk(1:1 000)、Erk(1:1 000)及GAPDH(1:5 000),于4℃过夜后,洗膜3次,再与相应二抗溶液鼠二抗(1:3 000)和兔二抗(1:3 000)室温孵育1 h。同上洗膜3次后,用ECL plus试剂发色液显色,化学发光信号用凝胶成像系统ChemiDoc Imaging System检测。
1.7 统计学方法GraphPad Prism软件进行t检验分析,数据均以(x±s)表示,P < 0.05为差异有统计学意义。
2 结果 2.1 AUY-922逆转SH-SY5Y和KELLY细胞耐药细胞增殖实验结果显示,SH-SY5Y和KELLY细胞对ALK抑制剂TAE684显示出了不同程度的耐药,其IC50分别约为1.50和0.50 μmol/L(P < 0.05);而SH-SY5Y和KELLY细胞均对HSP90抑制剂AUY-922显示出高度敏感度,IC50分别约为0.30和0.12 μmol/L(P < 0.05),见图 1。
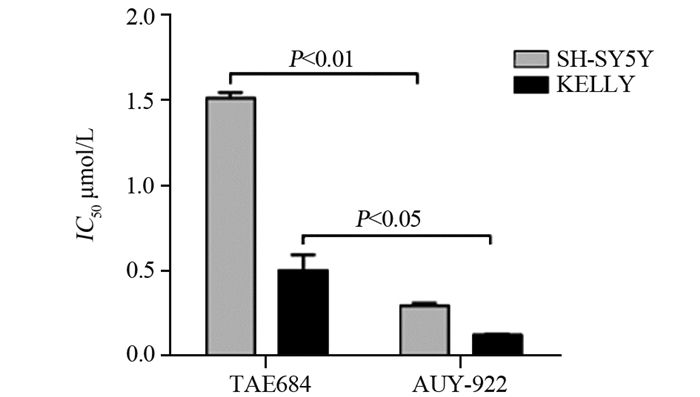
|
| 图 1 SH-SY5Y细胞和KELLY细胞对TAE684和AUY-922的IC50值 Figure 1 IC50 values of SH-SY5Y cells and KELLY cells to TAE684 and AUY-922 |
流式细胞仪检测结果显示,AUY-922剂量依赖性地引起SH-SY5Y和KELLY细胞发生G2/M期周期阻滞,见图 2。
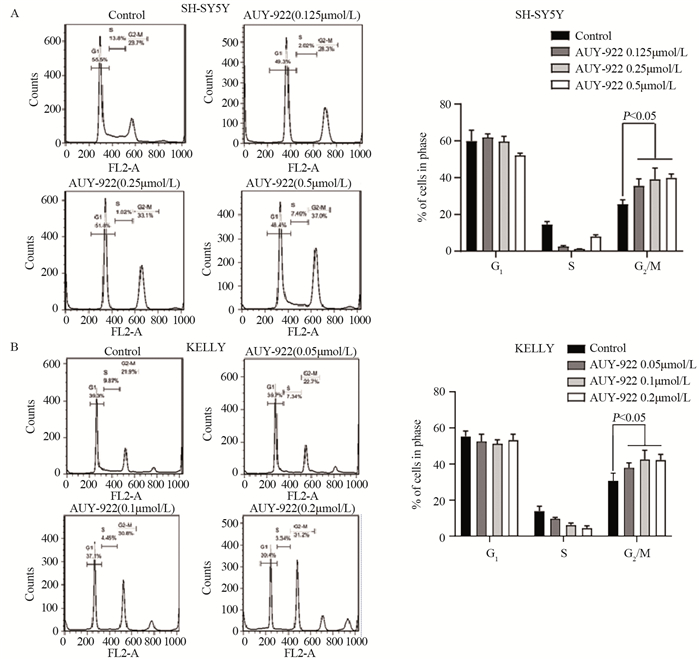
|
| 图 2 AUY-922对SH-SY5Y细胞(A)和KELLY细胞(B)的细胞周期影响 Figure 2 Effect of AUY-922 on cell cycle of SH-SY5Y (A) and KELLY(B) cells |
Western blot结果显示,AUY-922能剂量依赖性地降低G2/M期关键调控蛋白Cdc2的表达,伴随Cdc2蛋白的磷酸化水平的降低,见图 3。
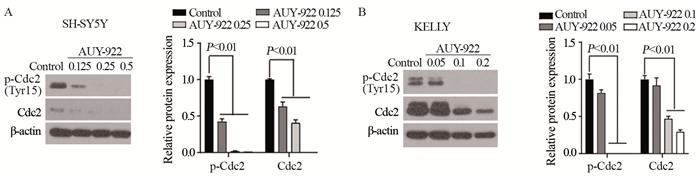
|
| 图 3 AUY-922对SH-SY5Y细胞(A)和KELLY细胞(B)中Cdc2蛋白表达的影响 Figure 3 Effect of AUY-922 on expression of Cdc2 protein in SH-SY5Y(A) and KELLY(B) cells |
Western blot结果显示,AUY-922能剂量依赖性地降低驱动基因ALK蛋白的表达,同时剂量依赖性地抑制了ALK激酶下游p-Akt、p-Erk及p-Stat3信号通路,见图 4。
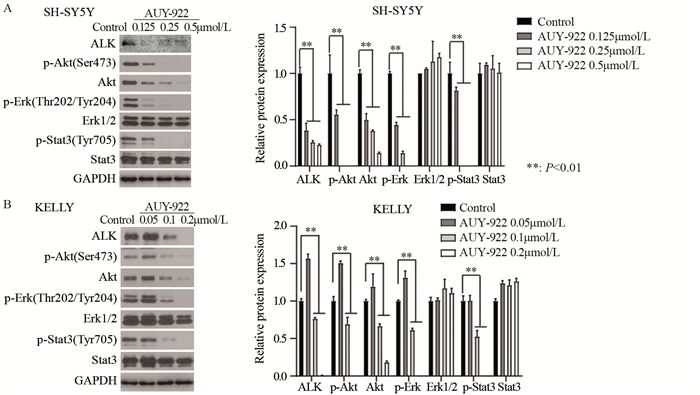
|
| 图 4 AUY-922对SH-SY5Y细胞(A)和KELLY细胞(B)中ALK蛋白表达及下游信号通路的影响 Figure 4 Effect of AUY-922 on expression of ALK protein and downstream signal pathways in SH-SY5Y(A) and KELLY(B) cells |
神经母细胞瘤是最常见的颅外儿童恶性肿瘤。特定分子改变如MYCN和ALK的异常表达是神经母细胞瘤的致癌因素。ALK癌基因的酪氨酸激酶区域的激活突变是遗传性神经母细胞瘤的最常见原因,为神经母细胞瘤的治疗提供了关键的分子靶点。但临床试验运用ALK抑制剂克唑替尼治疗携有ALK基因激活突变的神经母细胞瘤时,患者响应率低(< 1/10)[21]。由此可见,大多数患者对ALK抑制剂克唑替尼产生了耐药,其耐药机制可能是克唑替尼不能有效抑制突变的ALK激酶活性。本研究发现二代ALK抑制剂TAE684亦不能有效抑制SH-SY5Y和KELLY细胞的增殖,这与临床报道一致。因此,抑制ALK激酶的活性或者降低ALK蛋白的表达是体内外克服神经母细胞瘤增殖的关键手段。
HSP90是一种帮助蛋白质折叠达到稳定的分子伴侣,在多种癌症中均有上调表达,与不良预后以及对化疗、放射治疗及分子靶向治疗的耐药密切相关[22-25]。本研究发现AUY-922能降低SH-SY5Y和KELLY细胞中ALK蛋白的表达,说明ALK F1174L亦是HSP90的客户蛋白。AUY-922一方面从上游降解ALK F1174L客户蛋白,另一方面促使下游Akt客户蛋白发生降解,达到双重抑制下游信号通路的作用。Cdc2是调控细胞周期G2/M期的关键蛋白[26-28],AUY-922剂量依赖性地导致Cdc2发生降解,进而诱发SH-SY5Y和KELLY细胞发生G2/M期周期阻滞,导致细胞增殖受阻,达到抑制耐药细胞增殖的作用。因此,AUY-922逆转ALK抑制剂耐药的作用机制可能与其降解ALK F1174L蛋白,削弱控制耐药细胞生存及增殖的下游信号转导相关。此外,AUY-922还通过降解细胞周期关键蛋白Cdc2,进一步抑制耐药细胞的增殖,达到双重克服耐药作用。
综上所述,本研究进一步证明了ALK F1174L是人神经母细胞瘤SH-SY5Y和KELLY细胞发生的驱动蛋白,同时二代ALK抑制剂TAE684不能抑制ALK F1174L蛋白活性,从而产生耐药。AUY-922一方面通过降解神经母细胞瘤依赖的ALK蛋白和调控肿瘤细胞存活的AKT蛋白,导致多种致癌信号转导通路如Akt、Erk及Stat3被阻断,从而抑制肿瘤耐药细胞的增殖;另一方面AUY-922通过降解细胞周期调节因子Cdc2蛋白,引起SH-SY5Y和KELLY细胞发生G2/M期阻滞,进一步达到抑制肿瘤耐药细胞增殖的作用。以上结果表明,携有ALK F1174L突变的人神经母细胞瘤细胞对二代ALK抑制剂TAE684产生耐药性,而HSP90抑制剂AUY-922通过降解多种客户蛋白,直接或间接抑制多条信号转导通路,有效地克服了人神经母细胞瘤细胞对二代ALK抑制剂的耐药性。本研究为临床应用HSP90抑制剂克服人神经母细胞瘤对ALK抑制剂的耐药提供了理论依据。
作者贡献:
王月琴:实验设计及操作、数据分析、文章撰写及基金支持
冯璐瑶:实验操作及校对文章
田鑫:写作指导及基金支持
| [1] |
Matthay KK, Maris JM, Schleiermacher G, et al. Neuroblastoma[J]. Nat Rev Dis Primers, 2016, 2: 16078. DOI:10.1038/nrdp.2016.78 |
| [2] |
Cañete A. High-risk neuroblastoma: where do we go?[J]. Ann Oncol, 2020, 31(3): 326-327. DOI:10.1016/j.annonc.2019.12.003 |
| [3] |
Brady SW, Liu Y, Ma X, et al. Pan-neuroblastoma analysis reveals age- and signature-associated driver alterations[J]. Nat Commun, 2020, 11(1): 5183. DOI:10.1038/s41467-020-18987-4 |
| [4] |
Schwab M, Westermann F, Hero B, et al. Neuroblastoma: biology and molecular and chromosomal pathology[J]. Lancet Oncol, 2003, 4(8): 472-480. DOI:10.1016/S1470-2045(03)01166-5 |
| [5] |
Mossé YP, Laudenslager M, Longo L, et al. Identification of ALK as a major familial neuroblastoma predisposition gene[J]. Nature, 2008, 455(7215): 930-935. DOI:10.1038/nature07261 |
| [6] |
Schleiermacher G, Javanmardi N, Bernard V, et al. Emergence of new ALK mutations at relapse of neuroblastoma[J]. J Clin Oncol, 2014, 32(25): 2727-2734. DOI:10.1200/JCO.2013.54.0674 |
| [7] |
Rajbhandari P, Lopez G, Capdevila C, et al. Cross-cohort analysis identifies a TEAD4-MYCN positive feedback loop as the core regulatory element of high-risk neuroblastoma[J]. Cancer Discov, 2018, 8(5): 582-599. DOI:10.1158/2159-8290.CD-16-0861 |
| [8] |
Janoueix-Lerosey I, Lequin D, Brugières L, et al. Somatic and germline activating mutations of the ALK kinase receptor in neuroblastoma[J]. Nature, 2008, 455(7215): 967-970. DOI:10.1038/nature07398 |
| [9] |
Zhang L, Wu B, Baruchel S. Oral metronomic topotecan sensitizes crizotinib antitumor activity in ALK F1174L drug-resistant neuroblastoma preclinical models[J]. Transl Oncol, 2017, 10(4): 604-611. DOI:10.1016/j.tranon.2017.04.008 |
| [10] |
Shen J, Najafi S, Stäble S, et al. A kinome-wide RNAi screen identifies ALK as a target to sensitize neuroblastoma cells for HDAC8-inhibitor treatment[J]. Cell Death Differ, 2018, 25(12): 2053-2070. DOI:10.1038/s41418-018-0080-0 |
| [11] |
Trigg RM, Lee LC, Prokoph N, et al. The targetable kinase PIM1 drives ALK inhibitor resistance in high-risk neuroblastoma independent of MYCN status[J]. Nat Commun, 2019, 10(1): 5428. DOI:10.1038/s41467-019-13315-x |
| [12] |
Bresler SC, Weiser DA, Huwe PJ, et al. ALK mutations confer differential oncogenic activation and sensitivity to ALK inhibition therapy in neuroblastoma[J]. Cancer Cell, 2014, 26(5): 682-694. DOI:10.1016/j.ccell.2014.09.019 |
| [13] |
Taipale M, Krykbaeva I, Koeva M, et al. Quantitative analysis of HSP90-client interactions reveals principles of substrate recognition[J]. Cell, 2012, 150(5): 987-1001. DOI:10.1016/j.cell.2012.06.047 |
| [14] |
Lachowiec J, Lemus T, Borenstein E, et al. Hsp90 promotes kinase evolution[J]. Mol Biol Evol, 2015, 32(1): 91-99. DOI:10.1093/molbev/msu270 |
| [15] |
Trepel J, Mollapour M, Giaccone G, et al. Targeting the dynamic HSP90 complex in cancer[J]. Nat Rev Cancer, 2010, 10(8): 537-549. DOI:10.1038/nrc2887 |
| [16] |
Whitesell L, Lindquist SL. HSP90 and the chaperoning of cancer[J]. Nat Rev Cancer, 2005, 5(10): 761-772. DOI:10.1038/nrc1716 |
| [17] |
Felip E, Barlesi F, Besse B, et al. Phase 2 Study of the HSP-90 inhibitor AUY922 in previously treated and molecularly defined patients with advanced non-small cell lung cancer[J]. J Thorac Oncol, 2018, 13(4): 576-584. DOI:10.1016/j.jtho.2017.11.131 |
| [18] |
Johnson ML, Yu HA, Hart EM, et al. PhaseⅠ/ⅡStudy of HSP90 inhibitor AUY922 and erlotinib for EGFR-mutant lung cancer with acquired resistance to epidermal growth factor receptor tyrosine kinase inhibitors[J]. J Clin Oncol, 2015, 33(15): 1666-1673. DOI:10.1200/JCO.2014.59.7328 |
| [19] |
Wang YQ, Shen AJ, Sun JY, et al. Targeting Hsp90 with FS-108 circumvents gefitinib resistance in EGFR mutant non-small cell lung cancer cells[J]. Acta Pharmacol Sin, 2016, 37(12): 1587-1596. DOI:10.1038/aps.2016.85 |
| [20] |
Sang J, Acquaviva J, Friedland JC, et al. Targeted inhibition of the molecular chaperone Hsp90 overcomes ALK inhibitor resistance in non-small cell lung cancer[J]. Cancer Discov, 2013, 3(4): 430-443. DOI:10.1158/2159-8290.CD-12-0440 |
| [21] |
Mossé YP, Lim MS, Voss SD, et al. Safety and activity of crizotinib for paediatric patients with refractory solid tumours or anaplastic large-cell lymphoma: a Children's Oncology Group phase 1 consortium study[J]. Lancet Oncol, 2013, 14(6): 472-480. DOI:10.1016/S1470-2045(13)70095-0 |
| [22] |
Garcia-Carbonero R, Carnero A, Paz-Ares L. Inhibition of HSP90 molecular chaperones: moving into the clinic[J]. Lancet Oncol, 2013, 14(9): e358-e369. DOI:10.1016/S1470-2045(13)70169-4 |
| [23] |
Zhao R, Davey M, Hsu YC, et al. Navigating the chaperone network: An integrative map of physical and genetic interactions mediated by the Hsp90 chaperone[J]. Cell, 2005, 120(5): 715-727. DOI:10.1016/j.cell.2004.12.024 |
| [24] |
Jacobson C, Kopp N, Layer JV, et al. HSP90 inhibition overcomes ibrutinib resistance in mantle cell lymphoma[J]. Blood, 2016, 128(21): 2517-2526. DOI:10.1182/blood-2016-04-711176 |
| [25] |
Bhatia S, Diedrich D, Frieg B, et al. Targeting HSP90 dimerization via the C terminus is effective in imatinib-resistant CML and lacks the heat shock response[J]. Blood, 2018, 132(3): 307-320. DOI:10.1182/blood-2017-10-810986 |
| [26] |
Asghar U, Witkiewicz AK, Turner NC, et al. The history and future of targeting cyclin-dependent kinases in cancer therapy[J]. Nat Rev Drug Discov, 2015, 14(2): 130-146. |
| [27] |
Shapiro GI. Cyclin-dependent kinase pathways as targets for cancer treatment[J]. J Clin Oncol, 2006, 24(11): 1770-1783. DOI:10.1200/JCO.2005.03.7689 |
| [28] |
Fang F, Newport JW. Evidence that the G1-S and G2-M transitions are controlled by different cdc2 proteins in higher eukaryotes[J]. Cell, 1991, 66(4): 731-742. DOI:10.1016/0092-8674(91)90117-H |
 2022, Vol. 49
2022, Vol. 49


