文章信息
- 血小板及其参数联合肿瘤标志物术前鉴别肝细胞癌及肝内胆管癌的临床价值
- Clinical Value of Platelet and Its Parameters Combined with Tumor Markers in Preoperative Differentiation of Hepatocellular Carcinoma and Intrahepatic Cholangiocarcinoma
- 肿瘤防治研究, 2022, 49(3): 213-218
- Cancer Research on Prevention and Treatment, 2022, 49(3): 213-218
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2022.21.0898
- 收稿日期: 2021-08-12
- 修回日期: 2021-11-22
2. 730030 兰州,兰州大学第二医院妇产科
2. Department of Obstetrics, The Second Hospital of Lanzhou University, Lanzhou 730030, China
原发性肝癌分为肝细胞性肝癌(hepatocellular carcinoma, HCC)、肝内胆管癌(intrahepatic cholangiocarcinoma, ICC)及混合性肝癌[1]。HCC和ICC是其中最常见的两种,分别约占70%和15%[2]。大部分患者早期无明显症状,通常通过用于其他目的的放射学检查时发现[3-4]。目前早期手术切除是最为有效的治疗方法。由于HCC、ICC的生物学行为和发病机制不同,其手术方式等也有所不同[5]。原发性肝癌诊疗规范中指出,HCC手术切除范围需距肿瘤边缘1 cm以上,即使切除少于1 cm,也要保证切缘阴性[4]。而与HCC不同,ICC侵袭性强,且目前尚无对ICC有效的化疗方法[6],通常需要扩大性肝切除术,包括切除肿瘤侵犯的血管、胆管和邻近组织[7]。
目前临床上HCC和ICC鉴别诊断的四种常用肿瘤标志物(AFP、CA199、CA125、CEA)的敏感度和特异性不足[8-10]。由于不推荐穿刺活检,同时限于早期肝癌的影像学特征不够典型,目前术前对HCC和ICC的鉴别诊断方法较少,依然是肝脏外科面临的难题之一。关于PLT及其参数的研究证明其在多种恶性肿瘤的发生、发展以及诊断中有着重要的参考价值。因此,本研究基于PLT及其参数联合肿瘤标志物(AFP、CA199、CA125、CEA)等血清学检验结果,探讨它们对术前鉴别HCC及ICC的临床价值。
1 资料与方法 1.1 研究对象收集2013—2021年在兰州大学第二医院行肝癌手术的患者共350例,纳入标准:(1)行手术治疗;(2)术后病检确诊为HCC或ICC者;(3)未转移或未合并其他系统肿瘤;(4)患者资料齐全。排除标准:(1)未行手术治疗;(2)术后病检排除HCC或ICC者;(3)转移或合并其他系统肿瘤;(4)治疗前有影响血PLT及其参数的疾病(如自身免疫性血小板减少症、白血病等免疫及血液系统疾病);(5)患者资料不齐全的患者。最终纳入274例,其中HCC组229例,ICC组45例。
1.2 数据收集所有患者资料从本院信息科获得,包括一般资料、PLT及其参数、肿瘤标志物(AFP、CA199、CA125、CEA)。收集数据仅用于科学研究,并经过医院伦理委员会批准(2021A-430)。
1.3 临床诊断标准根据原发性肝癌诊疗规范(2019年版)和指南以及相关文献[4, 11],将所有纳入患者分为术前明确诊断组和术前未明确诊断组。
HCC诊断标准:(1)有乙肝或丙肝或任何原因引起的肝硬化者,肿瘤直径≤2 cm,动态增强MRI、动态增强CT、超声造影或HCC特异性对比剂Gd-EOB-DTPA增强MRI四项检查中至少有两项显示肝脏占位具有HCC的典型特征(肝脏占位在动脉期明显强化、门静脉期或平衡期内快速洗脱即“快进快出”)。肿瘤直径 > 2 cm,则上述四种影像学检查中只需一项显示肝脏占位具有HCC的典型特征;(2)影像学提示肝脏占位,AFP(+)且AFP水平持续升高并排除妊娠、慢性或活动性肝病、生殖腺胚胎源性肿瘤以及消化道肿瘤;(3)术前穿刺活检提示HCC。
ICC诊断标准:可疑肝脏占位,增强CT或正电子发射计算机断层显像或普美显增强MRI或术前穿刺活检提示ICC。
1.4 统计学方法所有数据均采用SPSS 23.0统计软件进行分析,正态分布计量资料以(x±s)表示,组间比较采用t检验;非正态分布计量资料以中位数及四分位间距[M(QL, QU)]表示,组间比较采用Wilcoxon秩和检验。计数资料以率(%)表示,组间比较采用χ2检验。Logistic回归计算联合方案预测概率,绘制ROC曲线并计算AUC值评价有显著差异的指标单独及其联合检测对HCC和ICC的诊断效能。ROC曲线对最佳方案在术前明确诊断组与非明确诊断组中进行验证,结果以AUC表示。P < 0.05为差异有统计学意义。
2 结果 2.1 两组患者一般资料比较HCC组患者共229例,ICC组患者共45例,年龄组、胆道疾病病史、血管侵犯、乙肝病史、伴随症状及病理分级在两组间差异均具有统计学意义(均P < 0.05),其余差异无统计学意义(均P > 0.05),见表 1。
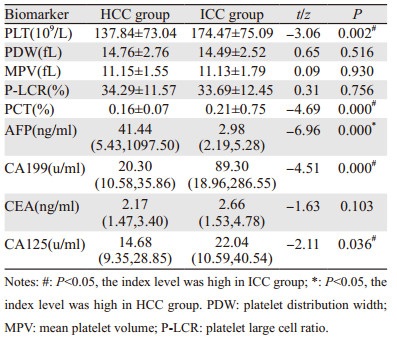
与ICC组比较,HCC组AFP水平较高,PLT、PCT、CA199、CA125水平较低,差异均有统计学意义(均P < 0.05),见表 2。
|
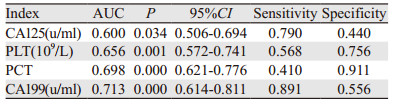
ROC曲线对ICC的诊断结果显示:CA125、CA199对ICC诊断的特异性较低,分别为44%、55.6%;PLT、PCT敏感度较低,分别为41%、56.8%,见表 3。
|
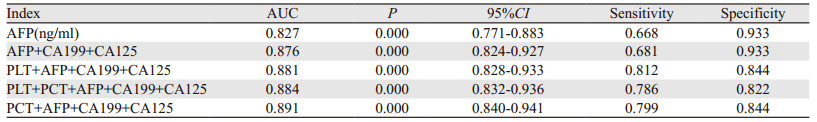
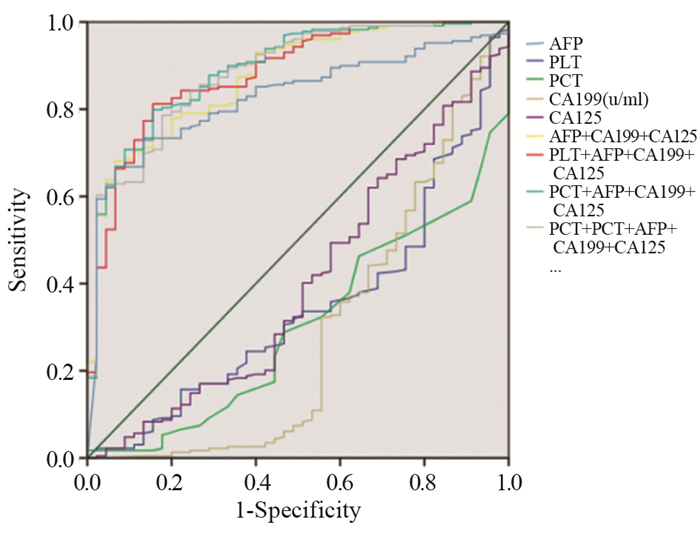
ROC曲线对HCC的诊断分析结果显示:PLT、PCT以及AFP、CA199、CA125单独检测时,AFP的AUC(0.827)最大,而PLT、PCT、CA199、CA125的AUC < 0.5。联合检测时,与PLT、PCT的联合均大于AFP、CA199、CA125单独诊断的AUC;其中,PCT+AFP+CA199+CA125的AUC(0.891)最高。与联合方案相比,AFP单独检测的敏感度(66.8%)最低,见表 4、图 1。
|
|
| 图 1 PLT、PCT、AFP、CA199、CA125单独及不同联合诊断肝细胞癌(HCC)的ROC曲线 Figure 1 ROC curves of HCC diagnosed by PLT, PCT, CA199, CA125 and AFP in single and different combination |
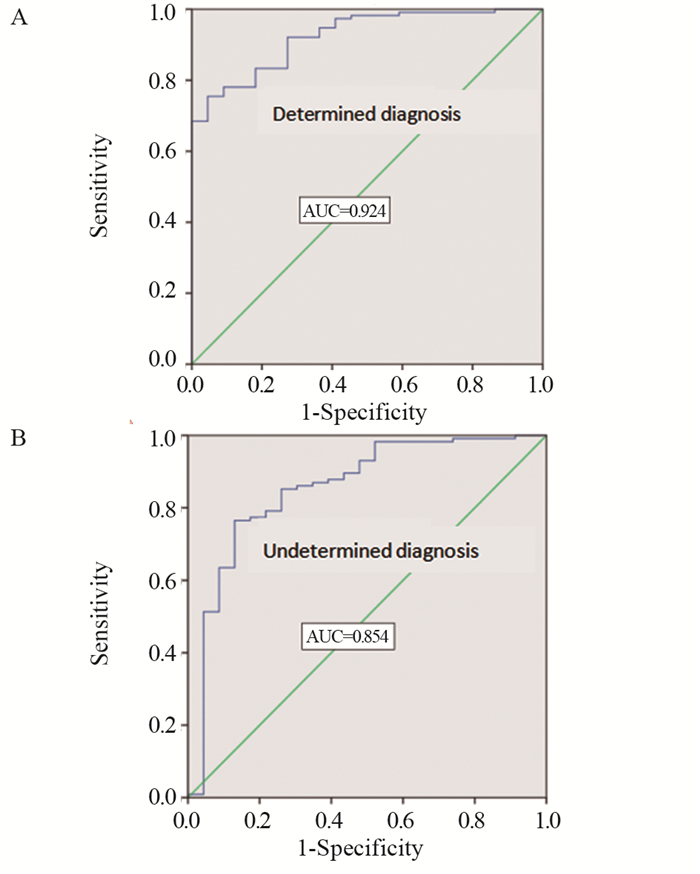
本研究将入组的274例患者根据临床诊断标准分为术前明确诊断组136例(其中HCC组114例,ICC组22例)和术前非明确诊断组138例(其中HCC组115例,ICC组23例)。将PCT+AFP+CA199+CA125在两个组中分别进行验证。在术前明确诊断组中验证的AUC为0.924;在术前非明确诊断组中验证的AUC为0.854,见图 2。
|
| 图 2 在术前明确与非明确诊断组中验证PCT+AFP+ CA199+CA125的ROC曲线 Figure 2 ROC curves of PCT+AFP+CA199+CA125 validated in the preoperative determined and undetermined diagnosis groups |
HCC和ICC是原发性肝癌的两种常见类型,其发病率逐年升高,两者生物学行为以及发病机制均不相同。本研究结果显示ICC组患者发生胆道疾病及血管侵犯的概率高于HCC,而既往乙肝的发病率以及伴有肝硬化和脾大等症状的概率低于HCC,差异有统计学意义(P < 0.05)。与现有研究[7, 12-13]一致,提示HCC多由乙肝、肝硬化发展而来,而ICC多由胆道系统疾病发展而来,并且具有更强的血管侵袭性。本研究显示HCC与ICC患者的发病平均年龄在50岁以上,ICC患者发病年龄显著高于HCC患者,提示中老年人是HCC、ICC的高发人群,且ICC发病年龄更大,与安等研究[14]一致。
由于HCC和ICC的生物学行为以及发病机制的不同,两者的治疗方案存在差异,术前进行鉴别诊断至关重要。研究发现PLT参与了肿瘤的发生、发展、侵袭以及转移等过程[15-17]。Best等研究证明,PLT的基因谱受肿瘤影响可发生改变,这种改变使其有潜力成为肿瘤诊断的生物标志物[18-19]。血小板参数作为PLT超微结构、酶活性和功能状态相关的活性标志物,较PLT而言,更有助于诊断恶性肿瘤[20]。提示PLT及其参数可用于肿瘤的诊断。本研究显示,HCC和ICC患者PLT及其参数PCT具有显著的统计学差异,证明了这一点。与HCC组比较,本研究ICC组PLT、PCT水平更高,差异有统计学意义(P < 0.05)。众所周知,ICC较HCC侵袭性高,易发生转移[7]。结合本研究结果,ICC组的PLT及PCT水平升高可能与PLT参与了ICC的生长及侵袭有关。研究[21-23]显示,肿瘤细胞分泌的组织因子等多种生物活性物质可导致PLT活化,活化后的PLT可分泌血管内皮生长因子等,促进肿瘤生长,间接促进肿瘤转移;同时PLT也可通过直接作用于肿瘤细胞或分泌转化生长因子β而直接促进肿瘤的生长和转移。结合于肿瘤细胞的PLT还可对肿瘤细胞起到保护作用,促使肿瘤细胞免疫逃逸[24]。其在恶性肿瘤发生发展中的机制目前仍未完全明确,仍有待进一步研究。
与既往研究一致[8-10],本研究证实了AFP对HCC的诊断价值(AUC=0.827),而CA199、CA125则对ICC有一定的诊断价值,AUC分别为0.713,0.600,但这些肿瘤标志物单独对HCC和ICC诊断的敏感度或特异性不高,临床应用过程中仍存在明显局限性。本研究显示联合诊断方案均优于单一指标的诊断价值,其中,PCT+AFP+CA199+CA125的AUC最大(0.891),对该最佳联合方案在术前明确诊断组和非明确诊断组的验证提示该联合方案对HCC具有重要的诊断价值。PLT、PCT与影像学、穿刺活检等其他的鉴别方式相比,获取简单、费用低、无创,未来有望成为HCC和ICC鉴别诊断的另一种辅助方法。但本研究属回顾性研究,且样本量较少,未来仍需要进行多中心,大样本的前瞻性研究进行验证。
综上所述,PLT及PCT可作为术前鉴别HCC和ICC的重要辅助指标。联合PLT、PCT可增加现有肿瘤标志物单独对术前HCC和ICC的鉴别诊断效能。PCT+AFP+CA199+CA125为最佳联合方案有助于术前对HCC和ICC的鉴别诊断。
作者贡献:
张浩东:数据收集和统计分析,构思和撰写文章
魏丰贤:指导文章撰写
张春芳:文章内容修改润色
徐小东:指导文章整体构思和内容修改
| [1] |
Sia D, Villanueva A, Friedman SL, et al. Liver Cancer Cell of Origin, Molecular Class, and Effects on Patient Prognosis[J]. Gastroenterology, 2017, 152(4): 745-761. DOI:10.1053/j.gastro.2016.11.048 |
| [2] |
Massarweh NN, El-Serag HB. Epidemiology of Hepatocellular Carcinoma and Intrahepatic Cholangiocarcinoma[J]. Cancer Control, 2017, 24(3): 1073274817729245. |
| [3] |
Brown KM, Parmar AD, Geller DA. Intrahepatic cholangiocarcinoma[J]. Surg Oncol Clin N Am, 2014, 23(2): 231-246. DOI:10.1016/j.soc.2013.10.004 |
| [4] |
中华人民共和国国家卫生健康委员会医政医管局. 原发性肝癌诊疗规范(2019年版)[J]. 中华肝脏病杂志, 2020, 28(2): 112-128. [Department of Medical Administration, National Health and Health Commission of the People's Republic of China. Guidelines for diagnosis and treatment of primary liver cancer in China (2019 edition)[J]. Zhonghua Gan Zang Bing Za Zhi, 2020, 28(2): 112-128. DOI:10.3760/cma.j.issn.1007-3418.2020.02.004] |
| [5] |
杭轶, 杨小勇, 李文美. 肝内胆管癌与肝细胞癌临床特征的比较研究[J]. 中国普通外科杂志, 2015, 24(2): 175-179. [Hang Y, Yang XY, Li WM. Comparative study of clinical features between intrahepatic cholangiocarcinoma and hepatocellular carcinoma[J]. Zhongguo Pu Tong Wai Ke Za Zhi, 2015, 24(2): 175-179.] |
| [6] |
陈丽华, 刘爱连, 宋清伟, 等. 磁共振扩散张量成像鉴别诊断肝内胆管细胞癌与肝细胞癌[J]. 中国医学影像技术, 2017, 33(7): 993-997. [Chen LH, Liu AL, Song QW, et al. Diffusion tensor imaging in differential diagnosis of intrahepatic cholangiocarcinoma and hepatocellular carcinoma[J]. Zhongguo Yi Xue Ying Xiang Ji Shu, 2017, 33(7): 993-997.] |
| [7] |
Wang K, Zhang H, Xia Y, Liu J, et al. Surgical options for intrahepatic cholangiocarcinoma[J]. Hepatobiliary Surg Nutr, 2017, 6(2): 79-90. DOI:10.21037/hbsn.2017.01.06 |
| [8] |
Macias RIR, Kornek M, Rodrigues PM, et al. Diagnostic and prognostic biomarkers in cholangiocarcinoma[J]. Liver Int, 2019, 39 Suppl 1: 108-122. |
| [9] |
Banales JM, Iñarrairaegui M, Arbelaiz A, et al. Serum Metabolites as Diagnostic Biomarkers for Cholangiocarcinoma, Hepatocellular Carcinoma, and Primary Sclerosing Cholangitis[J]. Hepatology, 2019, 70(2): 547-562. DOI:10.1002/hep.30319 |
| [10] |
Blechacz B, Komuta M, Roskams T, et al. Clinical diagnosis and staging of cholangiocarcinoma[J]. Nat Rev Gastroenterol Hepatol, 2011, 8(9): 512-522. DOI:10.1038/nrgastro.2011.131 |
| [11] |
王冲, 程石. 肝内胆管癌—国内外专家共识及指南解读[J]. 外科理论与实践, 2021, 26(2): 124-129. [Wang C, Cheng S. Intrahepatic cholangiocarcinoma- consensus and guideline interpretation of experts at home and abroad[J]. Wai Ke Li Lun Yu Shi Jian, 2021, 26(2): 124-129.] |
| [12] |
Torre LA, Bray F, Siegel RL, et al. Global cancer statistics, 2012[J]. CA Cancer J Clin, 2015, 65(2): 87-108. DOI:10.3322/caac.21262 |
| [13] |
Zhang H, Yang T, Wu M, et al. Intrahepatic cholangiocarcinoma: Epidemiology, risk factors, diagnosis and surgical management[J]. Cancer Lett, 2016, 379(2): 198-205. DOI:10.1016/j.canlet.2015.09.008 |
| [14] |
安澜, 冉显会, 郑荣寿, 等. 中国肝细胞癌和肝内胆管细胞癌临床诊疗情况比较研究[J]. 中国癌症防治杂志, 2021, 13(2): 126-132. [An L, Ran XH, Zheng RS, et al. A comparative study on clinical diagnosis and treatment of hepatocellular carcinoma and intrahepatic cholangiocarcinoma in China[J]. Zhongguo Ai Zheng Fang Zhi Za Zhi, 2021, 13(2): 126-132. DOI:10.3969/j.issn.1674-5671.2021.02.03] |
| [15] |
Chan TS, Hwang YY, Gill HS, et al. Increasing incidence of venous thromboembolism due to cancer-associated thrombosis in Hong Kong Chinese[J]. Throm Res, 2014, 134(5): 1157-1159. DOI:10.1016/j.thromres.2014.08.008 |
| [16] |
Walker AJ, Grainge MJ, Card TR, et al. Venous thromboembolism in children with cancer-A population-based cohort study[J]. Throm Res, 2014, 133(3): 340-344. DOI:10.1016/j.thromres.2013.12.021 |
| [17] |
Nailin Li. Platelets in cancer metastasis: To help the "villain" to do evil[J]. Int J Cancer, 2016, 138(9): 2078-2087. DOI:10.1002/ijc.29847 |
| [18] |
Best MG, Sol N, Kooi I, et al. RNA-Seq of tumor-educated platelets enables blood-based pan-cancer, multiclass, and molecular pathway cancer diagnostics[J]. Cancer Cell, 2015, 28(5): 666-676. DOI:10.1016/j.ccell.2015.09.018 |
| [19] |
Nilsson RJ, Balaj L, Hulleman E, et al. Blood platelets contain tumor-derived RNA biomarkers[J]. Blood, 2011, 118(13): 3680-3683. DOI:10.1182/blood-2011-03-344408 |
| [20] |
Cetin M, Bakirci EM, Baysal E, et al. Increased platelet distribution width is associated with ST-segment elevation myocardial infarction and thrombolysis failure[J]. Angiology, 2014, 65(8): 737-743. DOI:10.1177/0003319713520068 |
| [21] |
Yan M, Lesyk G, Radziwon-Balicka A, et al. Pharmacological Regulation of Platelet Factors That Influence Tumor Angiogenesis[J]. Semin Oncol, 2014, 41(3): 370-377. DOI:10.1053/j.seminoncol.2014.04.007 |
| [22] |
Szubert S, Moszynski R, Szpurek D, et al. The expression of Platelet-derived Growth factor receptors (PDGFRs) and their correlation with overall survival of patients with ovarian cancer[J]. Ginekol Pol, 2019, 90(5): 242-249. DOI:10.5603/GP.a2019.0045 |
| [23] |
D'Oronzo S, Brown J, Coleman R. The role of biomarkers in the management of bone-homing malignancies[J]. J Bone Oncol, 2017, 9: 1-9. DOI:10.1016/j.jbo.2017.09.001 |
| [24] |
董超男, 翟文萍, 王雪野. 血小板介导肿瘤细胞生长和转移的机制研究进展[J]. 医学综述, 2020, 26(4): 695-699. [Dong CN, Zhai WP, Wang XY. Research progress in mechanism of platelet-mediated tumor cell growth and metastasis[J]. Yi Xue Zong Shu, 2020, 26(4): 695-699. DOI:10.3969/j.issn.1006-2084.2020.04.014] |
 2022, Vol. 49
2022, Vol. 49



