文章信息
- 抗肿瘤药物临床试验的研究进展
- Research Progress on Clinical Trials of Antitumor Drugs
- 肿瘤防治研究, 2022, 49(2): 163-166
- Cancer Research on Prevention and Treatment, 2022, 49(2): 163-166
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2022.21.0873
- 收稿日期: 2021-08-04
- 修回日期: 2021-09-14
2. 730050 兰州,解放军联勤保障部队第九四〇医院眼科
2. Department of Ophthalmology, 940th Hospital of Joint Logistics Support Force of People's Liberation Army, Lanzhou 730050, China
半世纪前,医生和工程师都梦想计算机用于疾病诊断、资料存储和信息交流[1]。今天,数字医学逐渐发展并用于肿瘤治疗[2]。未来十年,精准医学推动的大纵向队列研究将改变传统的肿瘤临床试验设计,抗肿瘤药物的临床试验将进入数字、虚拟和精准时代,肿瘤研究将更加多样和包容[3-4]。
1 传统临床试验临床试验是肿瘤学的重要组成部分,传统临床试验不仅证明了肿瘤细胞毒药物和分子靶向药物的临床价值,也奠定了目前大多数肿瘤标准治疗的基础[5]。然而,招募入组患者是完成临床试验的主要瓶颈,约12%临床试验最终获得成功,大多数临床试验因不能证明其安全或有效而失败,其他失败的原因包括设计缺陷、资金短缺或试验者招募不足和脱落等。为了提高试验成功率,研究者借助了人工智能。电子健康记录、无线通信设备和深度机器学习等人工智能不仅节约了资金,也扩大了试验性治疗并加快了试验进度。当我们对肿瘤生物学的理解逐渐加深,肿瘤临床试验也相应地不断进步,整合了全分子图谱、机器学习和真实世界数据的试验设计成为治愈肿瘤的关键。数字临床试验和虚拟临床试验不仅克服了传统临床试验的局限,也能够增加试验人群的种族多样性[6]。
临床试验推动肿瘤治疗。传统临床试验需要场地,类型多样,见图 1。入组者往往住在试验场地附近以便于访视,研究者和入组者在固定场地面对面地签署知情书、筛选检查、收集标本和资料,这些试验用于研究肿瘤新药的安全和疗效[7]。不同临床试验类型有各自的优缺点,干预试验主要研究生物标志物指导下的药物或方案的效果,数据质量高但受试人群小;真实世界数据提供了更多的信息,但质量参差不齐;主方案设计可以在同一个总试验方案内对多种试验肿瘤药物或多种肿瘤类型同时进行评估,效率更高。观察试验努力寻找生物标志物或治疗策略,架起了干预试验和真实世界数据之间的桥梁[8]。主观察试验是一种新的临床试验类型,联合基于分子分型的主干预试验和真实世界数据,提供了分子医学快速进入临床的通路,回答了常规临床试验不能回答的问题,也完美地将诊断和治疗融入了干预试验[9]。但是,肿瘤分子特征和临床状态的复杂性需要寻找新的靶向药物,这驱动了大数据和精准医学指导下的新临床试验的设计[10]。
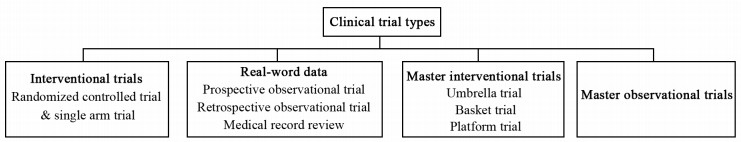
|
| 图 1 传统临床试验的类型 Figure 1 Types of conventional clinical trials |
数字技术影响着肿瘤的临床试验。数字试验是评价新药、器械等安全和疗效最重要的方法,它通过数字技术远距离招募、筛选和入组适合患者,数字传感器收集并传回试验患者资料,但研究者并不需要会面。另外,数字临床试验不需要传统临床试验的场地、设备和人力,但较传统试验更加有效和快捷[11]。数字临床试验得益于人工智能和无线传输的进步,需要互联网接入,各种沟通也通过e-mail、电话或视频完成。然而,数字临床试验不是常规临床试验过程的简单复制和数字转化,而是围绕入组试验者的重新思考和设计[12]。数字临床试验的关键因素包括三方面:数字招募和入组、数字资料收集和数字结果分析[13],见图 2。

|
| 图 2 数字临床试验的基本构成 Figure 2 Element of a digital clinical trial |
电子知情同意书和互联网临床试验可以简化知情同意程序并扩大入组人群[14]。应用移动设备,试验者能够更加容易地参加和共享他们的数据,机器学习或神经网络应用标志物对试验患者精准分组。入组患者线上获得知情书和资料,相关检查由远程医学或研究护士完成,试验标本通过研究护士和当地实验室收集,而试验药物由研究护士送到家中并监督其服用。
2.2 数字资料收集移动手机通过网络提供了远程医疗和便携式传感器技术的技术平台,手持设备就能够获得影像资料和实验室数据。便携式传感器通过非侵入检测体液的生化指标,从而实时提供连续的人体中代谢、微生物和激素等信息。移动健康涉及传感器、智能手机、社交媒体和定位追踪技术,未来还包括语音视频、图解词典、音频采访和人机交互系统[15]。电子传感器也实时监控和报告患者的服药情况,和电子健康记录一起追踪和记录患者各个生理系统的变化[16],这些数据通过移动设备提供给研究者。
2.3 数字结果分析机器学习和人工智能通过分析试验数据建立预测模型并得出研究结论。机器学习也为临床试验提供了从预测治疗反应到鉴定新的治疗靶标等研究工具,从而提高了适应性试验设计的能力[10]。
临床研究公司Science 37已经与多家制药企业合作开展新药临床研究。Science 37提供远距离控制的临床试验,不需要或少需要场地,患者可以在家里完成临床试验而不受地域的限制。这种去中心化临床试验能够增加招募和减少脱落,也能提高临床试验的种族多样性。重要的是,快速招募可以使研究者较早地决定试验是否继续进行而不是直到试验失败才终止[17]。除了考虑安全、隐私和数据质量外,数字临床试验更多关注患者招募、入组和随访。另外,研究者也需要处理他们自己的数字干扰问题。
3 虚拟临床试验虚拟现实通过在线治疗帮助患者采取健康行为,这项技术正在改变现有的医学模式和临床试验,见图 3。虚拟临床试验可以模仿肿瘤患者如何对某一治疗产生反应,从而可能避免一个真实世界必定失败的临床试验。虽然模仿在很大程度上是理论的,但是数学模型能够模仿虚拟肿瘤患者对某一药物反应如何。
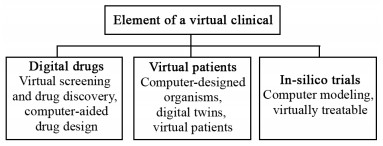
|
| 图 3 虚拟临床试验的基本构成 Figure 3 Element of a virtual clinical trial |
人工智能通过模拟生物过程发现新的药物靶点并重新设计药物,这些数字药物首先通过虚拟患者和虚拟试验进行验证[18]。合成生物学通过发现、认识和重构分子部件来编辑新的生物学功能,其与机器学习结合的计算机辅助设计生物体-生物机器人使真实的活体代替虚拟世界的数字,为数字药物增添了新内容[19]。Bryan等[20]应用计算机辅助设计构建了一个包含40个氨基酸残基的微蛋白PD-MP1,它能够特异地结合人PD-1/PD-L1。
3.2 虚拟患者类似于工程产品制造前的模具,医学数字分身应用多种数据流计算机模拟个体患者的疾病过程[21]。数字分身是动态功能的数字克隆而非真实的产品。医学中患者特异的数字分身能够实时整合患者临床资料从而模拟计算机刺激并预测患者反应,联合工程知识、观察数据和人工智能为虚拟临床试验提供理想的虚拟患者模型[22]。单细胞数字分身整合计算机模型中单细胞RNA资料从而推测对应单细胞的代谢表型和自动鉴定代谢亚群,为肿瘤临床试验提供了新的工具[23]。
3.3 虚拟试验机器学习分析数字药物对虚拟患者治疗的影响、预测治疗反应和建立疗效模型。Kozłowska等[24]应用虚拟临床试验评估卵巢癌联合治疗的效果,结果显示对化疗抵抗细胞敏感的药物可以增加铂类药物敏感度,而生物标志物分层临床试验的结果更多依赖药物本身和肿瘤构成而非标志物。虚拟临床试验应用虚拟患者和模型干预从而降低试验成本,而传统临床试验的费用相对较高。Sarrami-Foroushani等[25]证实虚拟临床试验中的分流器治疗脑动脉瘤成功率和以前真实的三个临床试验一致,发现虚拟临床试验能够成功复制传统临床试验的结果、完成传统试验不能实现的亚组分析以及发现治疗失败的可能因素。除了降低试验成本,虚拟临床试验还能够在临床研究前获得更多的数据、将试验群体扩展至难以招募表型的患者、直接比较同一虚拟群体中两种替代疗法的效果和减少对入组患者的伤害。
诺华积极推进远距离控制药物临床试验,这克服了传统临床试验的地域限制,同时也使更多人群参加临床研究。近三年诺华和虚拟研究公司Science 37合作开展了10项虚拟临床试验。人工智能软件Trial Pathfinder能够应用真实世界资料模仿肿瘤临床试验,学习优化肿瘤试验纳入标准[26-27]。
4 未来精准临床试验未来精准医学持续发展的关键领域之一是大纵向队列研究,精准临床试验将是未来抗肿瘤药物临床试验的方向。精准肿瘤试验在生物标志物指导下通过给患者提供更优的治疗选择而明显改善了肿瘤患者的预后[28]。虚拟分子肿瘤模块、动态精准医学和数字分身等支持队列选择和试验入组。虚拟分子肿瘤模块包括知识库、评分模型、报告工具和虚拟聊天等,通过整合分子检测结果、电子健康记录数据和临床指南为患者提出治疗选择。动态精准医学从初始治疗到未来决策考虑肿瘤的异质性和进化动力学,并根据患者耐药亚克隆出现的概率不断调整治疗方案[29]。肿瘤药物的临床试验也需要更多的受试人群和更低的试验费用,数字临床试验和虚拟临床试验克服了传统临床试验的局限,将极大地推动药物的发展和应用。
作者贡献:
张百红:检索文献,文章撰写
岳红云:文章审校
| [1] |
Greene JA, Lea AS. Digital Futures Past-The Long Arc of Big Data in Medicine[J]. N Engl J Med, 2019, 381(5): 480-485. DOI:10.1056/NEJMms1817674 |
| [2] |
Makin S. The Emerging World of Digital Therapeutics[J]. Nature, 2019, 573(7775): S106-S109. DOI:10.1038/d41586-019-02873-1 |
| [3] |
Denny JC, Collins FS. Precision medicine in 2030-seven ways to transform healthcare[J]. Cell, 2021, 184(6): 1415-1419. DOI:10.1016/j.cell.2021.01.015 |
| [4] |
Carpten JD, Fashoyin-Aje L, Garraway LA, et al. Making cancer research more inclusive[J]. Nat Rev Cancer, 2021, 21(10): 613-618. DOI:10.1038/s41568-021-00369-7 |
| [5] |
张百红, 岳红云. 系统生物学指导下的抗肿瘤药物临床试验[J]. 肿瘤, 2013, 33(7): 645-647. [Zhang BH, Yue HY. Clinical trials of antitumor agents in the theory of systems biology[J]. Zhong Liu, 2013, 33(7): 645-647.] |
| [6] |
Bumpus NN. For better drugs, diversify clinical trials[J]. Science, 2021, 371(6529): 570-571. DOI:10.1126/science.abe2565 |
| [7] |
Cummings SR. Clinical Trials Without Clinical Sites[J]. JAMA Intern Med, 2021, 181(5): 680-684. DOI:10.1001/jamainternmed.2020.9223 |
| [8] |
Dickson D, Johnson J, Bergan R, et al. Snapshot: Trial Types in Precision Medicine[J]. Cell, 2020, 181(1): 208-208.e1. DOI:10.1016/j.cell.2020.02.032 |
| [9] |
Dickson D, Johnson J, Bergan R, et al. The Master Observational Trial: A New Class of Master Protocol to Advance Precision Medicine[J]. Cell, 2020, 180(1): 9-14. DOI:10.1016/j.cell.2019.12.009 |
| [10] |
Li A, Bergan RC. Clinical trial design: Past, present, and future in the context of big data and precision medicine[J]. Cancer, 2020, 126(22): 4838-4846. DOI:10.1002/cncr.33205 |
| [11] |
Steinhubl SR, McGovern P, Dylan J, et al. The digitised clinical trial[J]. Lancet, 2017, 390(10108): 2135. DOI:10.1016/S0140-6736(17)32741-1 |
| [12] |
Steinhubl SR, Wolff-Hughes DL, Nilsen W, et al. Digital clinical trials: creating a vision for the future[J]. NPJ Digit Med, 2019, 2: 126. DOI:10.1038/s41746-019-0203-0 |
| [13] |
Inan OT, Tenaerts P, Prindiville SA. Digitizing clinical trials[J]. NPJ Digit Med, 2020, 3: 101. DOI:10.1038/s41746-020-0302-y |
| [14] |
Grady C, Cummings SR, Rowbotham MC, et al. Informed Consent[J]. N Engl J Med, 2017, 376(9): 856-867. DOI:10.1056/NEJMra1603773 |
| [15] |
Sim I. Mobile Devices and Health[J]. N Engl J Med, 2019, 381(10): 956-968. DOI:10.1056/NEJMra1806949 |
| [16] |
Bera K, Schalper KA, Rimm DL, et al. Artificial intelligence in digital pathology-new tools for diagnosis and precision oncology[J]. Nat Rev Clin Oncol, 2019, 16(11): 703-715. DOI:10.1038/s41571-019-0252-y |
| [17] |
Smalley E. Clinical trials go virtual, big pharma dives in[J]. Nat Biotechnol, 2018, 36(7): 561-562. DOI:10.1038/nbt0718-561 |
| [18] |
Ho D. Artificial intelligence in cancer therapy[J]. Science, 2020, 367(6481): 982-983. DOI:10.1126/science.aaz3023 |
| [19] |
Tan X, Letendre JH, Collins JJ, et al. Synthetic biology in the clinic: engineering vaccines, diagnostics, and therapeutics[J]. Cell, 2021, 184(4): 881-898. DOI:10.1016/j.cell.2021.01.017 |
| [20] |
Bryan CM, Rocklin GJ, Bick MJ, et al. Computational design of a synthetic PD-1 agonist[J]. Proc Natl Acad Sci U S A, 2021, 118(29): e2102164118. DOI:10.1073/pnas.2102164118 |
| [21] |
Masison J, Beezley J, Mei Y, et al. A modular computational framework for medical digital twins[J]. Proc Natl Acad Sci U S A, 2021, 118(20): e2024287118. DOI:10.1073/pnas.2024287118 |
| [22] |
Laubenbacher R, Sluka JP, Glazier JA. Using digital twins in viral infection[J]. Science, 2021, 371(6534): 1105-1106. DOI:10.1126/science.abf3370 |
| [23] |
Filippo MD, Damiani C, Vanoni M, et al. Single-cell Digital Twins for Cancer Preclinical Investigation[J]. Methods Mol Biol, 2020, 2088: 331-343. |
| [24] |
Kozłowska E, Vallius T, Hynninen J, et al. Virtual clinical trials identify effective combination therapies in ovarian cancer[J]. Sci Rep, 2019, 9(1): 18678. DOI:10.1038/s41598-019-55068-z |
| [25] |
Sarrami-Foroushani A, Lassila T, MacRaild M, et al. In-silico trial of intracranial flow diverters replicates and expands insights from conventional clinical trials[J]. Nat Commun, 2021, 12(1): 3861. DOI:10.1038/s41467-021-23998-w |
| [26] |
Dolgin E. Industry embraces virtual trial platforms[J]. Nat Rev Drug Discov, 2018, 17(5): 305-306. DOI:10.1038/nrd.2018.66 |
| [27] |
Weng CH, Rogers JR. AI uses patient data to optimize selection of eligibility criteria for clinical trials[J]. Nature, 2021, 592(7855): 512-513. DOI:10.1038/d41586-021-00845-y |
| [28] |
Woo M. An AI boost for clinical trials[J]. Nature, 2019, 573(7775): S100-S102. DOI:10.1038/d41586-019-02871-3 |
| [29] |
Madhavan S, Beckman RA, McCoy MD, et al. Envisioning the future of precision oncology trials[J]. Nat Cancer, 2021, 2: 9-11. DOI:10.1038/s43018-020-00163-8 |
 2022, Vol. 49
2022, Vol. 49
