文章信息
- 仑伐替尼联合局部疗法治疗PD-L1基因阳性门脉癌栓程氏分型Ⅰ~Ⅲ型肝癌疗效观察
- Curative Effect of Lenvatinib Combined with Locoregional Therapy on PD-L1-positive Hepatocellular Carcinoma Patients with Type Ⅰ-Ⅲ Portal Vein Tumor Thrombus According to Cheng's Classification
- 肿瘤防治研究, 2022, 49(1): 53-57
- Cancer Research on Prevention and Treatment, 2022, 49(1): 53-57
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2022.21.0794
- 收稿日期: 2021-07-08
- 修回日期: 2021-09-14
2. 100191 北京,北京大学第三医院肿瘤放疗科;
3. 570100 海口,海南医学院第一附属医院胃肠肿瘤外科
2. Department of Radiation Oncology, Peking University Third Hospital, Beijing 100191, China;
3. Department of Gastrointestinal Cancer Surgery, The First Affiliated Hospital of Hainan Medical College, Haikou 570100, China
原发性肝癌是世界上排名第二位的肿瘤相关致死原因,在我国等发展中国家情况尤为严重。由于肝癌的解剖学和生物学特点,其合并门静脉癌栓(portal vein tumor thrombus, PVTT)的发生率较高,可达44.0%~62.2%[1]。肝癌合并PVTT患者中位生存期仅为2.7~4月[2]。程序性死亡配体1(programmed cell death 1 ligand 1, PD-L1)肝癌细胞中高表达,尤其在索拉菲尼耐药人肝癌细胞中高表达[3]。包括经导管肝动脉化疗栓塞术(transcatheterarterial chemoembolization, TACE)、门脉支架、碘125粒子植入、微波消融等局部治疗与系统治疗的靶向药物仑伐替尼均为目前原发性肝癌系统治疗的一线治疗方案,两种治疗方案同时获得NCCN指南原发性肝癌系统治疗的1A类推荐,仑伐替尼联合局部治疗干预后能否让PD-L1基因阳性程氏分型Ⅰ~Ⅲ型肝癌患者得到更多的临床获益,目前尚没有相关循证医学研究,本研究对60例接受仑伐替尼联合或不联合局部治疗的PD-L1基因阳性门脉癌栓程氏分型Ⅰ~Ⅲ型肝癌患者进行了随访,现报道如下。
1 资料与方法 1.1 病例选择2018年1月—2020年8月三亚中心医院或海南医学院第二附属医院收治的组织病理确诊为各期无手术指征肝癌。且合并程氏分型(Cheng’s classification)为Ⅰ~Ⅲ型门脉癌栓(portal vein tumor thrombus, PVTT)患者共60例,根据治疗方法分为仑伐替尼联合局部治疗组和局部治疗组两组,其中仑伐替尼联合局部治疗组患者32例,局部治疗组患者28例;男34例,女26例,男女比1.3:1,年龄37~70岁;选择同期局部治疗28例肝癌患者作为对照组。纳入标准:入选患者均为经B型超声、CT、MRI或数字减影血管造影(digital subtraction angiography, DSA)发现门脉癌栓,既往无门脉癌栓治疗史;肝功能Child-Pugh分级A级或B级;以及符合肿瘤内科靶向药物治疗和肝癌局部治疗适应证,均未接受过化疗、靶向分子药物、PD-1/PD-L1等治疗。排除标准:疑似非癌栓形成和PVTT的介入等治疗史、合并严重心肝肾功能不全,无法完成治疗、出血倾向,凝血时间明显延长国际标准化比值(international normalized ratio, INR) > 1.5、ECOG评分体力状态极差无法耐受靶向药物过敏者以及患者本人拒绝使用靶向分子药物和局部治疗等。本研究经医学伦理委员会批准(批号:医伦2020第6号)。数据不会泄露任何个人隐私,已获得入组所有患者知情同意。
1.2 治疗方法仑伐替尼联合局部治疗组患者持续口服仑伐替尼12 mg每天一次(体重≥60 kg)或8 mg每天一次(体重 < 60 kg)。无局部治疗禁忌证者予局部治疗,局部治疗方法包括:肝动脉化疗栓塞术(TACE)、门静脉支架、碘125粒子植入或粒子链植入或微波消融等。对照组患者仅行局部治疗。如行局部治疗患者根据影像学复查情况,评估是否再次局部治疗。治疗期间常规给予还原型谷胱甘肽注射液护肝;予胃复安、托烷司琼止吐,奥美拉唑护胃,介入等局部治疗后发热者予药物退热对症治疗,有肝区疼痛者予三阶梯镇痛原则予止痛药物治疗。口服仑伐替尼高血压者予降压等对症治疗。
1.3 疗效及不良反应评价通过电话、门诊及住院病历的方式随访,随访至2021年2月,随访率为98.3%,若有失访患者则按删失计算。按照WHO实体瘤评估标准[2]对肝癌治疗疗效进行评价,分为完全缓解(complete remission, CR)、部分缓解(partial remission, PR)、稳定(stable disease, SD)和疾病进展(progressive disease, PD),CR+PR为有效(RR)。口服仑伐替尼联合局部治疗6~8周后复查评价疗效,以后每隔8周进行一次疗效评价。每个治疗周期开始前进行病史、体格检查,观察KPS变化,血常规、肝肾功能、AFP、心电图、CT或MRI以及彩超检查。随访评估中位生存时间。观察不良反应,不良反应按WHO抗癌药物不良反应标准评价,分为0~Ⅳ度。
1.4 统计学方法采用SPSS19.0软件进行统计分析,一般资料以平均数±标准差表示,定量资料行t检验,定性资料行χ2检验;使用Kaplan-Meier曲线分析生存率。P < 0.05为差异有统计学意义。
2 结果 2.1 PD-L1基因阳性门脉癌栓程氏分型Ⅰ~Ⅲ型肝癌患者一般资料仑伐替尼联合局部治疗组和局部治疗组患者在性别、年龄、ECOG=0分、AFP > 400 ng/ml、PVTT程氏分型Ⅰ型、PD-L1表达水平≥10%、TACE+微波消融、门脉高压、ALT≥40 μmol/L、Child-Pugh分级A级以及TB < 20 μmol/L比较,两组差异无统计学意义(均P > 0.05),见表 1。

|
仑伐替尼联合局部治疗组患者经治疗后有效率(78.1% vs. 53.6%)和疾病控制率(90.6% vs. 67.9%)均高于局部治疗组患者;两组差异均有统计学意义(P=0.044, P=0.029),见表 2。

|
Kaplan-Meier曲线生存分析显示,仑伐替尼联合局部治疗组中位生存期为35.0月;局部治疗组中位生存期为22.0月;仑伐替尼联合局部治疗组的总生存率高于局部治疗组(P=0.021),见图 1。
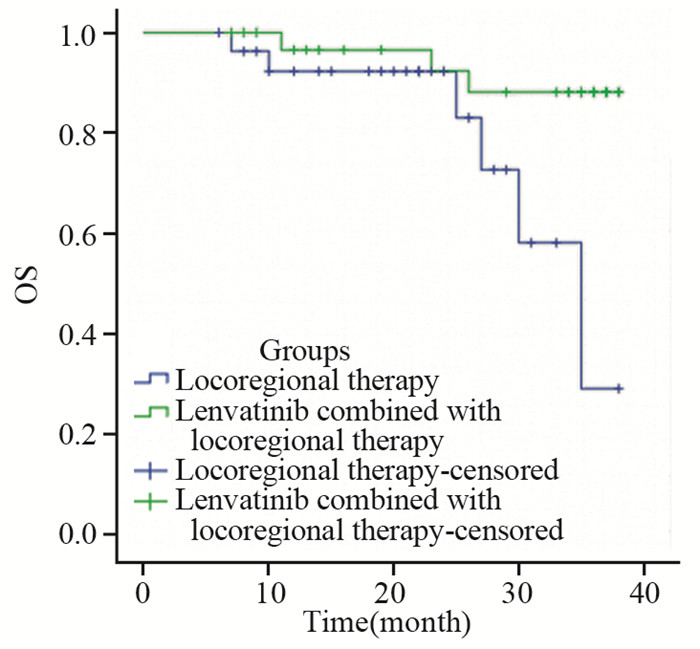
|
| 图 1 两组PD-L1基因阳性程氏分型Ⅰ~Ⅲ型肝癌患者生存率比较 Figure 1 Survival curves of PD-L1-positive hepatocellular carcinoma patients with typeⅠ-Ⅲ portal vein tumor thrombus according to Cheng's classification |
服用仑伐替尼和局部治疗的主要不良反应为胃肠道反应、高血压、蛋白尿、疲乏、肝区疼痛、肝功能损伤以及发热;进入本研究的两组60例PD-L1基因阳性程氏分型Ⅰ~Ⅲ型肝癌患者均未出现Ⅲ~Ⅳ级的严重不良反应,均无因不良反应减量或停药退出研究。两组肝癌患者的主要不良反应为胃肠道反应、高血压、蛋白尿、肝部疼痛、肝功损害、疲乏、发热,两组不良反应差异无统计学意义(均P > 0.05),以上不良反应均较轻微,经护胃止吐、止泻、降压、保肝治疗等对症支持治疗可缓解,见表 3。
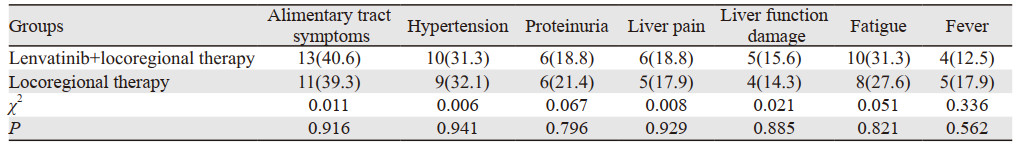
|
目前,门脉癌栓程氏分型Ⅰ~Ⅲ型肝癌患者的治疗主要是手术联合TACE等各种局部治疗,无手术指征者则为TACE联合粒子门脉支架、消融等局部治疗及支持治疗等多种治疗模式[4];同样,靶向分子药物也是治疗晚期原发性肝癌的主要手段之一,其中索拉菲尼和仑伐替尼是目前原发性肝癌系统治疗的靶向一线治疗方案,两药同时获得NCCN指南原发性肝癌系统治疗的1A类推荐[5],PD-L1在肝癌细胞中普遍高表达,尤其在索拉菲尼耐药人肝癌细胞中高表达[3],所以索拉非尼对PD-L1基因阳性程氏分型Ⅰ~Ⅲ型肝癌患者总生存改善并不显著。虽然多项大型的、随机对照、多中心3期研究SHARP、Oriental以及REFLECT等结果均表明在延长晚期原发性肝癌患者的生存期方面,仑伐替尼非劣效于索拉非尼,相比于索拉非尼,仑伐替尼可显著提高客观缓解率(40.6% vs. 12.4%)和无进展生存期(7.3月vs. 3.6月);而针对中国患者,仑伐替尼可提高总生存期(15.0 vs. 10.2月),降低50%的死亡风险[6-8]。而仑伐替尼联合局部治疗治疗PD-L1基因阳性程氏分型Ⅰ~Ⅲ型肝癌患者国内报道甚少,本研究报道仑伐替尼联合局部治疗治疗PD-L1基因阳性程氏分型Ⅰ~Ⅲ型肝癌患者的疗效和安全性情况。
本研究显示,仑伐替尼联合局部治疗组和局部治疗组患者的临床特征并无明显差别。本研究中,PD-L1基因阳性肝癌患者合并门脉癌栓PVTT程氏分型Ⅰ型、Child-Pugh分级A级以及TB < 20 μmol/L人数均占各组患者人数绝大多数比例;局部治疗仍是目前合并PD-L1基因阳性肝癌患者合并门脉癌栓治疗的主要手段,肝癌局部治疗对患者一般情况尤其肝功能要求较高,Child-Pugh分级A级、TB < 20 μmol/L为无黄疸或肝细胞储备功能较好,故本研究Child-Pugh分级A级、TB < 20 μmol/L人数均占各组患者人数绝大多数比例。另外,门脉癌栓PVTT程氏分型Ⅱ~Ⅳ型累及一级门静脉分支或门静脉主干甚至肠系膜上静脉,并非肝癌局部治疗最优适应证。故本研究入组患者多为门脉癌栓PVTT程氏分型Ⅰ型患者。虽然本研究入组门脉癌栓Ⅰ型患者较多,但Ⅱ~Ⅳ型不是TACE及微波消融等局部治疗的禁忌证,已有研究表明TACE及微波消融等局部治疗对门脉分支癌栓患者安全有效[9]。
本研究结果显示仑伐替尼联合局部治疗组有效率和疾病控制率均高于局部治疗组;两组差异均有统计学意义。印证了国内报道的仑伐替尼联合TACE等局部治疗效果优于单纯局部治疗治疗进展期肝癌[10]。仑伐替尼联合局部治疗组的有效率和疾病控制率分别78.1%和90.6%,均高于国内报道的索拉菲尼联合局部治疗治疗肝癌并门脉癌栓的有效率和疾病控制率[11],可能与该报道入组条件为门脉主干或主分支癌栓患者预后相对较差相关,本研究均为索拉菲尼耐药的PD-L1基因阳性肝癌患者,有效率和疾病控制率较好可能与选用的一线靶向药物为仑伐替尼而非索拉菲尼相关,也可能与本研究入组均为PD-L1基因阳性门脉癌栓程氏分型Ⅰ~Ⅲ型肝癌患者,样本量较小相关。
本研究Kaplan-Meier生存分析显示,仑伐替尼联合局部治疗组中位生存期为35.0月,局部治疗组中位生存期为22.0月。与国内外多个研究相比,本研究中无论仑伐替尼联合局部治疗组或局部治疗组均远超以TACE为主的局部治疗联合靶向药物治疗中位生存期10.2月,且安全性与单纯局部治疗相当[4]。日本关于仑伐替尼真实世界临床数据显示:基线肝功能Child-pugh分级A级晚期肝癌患者使用仑伐替尼作为2线治疗(索拉非尼之后)和作为3线治疗(瑞戈非尼之后)的客观缓解率、疾病控制率以及中位生存期与Ⅲ期试验REFLECT临床数据基本一致,不良反应也基本相当。甚至在小样本针对不符合临床试验标准的患者,仑伐替尼疗效优异[12]。另外,国内有研究结果显示对肝癌合并门脉癌栓最基础的局部治疗方法TACE无效的中晚期肝细胞癌患者,仑伐替尼仍部分有效,并能明显延长患者生存时间[13]。本研究结果在佐证国内学者的相关研究的同时,也提示仑伐替尼联合局部治疗能改善PD-L1基因阳性门脉癌栓程氏分型Ⅰ~Ⅲ型肝癌患者生存期。但也有日本研究者主导的TACTICS研究、一项全球多中心随机双盲对照Ⅱ期临床研究(SPACE研究)以及另一项英国多中心安慰剂对照随机Ⅲ期临床试验(TACE2)指出:靶向联合局部治疗组患者的无进展生存期、发生血管侵犯和肝外转移的时间均显著高于局部治疗组,靶向联合局部治疗治疗对比单纯局部治疗并未给患者带来明显生存获益[14],提示仑伐替尼联合局部治疗治疗PD-L1基因阳性门脉癌栓程氏分型Ⅰ~Ⅲ型肝癌患者远期疗效可能较局部治疗好,目前国内并无相关报道,需要进一步地多地区大样本的相关研究来进一步佐证。
仑伐替尼和局部治疗主要不良反应为胃肠道反应、高血压、蛋白尿、疲乏、肝区疼痛、肝功损害以及发热,但国内也有Meta研究指出,仑伐替尼单药或联合所致的不良反应中以呼吸系统和泌尿系统最为多见(21.05%),且主要发生在用药后1月内(68.42%)[15],本研究中仑伐替尼联合局部治疗不良反应并未较局部治疗增加,总体反应较轻,且两组患者发生不良反应比例并无明显差异,患者均可耐受,提示可能与本研究中入组患者的肝炎类型、肝硬化程度重及肝功能分级有关。
综上所述,仑伐替尼联合局部治疗治疗PD-L1基因阳性门脉癌栓程氏分型Ⅰ~Ⅲ型肝癌患者效果好、不良反应轻微。通过比较,PD-L1基因阳性门脉癌栓程氏分型Ⅰ~Ⅲ型肝癌患者应用仑伐替尼联合局部治疗的治疗效果好于局部治疗。本研究仅将有限观察指标纳入分析,其他未涉及的观察指标的作用仍需进一步研究。
作者贡献:
陈珑:选题设计、病例资料与数据收集、文章撰写和修改
刘宇杰:指导选题与设计、数据收集
田素青、王翠英、何冬雷:提供病例资料
| [1] |
Zhang ZM, Lai EC, Zhang C, et al. The strategies for treating primary hepatocellular carcinoma with portal vein tumor thrombus[J]. Int J Surg, 2015, 20: 8-16. DOI:10.1016/j.ijsu.2015.05.009 |
| [2] |
Katagiri S, Yamamoto M. Multidisciplinary treatments for hepatocellular carcinoma with major portal vein tumor thrombus[J]. Surg Today, 2014, 44(2): 219-226. DOI:10.1007/s00595-013-0585-6 |
| [3] |
孙非凡, 李栋, 李华, 等. 程序性死亡配体1在索拉非尼耐药肝癌细胞中的表达及功能[J]. 第二军医大学学报, 2018, 39(2): 152-158. [Sun FF, Li D, Li H, et al. Expression and role of programmed cell death ligand-1 in sorafenib-resistant hepatocellular carcinoma cells[J]. Di Er Jun Yi Da Xue Xue Bao, 2018, 39(2): 152-158.] |
| [4] |
广东省抗癌协会肝癌专业委员会, 广东省医学会肝胆胰外科学分会. 肝细胞肝癌合并门静脉癌栓多学科团队综合治疗广东专家共识(2015版)[J]. 中华消化外科杂志, 2015, 14(9): 694-701. [The Society of Liver Cancer of Guangdong Anti-cancer Association, The Society of Hepato-Pancreato-Biliary Surgery of Guangdong Medical Association. Cantonese expert consensus on multidisciplinary team treatment for hepatocellular carcinoma with portal vein tumor thrombus(2015 edition)[J]. Zhonghua Xiao Hua Wai Ke Za Zhi, 2015, 14(9): 694-701. DOI:10.3760/cma.j.issn.1673-9752.2015.09.002] |
| [5] |
National Comprehensive Cancer Network. NCCN clinical practice guidelines in oncology (NCCN guidelines) Hepatocellular Carcinoma(version 5.2020)[EB/OL]. https://www.nccn.org/professionals/physician-gls/pdf/hepatobiliary-pdf.
|
| [6] |
Llovet JM, Ricci S, Mazzaferm V, et al. Sorafenib in advanced hepatocellular carcinoma[J]. N End J Med, 2008, 359(4): 378-390. DOI:10.1056/NEJMoa0708857 |
| [7] |
Cheng AL, Kang YK, Chen Z, et al. Emcacy and safety of sorafenib in patients in the Asia-Pacific region with advanced hepatocellular carcinoma: a phase Ⅲ randomized, double-blind placebo-controlled trial[J]. Lancet Oncol, 2009, 10(1): 25-34. DOI:10.1016/S1470-2045(08)70285-7 |
| [8] |
Kudo M, Finn RS, Qin S, et al. Lenvatinib versus sorafenib in first-line treatment of patients with unresectable hepatocellular carcinoma: a randomized phase 3 non-inferiority trial[J]. Lancet, 2018, 391(10126): 1163-1173. DOI:10.1016/S0140-6736(18)30207-1 |
| [9] |
黄海, 竺越, 保志军, 等. 肝动脉化疗栓塞术治疗老年肝癌病人的疗效及预后影响因素分析[J]. 实用老年医学, 2019, 33(6): 577-581. [Huang H, Zhu Y, Bao ZJ, et al. Prognostic factors of elderly patients with hepatocellular carcinoma undergoing transcatheter arterial chemoembolization[J]. Shi Yong Lao Nian Yi Xue, 2019, 33(6): 577-581. DOI:10.3969/j.issn.1003-9198.2019.06.015] |
| [10] |
王洪云. 甲磺酸仑伐替尼联合TACE治疗中晚期原发性肝癌的临床效果及安全性分析[J]. 中国医学创新, 2020, 17(31): 6-9. [Wang HY. Analysis on the Clinical Effect and Safety of Lenvatinib Mesilate Combined with TACE in the Treatment of Patients with Metaphase and Advanced Primary Liver Cancer[J]. Zhongguo Yi Xue Chuang Xin, 2020, 17(31): 6-9. DOI:10.3969/j.issn.1674-4985.2020.31.002] |
| [11] |
余紫珊, 何敏柯, 张耀军, 等. TAI联合索拉非尼和单用索拉非尼对伴门脉主干或主分支癌栓的肝癌的疗效比较[J]. 广东医学, 2018, 39(8): 1213-1222. [Yu ZS, He MK Y, Zhang YJ, et al. Sorafenib combined with transcatheter arterial infusion versus sorafenib alone for hepatocellular carcinoma with major portal vein carcinoma thrombosis[J]. Guangdong Yi Xue, 2018, 39(8): 1213-1222. DOI:10.3969/j.issn.1001-9448.2018.08.023] |
| [12] |
Tsuchiya K, Kurosaki M, Kaneko S, et al. A nationwide multicenter study in patients with unresectable hepatocellular carcinoma treated with lenvatinib in real world practice in Japan[J]. J Clin Oncol, 2019, 37(4-supl): 364. |
| [13] |
袁冰, 王燕, 张金龙, 等. 仑伐替尼治疗经肝动脉化疗栓塞术无效的中晚期肝细胞癌患者的临床观察[J]. 中华医学杂志, 2020, 100(1): 833-836. [Yuan B, Wang Y, Zhang JL, et al. Value of lenvatinib for the treatment of advanced hepatocellular carcinoma[J]. Zhonghua Yi Xue Za Zhi, 2020, 100(11): 833-836. DOI:10.3760/cma.j.cn112137-20190818-01832] |
| [14] |
郅新, 高健, 郑晟旻, 等. 肝细胞癌经动脉化疗栓塞治疗的应用现状与研究进展[J]. 中华普通外科杂志, 2019, 34(8): 742-744. [Zhi X, Gao J, Zheng S, et al. Research progress of transcatheter arterial chemoembolization treatment of hepatocellular carcinoma[J]. Zhonghua Pu Tong Wai Ke Za Zhi, 2019, 34(8): 742-744.] |
| [15] |
王慧, 顾红燕, 彭德明, 等. 仑伐替尼致不良反应文献分析[J]. 中国新药杂志, 2020, 29(14): 1675-1680. [Wang H, Gu HY, Peng DM, et al. Literature analysis of adverse drug reactions induced by lenvatinib[J]. Zhongguo Xin Yao Za Zhi, 2020, 29(14): 1675-1680. DOI:10.3969/j.issn.1003-3734.2020.14.021] |
 2022, Vol. 49
2022, Vol. 49
