文章信息
- 18F标记的PSMA PET/CT对前列腺癌区域淋巴结转移诊断价值的Meta分析
- Diagnostic Value of 18F-labeled PSMA PET/CT for Regional Lymph Node Metastasis in Prostate Cancer: A Meta-analysis
- 肿瘤防治研究, 2022, 49(2): 141-147
- Cancer Research on Prevention and Treatment, 2022, 49(2): 141-147
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2022.21.0752
- 收稿日期: 2021-06-29
- 修回日期: 2021-10-15
前列腺癌常见于50岁以上的男性,其发病率居全球男性恶性肿瘤首位,死亡率居第二位[1]。中高危前列腺癌常伴有淋巴结转移,有研究表明淋巴结转移的数量与无进展生存期及总生存期相关[2]。联合应用前列腺特异性膜抗原(prostate-specific membrane antigen, PSMA)正电子发射计算机体层摄影(positron emission tomography/computed tomography, PET/CT)和前哨淋巴结活检,可使中高危前列腺癌患者淋巴结分期的准确性达到94%[3]。68Ga标记的PSMA对前列腺癌淋巴结转移具有较好的诊断性能[4-5],但68Ga的半衰期为68分钟,远程运输存在一定的挑战,而18F标记的PSMA半衰期为110分钟,有利于长距离运输,而且患者接受的辐射相对更少,图像分辨率更高[6-7]。同时,18F标记的PSMA对膀胱的放射性剂量相对更低,尤其是18F-PSMA-1007在尿路的清除率极低[8],对盆腔内区域淋巴结转移的诊断可能具有较高的准确性。为进一步了解18F标记的PSMA PET/CT对前列腺癌区域淋巴结转移的诊断价值,我们进行此次Meta分析,以便为临床实践提供参考。
1 资料与方法 1.1 资料的纳入与排除标准纳入标准:(1)18F标记的PSMA PET/CT用于评估前列腺癌区域淋巴结转移或分期的文献;(2)所有病灶以穿刺活检或术后病理或临床影像学随访作为诊断金标准;(3)能够直接或间接获取真阳性数(TP)、假阳性数(FP)、假阴性数(FN)及真阴性数(TN)的四格表数据;(4)以患者为分析单位的文献,病例数不少于10例。
排除标准:(1)与本研究目的无关的文章;(2)综述性文章、读者来信、病例报告、会议摘要、动物实验;(3)以患者为分析单位的文献,病例数少于10例;(4)数据不齐全、无法直接或间接提取四格表数据的文献。
1.2 文献检索两名研究者独立通过计算机检索中英文数据库,数据库包括:中国知网(CNKI)、万方、维普、PubMed、Embase、Cochrane Library、Web of Science等。检索时间为2000年1月1日至2021年5月31日。英文检索词:prostatic neoplasms、prostate cancer、prostate carcinoma、PSMA、prostate-specific membrane antigen、18F-DCFPyL、18F-PSMA-1007、18F-DCFBC、positron emission tomography、PET、computed tomography、CT、lymph node。中文检索词:前列腺癌、前列腺特异性膜抗原、正电子发射计算机体层摄影。检索方式为主题词与自由词结合,经过多次预检索后确定最终的检索策略,并根据各数据库的特点进行适当调整。以PubMed为例,检索策略为:#1 Prostatic Neoplasms [Mesh] OR Prostate cancer OR Prostate carcinoma;#2 PSMA OR Prostate-specific membrane antigen;#3 DCFPyL OR PSMA-1007 OR DCFBC;#4 Positron emission tomography/computed tomography OR PET/CT;#5 Lymph node;#6 #1 AND #2 AND #3 AND #4 AND #5。
1.3 文献筛选与数据提取利用EndNote X9删除重复文献后,所有文献均由两名研究者独立进行筛选,先浏览文献的标题和摘要,根据纳入标准和排除标准筛选出合适的文献,并进行全文阅读及提取相关数据。提取数据包括:第一作者、国家、发表年份、患者群体(新发或复发)、样本量、年龄、研究类型、诊断标准、示踪剂、TP、FP、FN、TN、分析单位。如研究中提供了两名或以上观察者的数据,则取平均值,遇到分歧时共同讨论得出一致的结论,若仍有异议则请第三方决定。
1.4 文献质量评价使用Cochrane推荐的QUADAS-2(第2版诊断准确性研究质量评估工具)进行文献质量评价,该工具包括病例选择、待评价试验、金标准、病例流程和进展情况四个方面。分别由两名评价者独立对纳入文献进行质量评价,若偏倚风险低或适用性好则评估为“低风险”、若偏倚风险不清楚则评估为“不确定”,若偏倚风险高或适用性差则评估为“高风险”。
1.5 数据分析采用Meta-disc1.4和Stata 16.0软件分析提取的四格表数据。首先,使用Spearman相关系数及综合受试者工作特征曲线(summary receiver operating characteristic, SROC)检验纳入文献是否存在阈值效应,若P < 0.05,提示存在阈值效应,则拟合SROC曲线;若P > 0.05,提示不存在阈值效应,则使用Stata 16.0软件包midas命令统计分析四格表数据,计算各研究的合并敏感度(sensitivity, Sen)、合并特异性(specificity, Spe)、合并阳性似然比(positive likelihood ratio, PLR)、合并阴性似然比(negative likelihood ratio, NLR)、诊断比值比(diagnostic odds ratio, DOR)和SROC曲线下面积(AUC)。通过异质性指数I2和χ2检验评估各研究的异质性。I2 < 25%为不存在异质性,25% < I2 < 50%为异质性较小,50% < I2 < 75%为存在一定的异质性,I2 > 75%则为存在较大的异质性。若异质性较明显,则进行Meta回归分析明确异质性的来源,如分析单位、研究类型、不同示踪剂等,计算各亚组之间的Sen、Spe。使用Stata 16.0制作漏斗图评估发表偏倚,检验水准P=0.05。
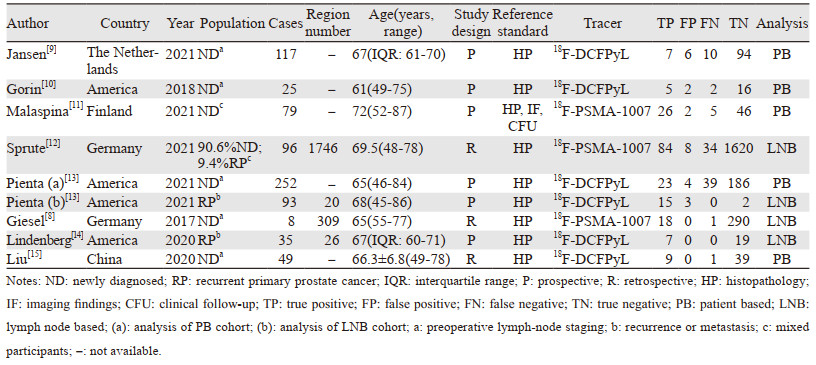
2 结果 2.1 文献检索结果通过检索中英文数据初步检出相关文献664篇,使用Endnote X9软件进行文献管理,删除重复文献122篇,经过阅读标题和摘要排除不相关文献484篇,对剩下的可能符合要求的58篇文献阅读全文,根据排除标准剔除无法直接或间接提取四格表数据的50篇文献,最终筛选出符合纳入标准的文献8篇,见图 1。
|
| 图 1 文献筛选流程图 Figure 1 Flow diagram of literature screening |
共纳入文献8篇,其中英文文献7篇,中文文献1篇;前瞻性研究5篇,回顾性研究3篇;共纳入分析754例前列腺癌患者的2 101枚淋巴结。只纳入新发病例的文献5篇,只纳入复发病例的文献1篇,同时纳入了新发和复发病例的文献2篇。以淋巴结为分析单位的文献3篇,以患者为分析单位的文献4篇,以患者和淋巴结为分析单位的文献1篇。以病理作为唯一诊断标准的文献7篇,以病理、影像学及临床随访资料作为诊断标准的文献1篇。5篇文献使用18F-DCFPyL作为示踪剂,3篇使用18F-PSMA-1007作为示踪剂,见表 1。
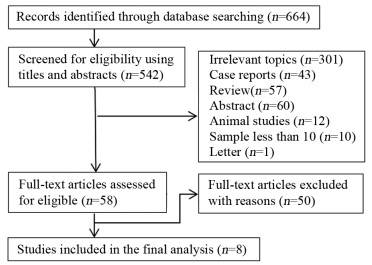
采用RevMan 5.3软件,根据QUADAS-2[16]中的条目对纳入的8篇文献进行质量评价,结果显示:大部分纳入文献在病例选择、待评价试验方面偏倚较小,而在金标准、病例流程和进展情况两个方面可能存在一定的偏倚,见图 2。一篇文献金标准的解读未使用盲法[9],部分文献没有足够的信息判断是否使用盲法[12, 14-15]。部分病例因病情变化未完成手术,或因治疗方案改变等原因无法获得病理结果而未被纳入最终的分析[8, 10, 13-14],其中一篇文献并非以病理作为唯一的诊断标准[11]。各纳入文献在病例的选择、待评价试验及金标准三方面的临床适用性较好。
|
| 图 2 18F标记的PSMA PET/CT诊断前列腺癌区域淋巴结转移的文献质量评价 Figure 2 Quality assessment of literatures about 18F-labeled PSMA PET/CT for diagnosis of regional lymph node metastasis in prostate cancer |
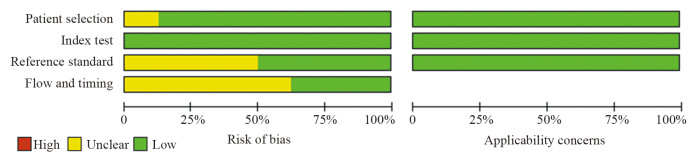
阈值分析结果提示Spearman相关系数为0.117(P=0.765),SROC曲线显示各研究的数据点不呈“肩臂状”分布,说明不存在阈值效应,见图 3。Sen和Spe的异质性结果显示,PSen < 0.01,ISen2=89.51%;PSpe < 0.01,ISen2=97.38%,提示各纳入文献的Sen和Spe存在高度异质性,见图 4。
|
| Sen: sensitivity; Spe: specificity. 图 3 18F标记的PSMA PET/CT诊断前列腺癌区域淋巴结转移的SROC曲线图 Figure 3 SROC curve of 18F-labeled PSMA PET/CT for diagnosis of regional lymph node metastasis in prostate cancer |
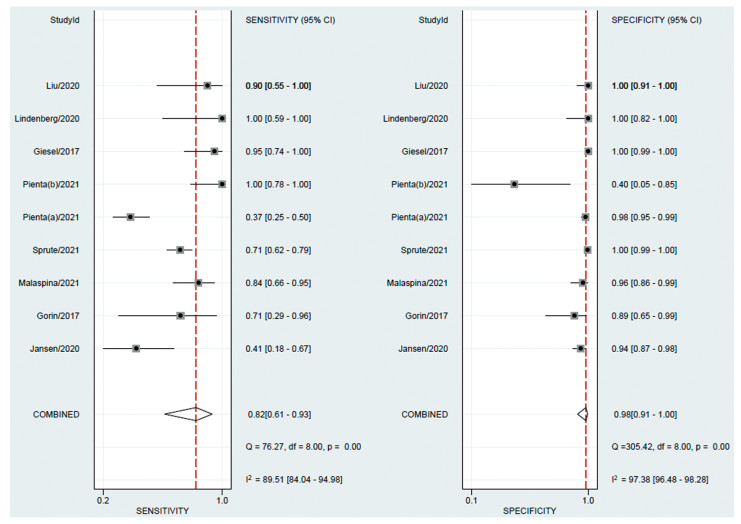
|
| 图 4 18F标记的PSMA PET/CT诊断前列腺癌淋巴结转移敏感度、特异性的森林图 Figure 4 Forest plot of sensitivity and specificity of 18F-labeled PSMA PET/CT for diagnosis of regional lymph node metastasis in prostate cancer |
18F标记的PSMA PET/CT诊断前列腺癌区域淋巴结转移的结果显示:Sen=0.82(95%CI: 0.61~0.93)、Spe=0.98(95%CI: 0.91~1.00)、PLR=45.7(95%CI: 9.0~231.3)、NLR=0.18(95%CI: 0.07~0.45)、DOR=251(95%CI: 34~1851)、AUC=0.97(95%CI: 0.95~0.98),见图 4。
2.4.3 Meta回归分析对本研究可能引起异质性的原因进行Meta回归分析,分析因素包括:研究类型、分析水平、放射性示踪剂、是否只纳入新发病例及术前淋巴结分期。结果显示:以淋巴结为分析单位是引起Sen异质性的主要原因,而前瞻性研究、使用放射性示踪剂18F-PSMA-1007、只纳入新发病例及术前淋巴结分期是引起Spe异质性的主要原因,见表 2。
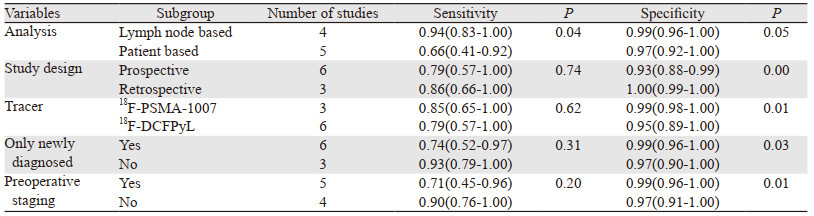
|
使用Stata 16.0软件绘制发表偏倚漏斗图,其中横坐标为DOR,纵坐标为有效样本量的平方根的倒数(1/ESS1/2),见图 5。所有纳入篇文献中,P=0.56(t=-0.61, 95%CI: -38.29, 22.67),说明发表偏倚存在的可能性较小。
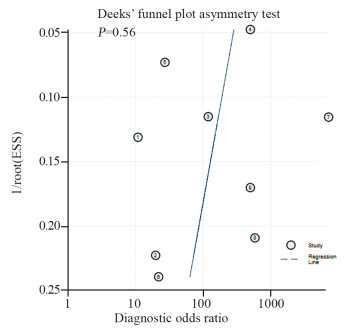
|
| 图 5 18F标记的PSMA PET/CT诊断前列腺癌区域淋巴结转移的发表偏倚漏斗图 Figure 5 Funnel plot of publication bias of 18F-labeled PSMA PET/CT for diagnosis of regional lymph node metastasis in prostate cancer |
中高危前列腺癌患者易发生区域或远处转移,部分临床复发的患者,复发部位最先发生于前列腺床和盆腔淋巴结,因此对淋巴结转移的准确诊断至关重要,关系患者的管理及预后[2, 17]。根据美国临床肿瘤学会(American Society of Clinical Oncology, ASCO)指南,对于常规影像学检查不明确或前列腺癌术后常规影像学检查阴性而前列腺特异性抗原(prostate-specific antigen, PSA)升高的患者,推荐行PSMA显像,尤其是有意愿行挽救性放疗的患者[18]。用于PSMA显像的放射性示踪剂主要有两类,包括68Ga和18F标记的药物。68Ga标记的PSMA主要缺点是半衰期较短、患者量多时生产成本较高及在膀胱的放射性相对较高,而18F标记的药物可以弥补这样的缺点[6]。有Meta分析表明,68Ga标记的PSMA PET/CT对前列腺癌术前淋巴结分期具有中度敏感度和高度特异性[19-20],尚未有研究系统性总结18F标记的PSMA PET/CT对前列腺癌区域淋巴结转移的诊断性能,本文就此进行Meta分析。
18F标记的PSMA PET/CT示踪剂主要有3种,分别是18F-PSMA-1007、18F-DCFPyL和18F-DCFBC,本研究纳入文献只包括前两种。相对而言,18F-PSMA-1007在膀胱的放射性剂量最低,对观察骨盆内的病灶可能更有优势,而其余两种示踪剂在膀胱内均可有放射性积聚[8, 21]。18F-PSMA-1007对前列腺癌根治术后的生化复发具有较高的检出率,能够检测出盆腔或腹膜后的转移淋巴结[22]。在高危前列腺癌患者中,18F-DCFPyL PET/CT对前列腺内肿瘤的检测具有很高的敏感度,可以检测到部分多参数磁共振成像(multiparametric magnetic resonance imaging, mpMRI)上漏诊的肿瘤[23]。同时,18F-DCFPyL PET/CT能检测出CT检查阴性的病灶,对一些CT显示没有肿大的淋巴结,仍可表现为阳性,该检查手段可作为原发性高危前列腺癌患者的一线成像方式,而且大部分患者不需要再进行额外的诊断性成像[24]。
CT及MRI等常规影像学检查方法均可用于评估前列腺癌患者的淋巴结分期,既往Meta分析表明CT和MRI诊断前列腺癌淋巴结转移具有较低的敏感度,分别为0.42和0.39[25]。一项研究表明,18F-PSMA-1007 PET/CT、全身MRI及增强CT对前列腺癌盆腔淋巴结转移诊断的敏感度分别为0.87、0.37和0.26,前者具有较明显的诊断优势,且能检出上述两种检查方法均呈阴性的转移淋巴结[11]。18F-DCFPyL PET/CT对前列腺癌盆腔淋巴结的检出率较mpMRI更高,在经活检证实的淋巴结病灶中,前者诊断敏感度更高(1.00 vs. 0.57)[14]。
本研究中,18F标记的PSMA PET/CT诊断前列腺癌区域淋巴结转移的敏感度为0.82,特异性为0.98,AUC值为0.97,说明18F标记的PSMA PET/CT对前列腺癌区域淋巴结转移具有较高的诊断性能,尤其特异性很高,这意味着影像上诊断淋巴结阴性时,能更有效地排除淋巴结转移的可能。一项纳入6篇研究的Meta分析中[19],其中5篇研究应用68Ga标记的PSMA PET/CT作为成像方式,该研究对前列腺癌淋巴结转移诊断的敏感度为0.71,特异性为0.95,与本研究有相似的高特异性,但本研究的Sen相对更高。18F标记的PSMA半衰期相对更长,考虑到运输过程,18F标记的示踪剂可能更适用于临床。
本研究所纳入的文献存在高度异质性,对可能引起异质性的因素进行Meta回归分析,结果显示以淋巴结为分析单位的敏感度高于以患者为分析单位(0.94 vs. 0.66),而特异性在两个分析单位之间相差不大(0.99 vs. 0.97)。Tu等[20]应用68Ga标记的PSMA PET/CT进行相关的Meta分析,结果也表明以淋巴结为分析单位的敏感度相对更高(0.70 vs. 0.63),且特异性亦较高(0.99 vs. 0.93),与本研究结果类似,但本研究的敏感度相对更高。这也说明以淋巴结为分析单位用于临床诊断前列腺癌区域淋巴结转移及进行临床分期的准确性更高。在临床研究中,由于研究方法存在差异,部分研究仅以患者或仅以淋巴结为分析单位,两者均可作为诊断的性能指标[19-20],本Meta分析的数据可为相关研究方法的选择提供一些参考信息。关于特异性的分析结果显示,前瞻性研究的特异性低于回顾性研究(0.93 vs. 1.00),这可能是因为在前瞻性研究中,部分纳入患者因病情的变化无法按计划进行手术或中途退出研究,导致少部分数据不能纳入最终的分析,在一定程度上影响诊断的性能。同时,回顾性研究可能会出现选择偏倚,导致诊断的性能偏高。应用放射性示踪剂18F-PSMA-1007的特异性较18F-DCFPyL相对更高(0.99 vs. 0.95),可能是由于后者通过尿路排泄,在膀胱内有一定的放射性积聚,影响盆腔内病灶的观察,对盆腔内转移淋巴结的诊断可能会出现假阳性的结果。只纳入新发病例的亚组较包含复发病例的亚组特异性相对更高(0.99 vs. 0.97),可能因为部分复发病例失去手术指征,更多地通过活检方式获得组织病理学结果,而体积较小或影像学阴性的病灶在临床上有更大的可能性不选择活检,这也可能出现选择性偏倚,影响最终的统计结果。也可能是由于复发病例接受过不同的治疗方案,转移前列腺癌细胞的PSMA表达出现了一定的差异。18F标记的PSMA PET/CT对前列腺癌术前淋巴结分期具有中度敏感度及高度特异性,有助于准确评估疾病的临床分期,指导治疗方案的选择。对于复发或转移性前列腺癌,因本Meta分析纳入的研究数量及样本量较少,未进行统计分析,有待进一步的扩大研究补充说明。
本Meta分析的局限性:(1)纳入的文献相对较少,可能存在一定偏倚,仍需更多的研究进一步证实。(2)其中一篇纳入文献并非以病理作为唯一的诊断金标准,在一定程度上影响了Meta分析的准确性。(3)少部分研究金标准的解读未使用盲法或无法判断是否使用盲法,结果解读可能存在偏倚。
综上,18F标记的PSMA PET/CT对前列腺癌区域淋巴结转移的诊断具有较高的敏感度及特异性,其药物半衰期及代谢特点具有较好的临床适用性,有望在临床上推广应用,有助于准确评估淋巴结分期,帮助临床医生根据不同患者的病情制定个体化的治疗方案。
作者贡献:
曾春媛:选题、文献检索与筛选、文献质量评价、数据提取、统计分析及论文撰写
程勇:文献检索与筛选、文献质量评价、数据提取、论文修改
徐浩:指导选题、论文修改与审校
| [1] |
Siegel RL, Miller KD, Fuchs HE, et al. Cancer statistics, 2021[J]. CA Cancer J Clin, 2021, 71(1): 7-33. DOI:10.3322/caac.21654 |
| [2] |
Ieiri K, Shiota M, Kashiwagi E, et al. The prognosis and the impact of radiotherapy in clinically regional lymph node-positive prostate cancer: which patients are candidates for local therapy with radiation?[J]. Urol Oncol, 2020, 38(12): 931.e1-931.e7. DOI:10.1016/j.urolonc.2020.08.018 |
| [3] |
Hinsenveld FJ, Wit EMK, van Leeuwen PJ, et al. Prostate-specific membrane antigen PET/CT combined with sentinel node biopsy for primary lymph node staging in prostate cancer[J]. J Nucl Med, 2020, 61(4): 540-545. DOI:10.2967/jnumed.119.232199 |
| [4] |
Zhang Q, Zang S, Zhang C, et al. Comparison of 68Ga-PSMA-11 PET-CT with mpMRI for preoperative lymph node staging in patients with intermediate to high-risk prostate cancer[J]. J Transl Med, 2017, 15(1): 230. DOI:10.1186/s12967-017-1333-2 |
| [5] |
Maurer T, Gschwend JE, Rauscher I, et al. Diagnostic efficacy of 68Gallium-PSMA positron emission tomography compared to conventional imaging for lymph node staging of 130 consecutive patients with intermediate to high risk prostate cancer[J]. J Urol, 2016, 195(5): 1436-1443. DOI:10.1016/j.juro.2015.12.025 |
| [6] |
Kesch C, Kratochwil C, Mier W, et al. 68Ga or 18F for prostate cancer imaging?[J]. J Nucl Med, 2017, 58(5): 687-688. DOI:10.2967/jnumed.117.190157 |
| [7] |
Sanchez-Crespo A. Comparison of Gallium-68 and Fluorine-18 imaging characteristics in positron emission tomography[J]. Appl Radiat Isot, 2013, 76: 55-62. DOI:10.1016/j.apradiso.2012.06.034 |
| [8] |
Giesel FL, Hadaschik B, Cardinale J, et al. F-18 labelled PSMA-1007: biodistribution, radiation dosimetry and histopathological validation of tumor lesions in prostate cancer patients[J]. Eur J Nucl Med Mol Imaging, 2017, 44(4): 678-688. DOI:10.1007/s00259-016-3573-4 |
| [9] |
Jansen BHE, Bodar YJL, Zwezerijnen GLC, et al. Pelvic lymph-node staging with 18F-DCFPyL PET/CT prior to extended pelvic lymph-node dissection in primary prostate cancer-the SALT trial[J]. Eur J Nucl Med Mol Imaging, 2021, 48(2): 509-520. DOI:10.1007/s00259-020-04974-w |
| [10] |
Gorin MA, Rowe SP, Patel HD, et al. Prostate specific membrane antigen targeted 18F-DCFPyL positron emission tomography/computerized tomography for the preoperative staging of high risk prostate cancer: results of a prospective, phase Ⅱ, single center study[J]. J Urol, 2018, 199(1): 126-132. DOI:10.1016/j.juro.2017.07.070 |
| [11] |
Malaspina S, Anttinen M, Taimen P, et al. Prospective comparison of 18F-PSMA-1007 PET/CT, whole-body MRI and CT in primary nodal staging of unfavourable intermediate- and high-risk prostate cancer[J]. Eur J Nucl Med Mol Imaging, 2021, 48(9): 2951-2959. DOI:10.1007/s00259-021-05296-1 |
| [12] |
Sprute K, Kramer V, Koerber SA, et al. Diagnostic accuracy of 18F-PSMA-1007 PET/CT imaging for lymph node staging of prostate carcinoma in primary and biochemical recurrence[J]. J Nucl Med, 2021, 62(2): 208-213. DOI:10.2967/jnumed.120.246363 |
| [13] |
Pienta KJ, Gorin MA, Rowe SP, et al. A phase 2/3 prospective multicenter study of the diagnostic accuracy of prostate specific membrane antigen PET/CT with 18F-DCFPyL in prostate cancer patients (OSPREY)[J]. J Urol, 2021, 206(1): 52-61. DOI:10.1097/JU.0000000000001698 |
| [14] |
Lindenberg L, Mena E, Turkbey B, et al. Evaluating biochemically recurrent prostate cancer: histologic validation of 18F-DCFPyL PET/CT with comparison to multiparametric MRI[J]. Radiology, 2020, 296(3): 564-572. DOI:10.1148/radiol.2020192018 |
| [15] |
刘亚超, 刘家金, 张晓军, 等. 18F-DCFPyL PET/CT术前诊断前列腺癌区域转移淋巴结[J]. 中国医学影像技术, 2020, 36(6): 868-872. [Liu YC, Liu JJ, Zhang XJ, et al. 18F-DCFPyL PET/CT in pre-operative diagnosis of regional lymph node metastasis from prostate cancer[J]. Zhongguo Yi Xue Ying Xiang Ji Shu, 2020, 36(6): 868-872.] |
| [16] |
Whiting PF, Rutjes AW, Westwood ME, et al. QUADAS-2: a revised tool for the quality assessment of diagnostic accuracy studies[J]. Ann Intern Med, 2011, 155(8): 529-536. DOI:10.7326/0003-4819-155-8-201110180-00009 |
| [17] |
Nini A, Gandaglia G, Fossati N, et al. Patterns of clinical recurrence of node-positive prostate cancer and impact on long-term survival[J]. Eur Urol, 2015, 68(5): 777-784. DOI:10.1016/j.eururo.2015.04.035 |
| [18] |
Trabulsi EJ, Rumble RB, Jadvar H, et al. Optimum imaging strategies for advanced prostate cancer: ASCO guideline[J]. J Clin Oncol, 2020, 38(17): 1963-1996. DOI:10.1200/JCO.19.02757 |
| [19] |
Kim SJ, Lee SW, Ha HK. Diagnostic performance of radiolabeled prostate-specific membrane antigen positron emission tomography/computed tomography for primary lymph node staging in newly diagnosed intermediate to high-risk prostate cancer patients: a systematic review and meta-analysis[J]. Urol Int, 2019, 102(1): 27-36. DOI:10.1159/000493169 |
| [20] |
Tu X, Zhang C, Liu Z, et al. The role of 68Ga-PSMA positron emission tomography/computerized tomography for preoperative lymph node staging in intermediate/high risk patients with prostate cancer: a diagnostic meta-analysis[J]. Front Oncol, 2020, 10: 1365. DOI:10.3389/fonc.2020.01365 |
| [21] |
Dietlein F, Kobe C, Hohberg M, et al. Intraindividual comparison of 18F-PSMA-1007 with renally excreted PSMA ligands for PSMA PET imaging in patients with relapsed prostate cancer[J]. J Nucl Med, 2020, 61(5): 729-734. DOI:10.2967/jnumed.119.234898 |
| [22] |
Giesel FL, Knorr K, Spohn F, et al. Detection efficacy of 18F-PSMA-1007 PET/CT in 251 patients with biochemical recurrence of prostate cancer after radical prostatectomy[J]. J Nucl Med, 2019, 60(3): 362-368. DOI:10.2967/jnumed.118.212233 |
| [23] |
Gaur S, Mena E, Harmon SA, et al. Prospective evaluation of 18F-DCFPyL PET/CT in detection of high-risk localized prostate cancer: comparison with mpMRI[J]. AJR Am J Roentgenol, 2020, 215(3): 652-659. DOI:10.2214/AJR.19.22042 |
| [24] |
Wondergem M, van der Zant FM, Broos WAM, et al. 18F-DCFPyL PET/CT for primary staging in 160 high-risk prostate cancer patients; metastasis detection rate, influence on clinical management and preliminary results of treatment efficacy[J]. Eur J Nucl Med Mol Imaging, 2021, 48(2): 521-531. DOI:10.1007/s00259-020-04782-2 |
| [25] |
Hövels AM, Heesakkers RA, Adang EM, et al. The diagnostic accuracy of CT and MRI in the staging of pelvic lymph nodes in patients with prostate cancer: a meta-analysis[J]. Clin Radiol, 2008, 63(4): 387-395. DOI:10.1016/j.crad.2007.05.022 |
 2022, Vol. 49
2022, Vol. 49