文章信息
- SLC16A家族与肺腺癌和肺鳞癌临床特征及生物学行为的关系
- Influence of SLC16A Family on Clinical Features and Biological Behaviours of Lung Adenocarcinoma and Squamous Cell Carcinoma
- 肿瘤防治研究, 2022, 49(1): 24-31
- Cancer Research on Prevention and Treatment, 2022, 49(1): 24-31
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2022.21.0700
- 收稿日期: 2021-06-17
- 修回日期: 2021-08-28
2. 450052 郑州,郑州大学医学科学院
2. School of Medical Sciences, Zhengzhou University, Zhengzhou 450052, China
在世界范围内,肺癌的发病率和致死率居恶性肿瘤前列,其中以肺腺癌、鳞癌为主的非小细胞肺癌是肺癌的主要病理类型,故探索肺腺癌、鳞癌的致癌机制乃至研究防治对策,对提升人民健康水平意义重大[1-2]。近年来靶向治疗和免疫检查点抑制剂治疗在非小细胞肺癌患者身上展现了强大的疗效,与传统化疗相比,显著改善了患者的预后。然而大部分患者仍然存在治疗不敏感和耐药的问题,因此肺腺癌、鳞癌的研究仍需要不断开拓[3]。
恶性肿瘤独特的能量代谢是探索肿瘤致癌机制的重要方面。研究表明肿瘤的异常能量代谢不仅为肿瘤的恶性扩张提供了充分的物质和能量,同时也在维持肿瘤细胞存活、抵抗压力应激环境、逃逸免疫抑制乃至局部浸润和远处转移中发挥重要作用[4-5],而代谢途径中重要蛋白则是控制肿瘤代谢活动的关键。溶质运载蛋白16A家族(solute carriers 16A, SLC16A),又称为单羧酸转运蛋白家族,主要介导乳酸、短链脂肪酸等单羧酸物质的跨膜转运,其异常改变在多种肿瘤的恶性进展中发挥重要作用,有望成为肿瘤治疗的新靶点[6-7]。然而,在肺腺癌、鳞癌中,SLC16A家族研究较少。本研究探索了SLC16A家族14名成员蛋白在肺腺癌、鳞癌中的表达,及其临床特征、生物学行为的联系,并尝试建立依据该家族成员的评分用于肺腺癌、鳞癌的临床评估,从而为探索肺腺癌、鳞癌恶性机制以及寻找新的防治策略提供一定帮助。
1 资料与方法 1.1 资料TCGA数据库提供了肺腺癌、鳞癌的基因表达谱和临床信息。通过进一步整理,将58对肺腺癌和正常组织、51对肺鳞癌和正常组织用于分析SLC16A家族基因表达情况;402例肺腺癌及358肺鳞癌具有完整生存预后,用于生存影响评估的初步分析;515例肺腺癌、501例肺鳞癌组织中分别随机选择70例用于层次聚类和神经网络可视化分析;515例肺腺癌、501例肺鳞癌组织用于基因相关分析及通过主成分分析建立Score-SLC16As;评分前后50位用于基因富集分析及免疫微环境分析;58对肺腺癌和正常组织、51对肺鳞癌和正常组织用于评分ROC诊断评定;253例肺腺癌、288例肺鳞癌具有完整年龄、性别、TNM参数及临床分期的数据用于临床病理参数评估、评分生存曲线展示及独立危险因素分析。
1.2 研究方法 1.2.1 肺腺癌、鳞癌中SLC16A家族评分系统的构建方法首先分别分析SLC16A家族各成员在肺腺癌、鳞癌中的表达特征和临床意义;随后使用随机数分别在肺腺癌、鳞癌中选择70个病例,通过层次聚类-神经网络的方式分析SLC16A家族在肺腺癌、鳞癌中的分布;接着在肺腺癌、鳞癌中分别评估SLC16A家族成员之间的关系;最后通过主成分分析分别建立肺腺癌、鳞癌各自的SLC16A家族的综合评分(Score-SLC16As)。
1.2.2 肺腺癌、鳞癌中SLC16A家族评分系统临床意义评估首先通过ROC分析肺腺癌、鳞癌中Score-SLC16As的诊断意义;接着使用中位数为截断值分别定义肺腺癌、鳞癌中Score-SLC16As高组和低组,并使用Kaplan-Meier曲线及Log rank检验分析Score-SLC16As和肺腺癌、鳞癌总生存期(overall survival, OS)、无进展生存期(progression free survival, PFS)的关系;最后使用多因素Cox回归分析Score-SLC16As对肺腺癌、鳞癌OS、PFS的独立预测功能。
1.2.3 肺腺癌、鳞癌中SLC16A家族评分系统生物学意义探究分别选择Score-SLC16As评分前后50例的肺腺癌、鳞癌,并使用DESeq2进行差异基因分析,继而基于KEGG/Reactome/Hallmark数据库进行生物富集分析;分别选择Score-SLC16As评分前后50例的肺腺癌、鳞癌,定义高低评分组,继而基于Cibersort分析22类常见肿瘤微环境细胞以及经典15种免疫检查点和Score-SLC16As高低组之间关系。
1.3 统计学方法Z分数用于转录数据的进一步标准化,Wilcoxon符号秩和检验用于两组基因表达分析及细胞含量分析;单因素Logistic回归用于TNM临床分期等评估;Kaplan-Meier曲线用于展示基因高低表达和生存概率的关系,Log rank检验用于统计学检验;单、多因素Cox回归模型用于独立危险因子的筛选;Pearson相关分析用于相关性矩阵建立;层次聚类、神经网络可视化用于数据划分聚类;主成分分析用于数据降维及Score-SLC16As评分建立;DESeq2用于差异基因分析;ROC用于诊断分析;GSEA用于富集分析;Cibersort用于免疫细胞评估。P < 0.05(双侧)为差异有统计学意义。通过R语言进行统计分析及图形绘制。
2 结果 2.1 肺腺癌、鳞癌中SLC16A家族的表达特点肺腺癌、鳞癌中,绝大部分SLC16A家族成员在癌和正常组织中呈现差异表达(肺腺癌:12/14,P < 0.05;肺鳞癌:14/14,P < 0.05)。与正常组织相比,肺腺癌组织中7个高表达(SLC16A1, SLC16A3, SLC16A7, SLC16A8, SLC16A9, SLC16A13, SLC16A14),5个低表达(SLC16A5, SLC16A6, SLC16A10, SLC16A11, SLC16A12);与正常组织相比,肺鳞癌组织中6个高表达(SLC16A1, SLC16A3, SLC16A8, SLC16A9, SLC16A13, SLC16A14),8个低表达(SLC16A2, SLC16A4, SLC16A5, SLC16A6, SLC16A7, SLC16A10, SLC16A11, SLC16A12)。肺腺癌、鳞癌中SLC16A家族成员表达并不完全一致,见图 1。
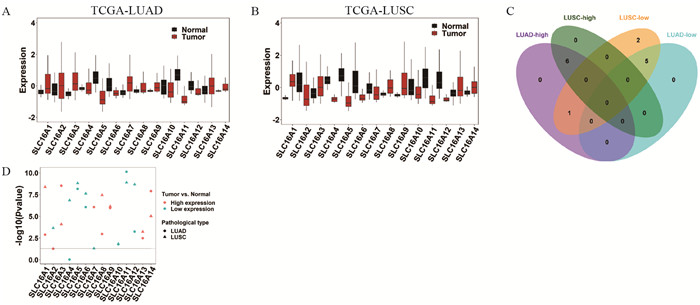
|
| SLC16A: solute carriers 16A; LUAD: lung adenocarcinoma; LUSC: lung squamous cell carcinoma; A-B: expression characteristics of SLC16A family in LUAD and LUSC; C: venn diagram of SLC16A family differentially expressed in LUAD and LUSC; D: scatter plots of SLC16A family differentially expressed in LUAD and LUSC. 图 1 SLC16A家族在肺腺癌、鳞癌中的表达特点 Figure 1 Expression characteristics of SLC16A family in lung adenocarcinoma and squamous cell carcinoma |
OS、PFS是衡量肿瘤预后的重要指标。依据单因素Cox回归法分别评估上述SLC16A家族成员在肺腺癌、鳞癌中与OS及PFS的关系。统计学分析表明:肺腺癌中4个基因(SLC16A1, SLC16A3, SLC16A9, SLC16A14)与OS相关,5个基因(SLC16A1, SLC16A3, SLC16A4, SLC16A13, SLC16A14)与PFS相关;肺鳞癌中4个基因(SLC16A3, SLC16A4, SLC16A7, SLC16A12)与OS相关,2个基因(SLC16A3, SLC16A4)与PFS相关。肺腺癌、鳞癌中SLC16A家族成员对预后的影响存在差异,见图 2。
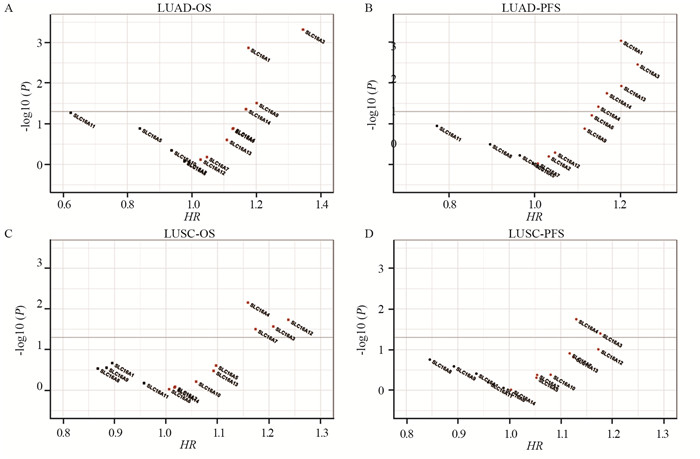
|
| OS: overall survival; PFS: progression free survival. 图 2 SLC16A家族对肺腺癌、鳞癌的OS、PFS的影响 Figure 2 Influence of SLC16A family on OS and PFS of lung adenocarcinoma and squamous cell carcinoma patients |
TNM分期分别反映肿瘤大小、淋巴结转移及远处转移情况,是肿瘤重要的临床参数,也是肿瘤临床分期重要的依据。根据单因素Logistic回归法分析肺腺癌、鳞癌中SLC16A家族成员和TNM分期及临床分期参数的关系,见表 1~2。
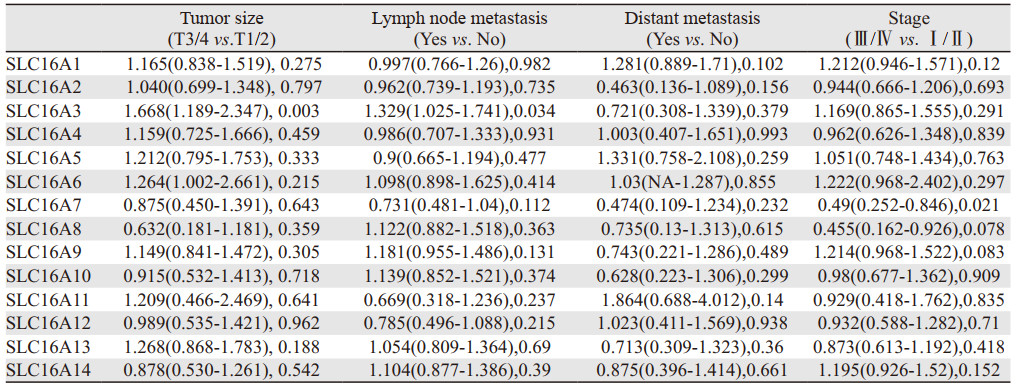
|
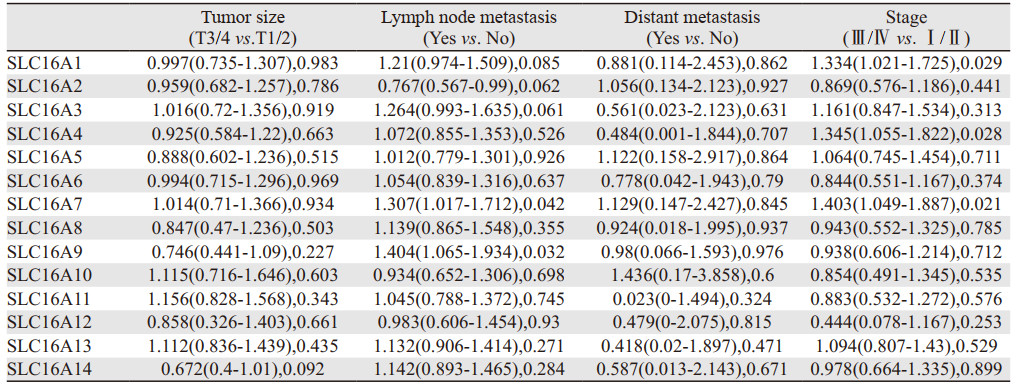
|
成功构建SLC16A家族评分系统(Score-SLC16As)。Score-SLC16As主成分选择累计方差贡献 > 70%,即8个主成分(Comp),依据各基因系数(Coef)及主成分方差(S2)占比计算Score-SLC16As,Score-SLC16As=∑(Compj*Sj2/∑Sj2),Comp=∑Genei*Coefi,见图 3。
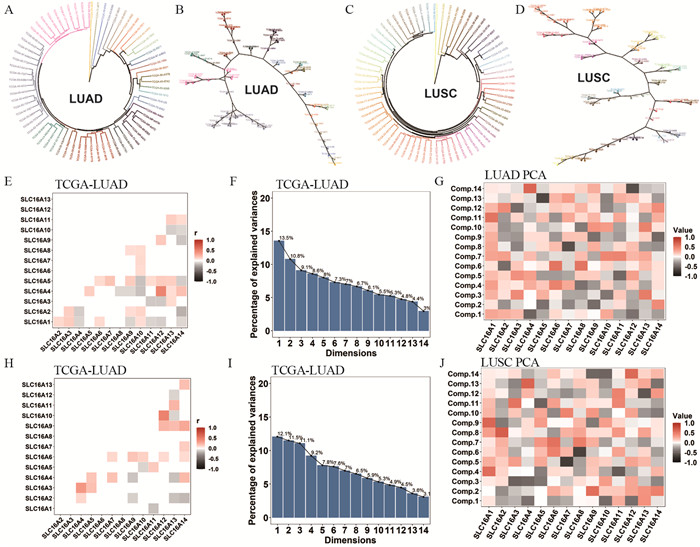
|
| A, C: SLC16A family clustering in LUAD and LUSC; B, D: neural networks of SLC16A family clustering in LUAD and LUSC; E, H: correlation matrices of SLC16A family in LUAD and LUSC; F, I: variance contributions of principal components for Score-SLC16As in LUAD and LUSC; G, J: heat maps of gene coefficients constituting principal components for Score-SLC16As in LUAD and LUSC. 图 3 肺腺癌、鳞癌中Score-SLC16As的建立 Figure 3 Establishment of Score-SLC16As in lung adenocarcinoma and squamous cell carcinoma |
分析Score-SLC16As在肺腺癌、鳞癌中的临床意义,结果表明肺腺癌Score-SLC16As是其预后的危险因素,而肺鳞癌Score-SLC16As则是其预后的保护因素,这反映了SLC16A家族对肺腺癌、鳞癌的不同作用,以及肺腺癌、鳞癌不同的生物-临床特征,见图 4。
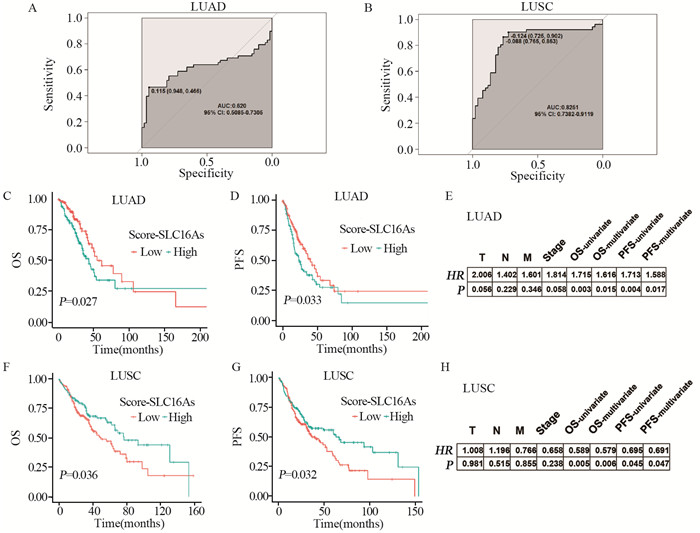
|
| A-B: Diagnostic efficacies of Score-SLC16As in LUAD and LUSC; C-F: Relation between Score-SLC16As and OS of LUAD and LUSC; D-G: Relation between Score-SLC16As and PFS of LUAD and LUSC; E-H: Associations between Score-SLC16As and TNM, Clinical stage, OS, PFS in LUAD and LUSC (univariate and multivariate analyses). 图 4 肺腺癌、鳞癌中Score-SLC16As临床意义评估 Figure 4 Clinical significance of Score-SLC16As in lung adenocarcinoma and squamous cell carcinoma |
通过GSEA分析评估了Score-SLC16As背后的生物学意义,结果发现Score-SLC16As和肿瘤恶性增殖相关生物学行为有关,值得注意的是,肺鳞癌中Score-SLC16As和移植免疫排斥相关通路有关,而肺腺癌中则不明显,体现了肺腺癌、鳞癌Score-SLC16As生物学意义的不同,见图 5。
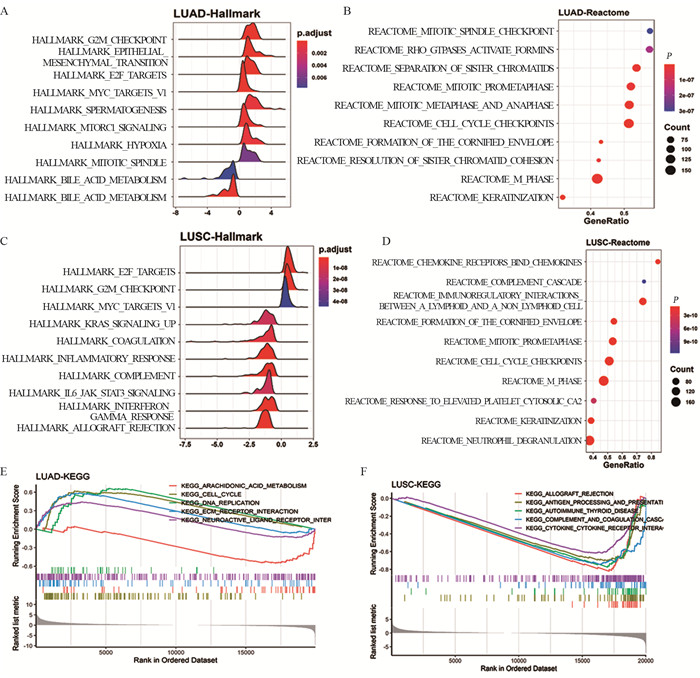
|
| A, C: Hallmark; B, D: Reactome database; E, F: KEGG database. 图 5 肺腺癌、鳞癌中Score-SLC16As生物学意义评估 Figure 5 Biological significance of Score-SLC16As in lung adenocarcinoma and squamous cell carcinoma |
进一步分析发现,Score-SLC16As和肿瘤微环境细胞及免疫检查点明显相关,然而肺腺癌、鳞癌中Score-SLC16As背后的肿瘤免疫联系却大不相同,肺腺癌高Score-SLC16As组中免疫检查点高表达,与T淋巴细胞相关,而肺腺癌高Score-SLC16As组中免疫检查点则低表达和B淋巴细胞相关,体现了肺腺癌、鳞癌Score-SLC16As不同的免疫微环境影响,见图 6。
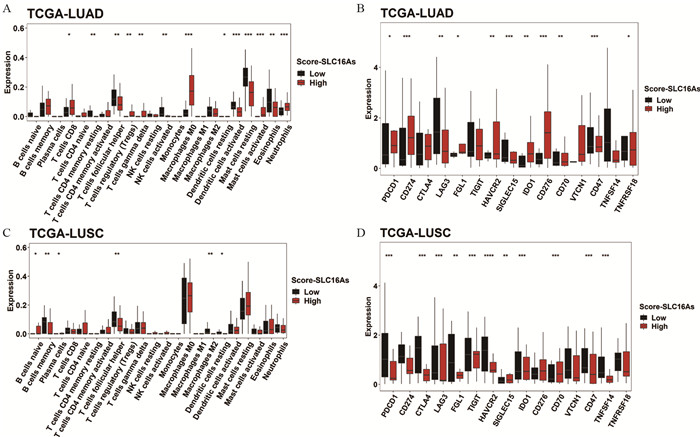
|
| A, C: cells; B, D: immune checkpoints. 图 6 肺腺癌、鳞癌中Score-SLC16As对免疫微环境的影响 Figure 6 Effect of Score-SLC16As on immune microenvironment in lung adenocarcinoma and squamous cell carcinoma |
肺癌的发病率和死亡率居肿瘤前列,而以肺腺癌、鳞癌为主要组成的非小细胞肺癌是肺癌的主要亚型,其临床防治一直备受关注[8-9]。然而,大部分非小细胞肺癌发现时已处于晚期,预后相对较差[10]。肿瘤致癌机制的突破带来了非小细胞肺癌尤其是晚期非小细胞肺癌治疗的显著提升。如针对表皮生长因子受体(epidermal growth factor receptor, EGFR)及间变性淋巴瘤激酶(ALK)等驱动突变的分子靶向治疗在相应突变患者中取得了较好的疗效,相比于晚期肿瘤经典的含铂双药化疗,靶向治疗显著改善了患者的预后[11-12]。而以程序性死亡配体1(programmed death ligand-1, PD-L1)和程序性死亡蛋白1(programmed death 1, PD-1)抗体为代表的免疫抑制剂治疗也在特定免疫背景的非小细胞肺癌群体中展现了良好的治疗效果[13-14]。然而大部分患者对靶向治疗或免疫治疗不敏感,以及常见的耐药现象都迫使肺腺癌、鳞癌的致癌机制需要深入研究,新的防治策略急需挖掘。
肿瘤异常的能量代谢特征是其核心特点之一,和其发生发展存在紧密联系。一方面肿瘤需要快速合成大量物质能量以满足其恶性扩张的需求,另一方面肿瘤也需要灵活的代谢策略应对各种压力应激[15]。其中异常的糖代谢是肿瘤较为普遍的代谢特征。多项研究表明,肿瘤即使在氧气充足的条件下,也倾向于糖酵解的代谢模式,从而为不断复制合成的需求提供大量原料[16]。如糖酵解途径衍生出的磷酸戊糖途径(pentose phosphate pathway, PPP)提供了大量的还原当量NADPH用于物质合成,而中间产物3磷酸甘油(3-phosphoglycerate, 3-PG)则为丝氨酸等一碳单位的合成提供了原料,同时糖酵解中的其他中间产物也为脂质和氨基酸的合成提供了骨架。值得注意的是,糖酵解大量产生的乳酸在肿瘤恶性进展中发挥重要作用。乳酸为肿瘤浸润转移乃至免疫逃逸提供了适应的酸性微环境,近年来研究表明乳酸可以成为肿瘤的主要营养来源,在特定条件下,甚至超过了葡萄糖[17]。因此,靶向肿瘤糖代谢乃至乳酸代谢是肿瘤治疗研究的重要方向,而代谢途径中的关键蛋白则是主要突破口。
SLC16A家族是介导以乳酸为主的单羧酸物质跨膜运输的重要蛋白家族,其功能异常和恶性肿瘤的发生发展密切相关[18]。一方面SLC16A家族成员可以促进单羧酸的排出,从而营造酸性微环境,促进肿瘤浸润和免疫逃逸,也间接减少了单羧酸的胞内蓄积,促进糖酵解的运转。另一方面SLC16A家族也在特定条件下促进单羧酸的吸收,从而为特定肿瘤提供物质原料以及促血管生成的信号。而SLC16A家族不同成员在不同类型的肿瘤中分布和作用不同[7, 18]:如SLC16A1在乳腺癌等多种恶性肿瘤中高表达,却在前列腺癌中低表达;SLC16A4在非小细胞肺癌等肿瘤中高表达,却在Burkitt淋巴瘤和弥漫性大B细胞淋巴瘤中低表达。在食管癌中,SLC16A1的低表达预示着较差的肿瘤分期和较高的转移风险,而SLC16A4的高表达却与高转移风险有关。这些结果提示SLC16A家族和恶性肿瘤的临床特征存在密切联系,但不同肿瘤、不同SLC16A家族成员却需要深入研究细致区分。在肺腺癌、鳞癌中,多种研究表明乳酸等单羧酸代谢发挥重要作用,然而介导单羧酸转运的SLC16A家族在肺腺癌、鳞癌中研究较少,其功能和临床联系亟需阐明。
本研究发现SLC16A家族大部分成员在肺腺癌、鳞癌中呈现差异表达,且和生存概率存在明显联系,基于SLC16A家族建立的Score-SLC16As能够明显诊断肺腺癌、鳞癌,且明显预测生存预后,与肿瘤恶性增殖以及免疫微环境有关,而肺腺癌、鳞癌的Score-SLC16As存在临床特征和生物学意义的差异。这为理解肺腺癌、鳞癌致癌机制乃至发掘新的临床策略提供一定启示。
本研究发现肺腺癌的Score-SLC16As和其预后呈现明显的负相关,而肺鳞癌的Score-SLC16As则和其预后呈现明显的正相关,这反映出肺腺癌、鳞癌不同的临床特征。进一步深入分析发现,肺腺癌的Score-SLC16As和恶性增殖、T细胞免疫及免疫检查点高表达有关,而肺鳞癌的Score-SLC16As则和恶性增殖、B细胞免疫及免疫检查点低表达有关,这种生物学行为上的差异可能部分解释了两种肺癌亚型中Score-SLC16As临床意义的差异。Score-SLC16As能否作为肺腺癌、鳞癌致癌机制的研究方向,尤其是二者不同致癌机制的研究突破口?Score-SLC16As和肺腺癌、鳞癌免疫逃逸及免疫治疗的关系如何?这都值得我们深入研究。
作者贡献:
岳竞:课题设计、数据分析、论文撰写
康静:课题指导、方案规划、论文审阅及修订
李国印:图表制作、经费支持、论文指导与修改
| [1] |
Sung H, Ferlay J, Siegel RL, et al. Global Cancer Statistics 2020: GLOBOCAN Estimates of Incidence and Mortality Worldwide for 36 Cancers in 185 Countries[J]. CA Cancer J Clin, 2021, 71(3): 209-249. DOI:10.3322/caac.21660 |
| [2] |
Duma N, Santana-Davila R, Molina JR. Non-Small Cell Lung Cancer: Epidemiology, Screening, Diagnosis and Treatment[J]. Mayo Clin Proc, 2019, 94(8): 1623-1640. DOI:10.1016/j.mayocp.2019.01.013 |
| [3] |
Bersani F, Morena D, Picca F, et al. Future perspectives from lung cancer pre-clinical models: new treatments are coming?[J]. Transl Lung Cancer Res, 2020, 9(6): 2629-2644. DOI:10.21037/tlcr-20-189 |
| [4] |
Faubert B, Solmonson A, DeBerardinis RJ. Metabolic reprogramming and cancer progression[J]. Science, 2020, 368(6487): eaaw5473. DOI:10.1126/science.aaw5473 |
| [5] |
Kim J, DeBerardinis RJ. Mechanisms and Implications of Metabolic Heterogeneity in Cancer[J]. Cell Metab, 2019, 30(3): 434-446. DOI:10.1016/j.cmet.2019.08.013 |
| [6] |
Kuo TC, Huang KY, Yang SC, et al. Monocarboxylate Transporter 4 Is a Therapeutic Target in Non-small Cell Lung Cancer with Aerobic Glycolysis Preference[J]. Mol Ther Oncolytics, 2020, 18: 189-201. DOI:10.1016/j.omto.2020.06.012 |
| [7] |
Felmlee MA, Jones RS, Rodriguez-Cruz V, et al. Monocarboxylate Transporters (SLC16): Function, Regulation, and Role in Health and Disease[J]. Pharmacol Rev, 2020, 72(2): 466-485. DOI:10.1124/pr.119.018762 |
| [8] |
Siegel RL, Miller KD, Jemal A. Cancer statistics, 2019[J]. CA Cancer J Clin, 2019, 69(1): 7-34. DOI:10.3322/caac.21551 |
| [9] |
Feng RM, Zong YN, Cao SM, et al. Current cancer situation in China: good or bad news from the 2018 Global Cancer Statistics?[J]. Cancer Commun (Lond), 2019, 39(1): 22. DOI:10.1186/s40880-019-0368-6 |
| [10] |
Chen R, Manochakian R, James L, et al. Emerging therapeutic agents for advanced non-small cell lung cancer[J]. J Hematol Oncol, 2020, 13(1): 58. DOI:10.1186/s13045-020-00881-7 |
| [11] |
Doval DC, Desai CJ, Sahoo TP. Molecularly targeted therapies in non-small cell lung cancer: The evolving role of tyrosine kinase inhibitors[J]. Indian J Cancer, 2019, 56(Supplement): S23-S30. |
| [12] |
Kauffmann-Guerrero D, Kahnert K, Huber RM. Treatment Sequencing for Anaplastic Lymphoma Kinase-Rearranged Non-Small-Cell Lung Cancer[J]. Drugs, 2021, 81(1): 87-100. DOI:10.1007/s40265-020-01445-2 |
| [13] |
Remon J, Passiglia F, Ahn MJ, et al. Immune Checkpoint Inhibitors in Thoracic Malignancies: Review of the Existing Evidence by an IASLC Expert Panel and Recommendations[J]. J Thorac Oncol, 2020, 15(6): 914-947. DOI:10.1016/j.jtho.2020.03.006 |
| [14] |
Akinleye A, Rasool Z. Immune checkpoint inhibitors of PD-L1 as cancer therapeutics[J]. J Hematol Oncol, 2019, 12(1): 92. DOI:10.1186/s13045-019-0779-5 |
| [15] |
Bergers G, Fendt SM. The metabolism of cancer cells during metastasis[J]. Nat Rev Cancer, 2021, 21(3): 162-180. |
| [16] |
Fendt SM, Frezza C, Erez A. Targeting Metabolic Plasticity and Flexibility Dynamics for Cancer Therapy[J]. Cancer Discov, 2020, 10(12): 1797-1807. DOI:10.1158/2159-8290.CD-20-0844 |
| [17] |
Certo M, Tsai CH, Pucino V, et al. Lactate modulation of immune responses in inflammatory versus tumour microenvironments[J]. Nat Rev Immunol, 2021, 21(3): 151-161. |
| [18] |
Bosshart PD, Charles RP, Garibsingh RA, et al. SLC16 Family: From Atomic Structure to Human Disease[J]. Trends Biochem Sci, 2021, 46(1): 28-40. DOI:10.1016/j.tibs.2020.07.005 |
 2022, Vol. 49
2022, Vol. 49


