文章信息
- 弥漫性恶性腹膜间皮瘤伴副肿瘤综合征1例报道及文献复习
- Diffuse Malignant Peritoneal Mesothelioma with Paraneoplastic Syndrome: A Case Report and Literature Review
- 肿瘤防治研究, 2022, 49(3): 246-250
- Cancer Research on Prevention and Treatment, 2022, 49(3): 246-250
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2022.21.0445
- 收稿日期: 2021-04-19
- 修回日期: 2021-11-19
2. 100038 北京,首都医科大学附属北京世纪坛医院病理科
2. Department of Pathology, Beijing Shijitan Hospital, Capital Medical University, Beijing 100038, China
弥漫性恶性腹膜间皮瘤(diffuse malignant peritoneal mesothelioma, DMPM)是一种原发于腹膜间皮细胞的罕见高度恶性肿瘤,其发病率为(1~2)/106,占所有间皮瘤的7%~20%[1-3]。其临床表现多样,症状无特异性。最常见的症状为腹痛和腹胀,其他症状包括体重减轻、腹壁疝、腹部肿块或厌食等,侵袭性较强的间皮瘤亚型亦可表现为快速进展性腹胀和肠梗阻[4]。此外,极少数患者在疾病进展过程中会出现多种副肿瘤综合征(paraneoplastic syndrome, PS),此类患者往往临床一般情况较差,诊疗困难。
本文回顾性分析本中心收治的1例发生DMPM相关性PS患者的临床病理特征,探讨其治疗要点,为该类患者的诊疗提供经验。
1 临床资料 1.1 病例资料患者女,31岁,主因“腹胀、腹痛5月,腹腔镜探查活检诊断恶性腹膜间皮瘤2月余”入院。2019年7月无明显诱因出现腹胀、腹痛,于当地医院行CT检查,结果提示胃窦部胃壁不规则增厚、强化,周围见多发增大淋巴结,考虑胃窦占位。胃镜检查提示慢性萎缩性胃炎(C-1)。PET-CT提示:(1)前下纵隔、胃窦周围、肝门区、腹膜后、盆腔多发淋巴结伴糖代谢增高,考虑转移;(2)腹膜多发结节状、片状、不规则状糖代谢增高影,考虑转移,腹盆腔大量积液;(3)胃窦处胃壁增厚,伴糖代谢增高,并与周围结构分界不清,考虑恶性;(4)双附件区混杂低密度影,伴糖代谢增高,考虑转移;(5)甲状腺双侧叶多发低密度灶。2019年9月20日在当地医院全麻下行腹腔镜检查+取材活检,并置入腹腔热灌注化疗管,术后病理回报:(腹膜肿物)免疫组织化学支持为间皮源性肿物,倾向恶性间皮瘤,给予腹腔热灌注化疗3次,其中2次加用顺铂(具体方案不详)。2019年10月22日转诊我院门诊,给予每日口服阿帕替尼250 mg治疗30天,因患者不耐受,为进一步手术治疗停药。2019年12月4日为行手术治疗住院。自发病以来体重下降约15 kg。无石棉接触史、无肿瘤家族史。查体:体温36.5℃,脉搏116次/分,呼吸16次/分,血压122/96 mmHg,KPS评分80分。腹部膨隆,可见陈旧性腹腔镜手术瘢痕孔,腹围71 cm,移动性浊音阳性。
实验室检查:肿瘤标志物CA125 869.7 u/ml,血红蛋白71 g/L,血小板863×109/L,白蛋白18.1 g/L,钠134 mmol/L,尿潜血+++,尿蛋白+++,肝功能、肾功能、心肌酶等未见明显异常。
腹盆腔增强CT:胃腔及胰头周围、肝门、横膈水平、肠系膜见多发大小不等软组织密度肿块及结节,增强扫描可见中度强化,最大者直径约3 cm,见图 1A。大网膜增厚,见图 1B。腹腔见少量水样密度影,双肾未见明显异常强化灶,结肠内容物多,部分节段收缩状态,部分小肠略增宽,子宫形态可,增强扫描可见不均匀明显强化,盆腔可见大量液性密度影,见图 1C。胰头、胃窦受压,腹腔干及分支与较大肿块关系密切,腹膜后见多发小淋巴结,见图 1D,肠系膜脂肪间隙呈结节索条状改变。
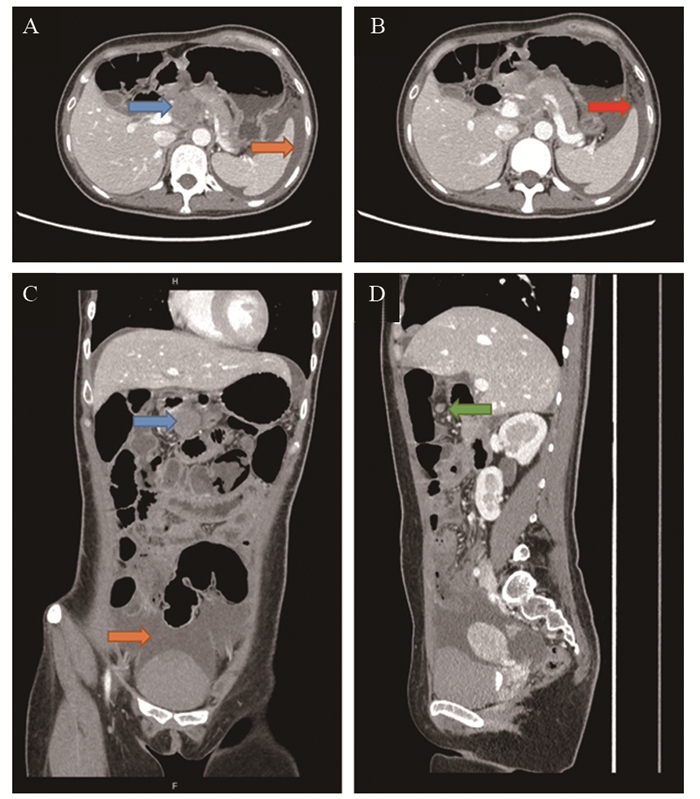
|
| A: fluid density shadow around the spleen (orange arrow), gastric antrum mass, about 3 cm in diameter (blue arrow); B: fat turbidity of the greater omentum; C: gastric antrum mass, pelvic fluid density shadow (coronal); D: retroperitoneal enlarged lymph nodes (sagittal). 图 1 本例患者术前增强CT影像 Figure 1 Preoperative enhanced CT images |
该病例初步诊断:恶性腹膜间皮瘤,恶性腹腔积液,肾病综合征,血小板增多,中度贫血。
给患者予以白蛋白补充、输血等对症治疗后,贫血及低蛋白血症较前改善,但血色素反复下降,进一步检查发现直接Coombs试验阳性,CH50、IgG、C3、铁蛋白、叶酸、VitB12明显升高,而铁、总铁结合力、网织红细胞下降,患者曾于外院行骨髓穿刺提示增生性贫血骨髓象伴铁利用障碍,结合尿蛋白+++,尿潜血+++,考虑患者可能发生DMPM相关性膜性肾病,并可能存在Coombs试验阳性溶血性贫血。经腹膜癌综合诊疗专家团队讨论,积极给予患者对症支持治疗同时,应争取尽早行规范化肿瘤细胞减灭术(cytoreductive surgery, CRS)+腹腔热灌注化疗(hyperthermic intrapertoneal chemotherapy, HIPEC)治疗,降低肿瘤负荷,改善临床症状,延长生存期。
2020年1月6日在我院全麻下行CRS+HIPEC术,腹腔内可见大量淡黄色清亮腹水溢出,总量约7 000 ml,大网膜、双侧膈肌腹膜、肝圆韧带、小网膜、脾门、两侧结肠旁沟、直肠前壁、膀胱后壁、子宫及双附件表面、阑尾及系膜、小肠及肠系膜表面、结肠及系膜表面可见大量粟粒样肿瘤结节,术中PCI评分13分。行肠粘连松解后,依次切除肝圆韧带、大网膜、右侧壁腹膜、后腹膜、阑尾、膀胱子宫陷凹腹膜、直肠子宫陷凹腹膜、小网膜、肝十二指肠韧带肿瘤、幽门后壁肿瘤、双侧膈肌腹膜、小肠及结肠系膜病损,术后CC评分0分。同时术中给予多西他赛120 mg+顺铂120 mg腹腔热灌注化疗。于左侧腹壁置入腹腔化疗泵,核查关腹。
术后病理:肿瘤细胞呈上皮样,胞质嗜酸,胞核呈空泡状,可见核仁,结合免疫组织化学结果,符合上皮样恶性间皮瘤(低级别),见图 2A,累及腹腔多处脏器,间质大量淋巴细胞浸润,未见脉管瘤栓及神经侵犯,胃十二指肠韧带可见淋巴结转移,胃小弯及脾门淋巴结未见转移(0/3);免疫组织化学:CK(+),Vim(+),CK5(+),Calretinin(+),见图 2B,WT-1(+),见图 2C,MC(+),D2-40(+),见图 2D,CD10(-),CEA(+),Ki-67(index 20%),P53(10%+),PD-L1(SP142)(TC-,IC5%+),PD1(UAMB199)(淋巴细胞30%+),CD4(淋巴细胞+),CD8(淋巴细胞+),CD68(组织细胞80%+),CD163(巨噬细胞+),CD31(血管+),VEGF(+)。
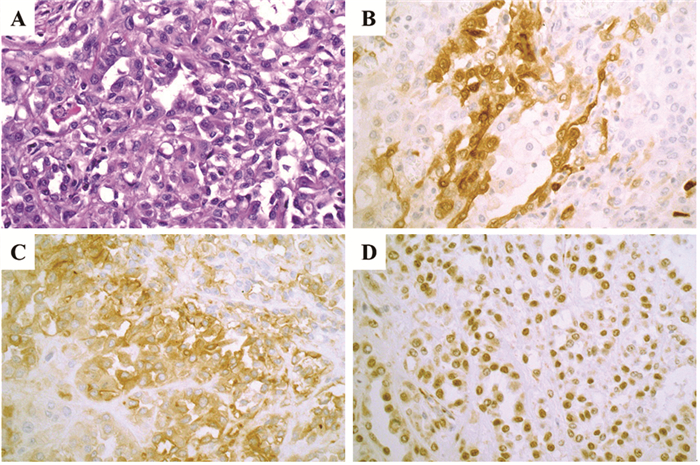
|
| A: tumor cells were epithelioid eosinophilic cytoplasm and vacuolated nuclei, nucleoli could be seen; B: Calretinin (+); C: D2-40 (+); D: WT-1 (+). 图 2 术后常规HE及免疫组织化学染色病理图片(× 400) Figure 2 Routine pathological images of postoperative HE and immunohistochemical staining (×400) |
2020年2月10日起,患者每日下午出现低热,体温最高达37.8℃,不伴咳嗽、咳痰、恶心、腹胀等不适,完善相关检查未见感染因素,考虑为肿瘤性发热(neoplastic fever)。2020年3月19日查血红蛋白48 g/L,白蛋白19.9 g/L,尿蛋白+++,尿潜血+++,肿瘤标志物CA125 832.3 U/ml,对症支持治疗后血红蛋白、白蛋白水平好转,2020年4月2日行第1周期术后辅助化疗:培美曲塞300 mg+卡铂200 mg静脉注射d1,培美曲塞200 mg+卡铂100 mg腹腔注射d1,每21天一次;化疗后出现Ⅳ度骨髓抑制,考虑患者不能耐受化疗,后续拟行PD-1治疗。2020年5月3日入院检查示重度贫血、低蛋白血症,对症支持治疗后,行卡瑞利珠单抗200 mg静脉注射治疗,2020年5月19日、2020年6月18日行卡瑞利珠单抗150 mg静脉注射治疗。2020年7月4日无明显诱因发作抽搐两次,无意识丧失,急诊完善头颅CT、MRI检查后,未见明显异常,实验室检查示T3、T4下降,考虑甲状腺功能低下,给予优甲乐每日50 μg治疗,再未出现抽搐症状,但持续有四肢无力、发抖、舌头麻木。2020年7月29日入院检查示重度贫血及低蛋白血症,给予对症治疗,未见明显好转,行腹部CT提示肿瘤较前进展,返回当地医院行支持治疗。患者在我院就诊期间,血小板计数、白蛋白及血红蛋白水平变化情况,见图 3。

|
| CRS: cytoreductive surgery; HIPEC: hyperthermic intraperitoneal chemotherapy 图 3 血小板计数(A)、白蛋白水平(B)和血红蛋白水平(C)变化曲线 Figure 3 Curves of platelet count(A), albumin level(B) and hemoglobin level(C) |
回顾病程,患者自确诊DMPM以来,即出现以肾病综合征为主的多种副肿瘤综合征,导致一般情况差。本中心在给予积极对症支持治疗改善患者一般状态的同时,及时进行了以CRS+HIPEC为主的综合治疗,包括术后培美曲塞+卡铂的静脉联合腹腔化疗及卡瑞利珠单抗免疫治疗。但患者最终因一般状态差,疾病持续进展,2020年10月2日病逝。自发病以来,总生存期(overall survival, OS)为15月,行CRS+HIPEC后为10月。
2 讨论副肿瘤综合征是指在肿瘤发生发展过程中出现的非肿瘤直接侵袭、压迫引起的一系列临床症状。目前认为,发生PS的主要原因有,肿瘤分泌功能肽和激素(如内分泌副肿瘤综合征)或肿瘤和正常宿主组织之间的免疫交叉反应(如神经系统副肿瘤综合征)[5]。腹膜间皮瘤相关性PS极为罕见,文献检索仅有部分病例报道,但可累及全身各个系统:(1)血液系统:自身免疫性溶血性贫血,粒细胞集落刺激因子和白细胞介素-6增多,血小板增多,恶性肿瘤相关性血栓形成,复发性血栓性血小板减少性紫癜样综合征,类白血病反应;(2)风湿系统:淀粉样变性,抗磷脂综合征,风湿性多肌样痛综合征;(3)内分泌系统:低血糖,异位促肾上腺皮质激素分泌综合征;(4)皮肤系统:皮肌炎;(5)神经系统:重症肌无力;(6)泌尿系统:肾病综合征;(7)其他:副肿瘤性肝病、消瘦综合征,持续性发热,见表 1。
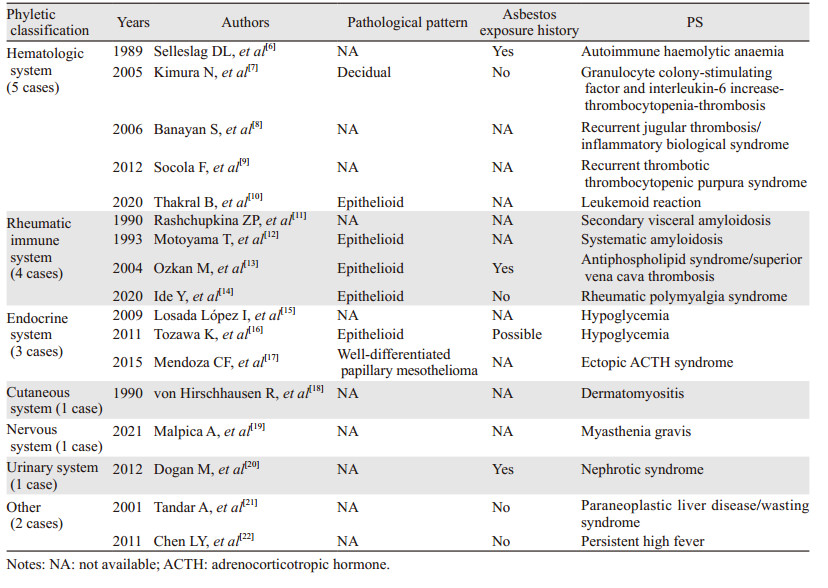
|
其中本例患者为上皮样型恶性腹膜间皮瘤,所涉及的有血小板增多、肾病综合征、可疑性自身免疫溶血性贫血及发热等,分析如下。
血小板增多是常见的血液学副肿瘤综合征之一,据报道,约35%的血小板增多(> 400×109/L)者患有恶性肿瘤,血清IL-6增多、JAK2 V617F突变多提示血小板增多与恶性肿瘤相关[5]。另有文献报道,术前血小板增多是MPM的独立预后危险因素[23]。本例患者初次就诊我院时查血小板818.0×109/L,行手术治疗后病理确诊为恶性腹膜间皮瘤。回顾性分析患者血小板变化曲线,每次行抗肿瘤治疗后血小板均下降,提示其血小板增多与肿瘤密切相关。
肾病综合征(nephrotic syndrome, NS)是以大量蛋白尿、低蛋白血症、高脂血症、水肿为特征表现的一组临床症候群,可由多种病因引起。其中白蛋白 < 30 g/L,尿蛋白定量 > 3.5 g/24 h为诊断所必需。副肿瘤性NS的诊断可参考以下标准:(1)无肾病综合征其他病因证据;(2)NS诊断与癌症的时间关系(如果肾病性蛋白尿在诊断为恶性肿瘤前或后6月内发生,则提示二者有因果关系);(3)肿瘤治疗可减少肾脏症状;(4)肿瘤复发与肾脏症状和蛋白尿增加相关[20]。该患者在我院就诊期间,低蛋白血症明显,尿蛋白定量6.91 g/d,肾病综合征诊断明确,完善其他检查示抗核抗体、抗ENA抗体、抗中性粒细胞胞质抗体、免疫蛋白电泳阴性,乙肝病毒、HIV等阴性,故考虑患者NS为副肿瘤性。此外,患者持续存在中至重度贫血,完善血液学相关检查发现直接Coombs试验阳性,与2016年Selleslag等[6]报道的1例DMPM相关性Coombs试验阳性自身免疫性溶血性贫血(Autoimmune haemolytic anaemia, AIHI)患者检查结果相比,未发现胆红素升高等其他溶血证据。结合患者尿常规示尿潜血+++,显微镜下见大量不均一性红细胞,考虑该患者发生交叉免疫性肾损伤,大量红细胞从肾脏丢失是其持续慢性中至重度贫血的主要原因。
肿瘤性发热是一种排除性诊断,多表现为皮肤潮红、发汗和低热,少有寒战、心动过速、精神异常等症状,萘普生试验或有助于其与感染性发热等的鉴别。此外,张等的一项Meta分析指出,萘普生在改善疑似肿瘤发热和不明原因发热症状方面效果良好。早期使用萘普生可能减轻癌症患者的痛苦,提高他们的生活质量[24-25]。本例患者2020年2月10日起,每日下午出现低热,体温最高达37.8℃,不伴其他特殊症状,查体无明显阳性体征,各项实验室指标未提示感染因素,可自行或给予冰袋物理降温后好转,考虑为肿瘤性发热。
此外,该患者病情期间出现抽搐、四肢无力、发抖、舌头麻木等神经系统症状,但实验室检查示甲状腺功能低下,神经系统各项检查未见器质性病变,给予优甲乐治疗后上述症状改善,最终考虑患者甲状腺功能低下与肿瘤进展相关。
由于患者存在上述以肾病综合征、贫血为主的PS,导致其整体状态差,病程期间难以耐受DMPM标准治疗,最终预后不佳,CRS+HIPEC后OS仅10月,显著低于本中心收治的其他DMPM患者。回顾性分析本例患者治疗过程及相关指标变化曲线得出以下结论:(1)CRS+HIPEC后血小板下降明显,并在一定程度上增强了补充白蛋白、输血对症治疗的疗效(排除手术后血液浓缩的影响),提示CRS+HIPEC治疗原发病,降低肿瘤负荷是该病治疗的关键;(2)静脉联合腹腔化疗后患者各项指标较前明显好转,但可能由于PS导致的免疫力下降,化疗后骨髓抑制明显,后续未能继续行化疗;(3)受疾病进展及相关PS的影响,免疫治疗的具体疗效有待进一步研究;(4)对此类患者仅行对症支持治疗效果有限,应及时行以CRS+HIPEC为核心的抗肿瘤相关治疗。
作者贡献:
苏延冬、刘刚:收集资料、论文撰写与修改
杜雪梅:收集资料
李雁:论文撰写与修改
| [1] |
李娜, 陈忠坚, 毛伟敏. 恶性腹膜间皮瘤的诊疗现状及进展[J]. 肿瘤防治研究, 2020, 47(12): 992-995. [Li N, Chen ZJ, Mao WM. Current Status and Progress on Diagnosis and Treatment of Malignant Peritoneal Mesothelioma[J]. Zhong Liu Fang Zhi Yan Jiu, 2020, 47(12): 992-995. DOI:10.3971/j.issn.1000-8578.2020.20.0384] |
| [2] |
Alexander HR Jr, Burke AP. Diagnosis and management of patients with malignant peritoneal mesothelioma[J]. J Gastrointest Oncol, 2016, 7(1): 79-86. |
| [3] |
Li CY, Alexander HR Jr. Peritoneal metastases from malignant mesothelioma[J]. Surg Oncol Clin N Am, 2018, 27(3): 539-549. DOI:10.1016/j.soc.2018.02.010 |
| [4] |
Kusamura S, Kepenekian V, Villeneuve L, et al. Peritoneal mesothelioma: PSOGI/EURACAN clinical practice guidelines for diagnosis, treatment and follow-up[J]. Eur J Surg Oncol, 2021, 47(1): 36-59. DOI:10.1016/j.ejso.2020.02.011 |
| [5] |
Pelosof LC, Gerber DE. Paraneoplastic syndromes: an approach to diagnosis and treatment[J]. Mayo Clin Proc, 2010, 85(9): 838-854. DOI:10.4065/mcp.2010.0099 |
| [6] |
Selleslag DL, Geraghty RJ, Ganesan TS, et al. Autoimmune haemolytic anaemia associated with malignant peritoneal mesothelioma[J]. Acta Clin Belg, 1989, 44(3): 199-201. DOI:10.1080/17843286.1989.11718015 |
| [7] |
Kimura N, Ogasawara T, Asonuma S, et al. Granulocyte-colony stimulating factor- and interleukin 6-producing diffuse deciduoid peritoneal mesothelioma[J]. Mod Pathol, 2005, 18(3): 446-450. DOI:10.1038/modpathol.3800245 |
| [8] |
Banayan S, Hot A, Janier M, et al. Malignant mesothelioma of the peritoneum as the cause of a paraneoplastic syndrome: detection by 18F-FDG PET[J]. Eur J Nucl Med Mol Imaging, 2006, 33(6): 751. DOI:10.1007/s00259-005-0059-1 |
| [9] |
Socola F, Loaiza-Bonilla A, Bustinza-Linares E, et al. Recurrent thrombotic thrombocytopenic purpura-like syndrome as a paraneoplastic phenomenon in malignant peritoneal mesothelioma: a case report and review of the literature[J]. Case Rep Oncol Med, 2012, 2012: 619348. |
| [10] |
Thakral B, Loghavi S. Marked paraneoplastic leukemoid reaction in a patient with mesothelioma mimicking a myeloid neoplasm[J]. Blood, 2020, 135(6): 457. DOI:10.1182/blood.2019003936 |
| [11] |
Rashchupkina ZP, Karmilov VA, Iudina LI, et al. Malignant mesothelioma of the peritoneum with secondary amyloidosis of the internal organs[J]. Klin Med(Mosk), 1990, 68(11): 99-101. |
| [12] |
Motoyama T, Honma T, Watanabe H, et al. Interleukin 6-producing malignant mesothelioma[J]. Virchows Arch B Cell Pathol Ind Mol Pathol, 1993, 64(6): 367-372. |
| [13] |
Ozkan M, Eser B, Er O, et al. Antiphospholipid syndrome associated with malignant mesothelioma presenting with superior vena cava thrombosis: a case report[J]. Clin Appl Thromb Hemost, 2004, 10(4): 393-396. DOI:10.1177/107602960401000413 |
| [14] |
Ide Y, Yuki T, Taooka Y, et al. Malignant Peritoneal Mesothelioma Presenting with Polymyalgia Rheumatica-like Syndrome[J]. Intern Med, 2020, 59(20): 2629-2632. DOI:10.2169/internalmedicine.4809-20 |
| [15] |
Losada López I, Nicolau Ramis JA, Gómez Gómez LA, et al. Glucagon perfusion in paraneoplastic hypoglycemia[J]. Endocrinol Nutr, 2009, 56(3): 143-146. DOI:10.1016/S1575-0922(09)70846-0 |
| [16] |
Tozawa K, Tamai H, Inoue K, et al. Case report; malignant peritoneal mesothelioma with hypoglycemia suggestive of paraneoplastic syndrome[J]. Nihon Naika Gakkai Zasshi, 2011, 100(8): 2259-2262. DOI:10.2169/naika.100.2259 |
| [17] |
Mendoza CF, Ontiveros P, Xibillé DX, et al. Ectopic ACTH secretion (EAS) associated to a well-differentiated peritoneal mesothelioma: case report[J]. BMC Endocr Disord, 2015, 15: 40. DOI:10.1186/s12902-015-0031-4 |
| [18] |
von Hirschhausen R, Clemens M. Paraneoplastic dermatomyositis in peritoneal mesothelioma[J]. Med Klin(Munich), 1990, 85 Suppl 1: 113-115. |
| [19] |
Malpica A, Euscher ED, Marques-Piubelli ML, et al. Malignant Mesothelioma of the Peritoneum in Women: A Clinicopathologic Study of 164 Cases[J]. Am J Surg Pathol, 2021, 45(1): 45-58. DOI:10.1097/PAS.0000000000001545 |
| [20] |
Dogan M, Ozal G, Savas B, et al. Malign peritoneal mesothelioma with nephrotic syndrome[J]. Bratisl Lek Listy, 2012, 113(1): 43-45. |
| [21] |
Tandar A, Abraham G, Gurka J, et al. Recurrent peritoneal mesothelioma with long-delayed recurrence[J]. J Clin Gastroenterol, 2001, 33(3): 247-250. DOI:10.1097/00004836-200109000-00018 |
| [22] |
Chen LY, Huang LX, Wang J, et al. Malignant peritoneal mesothelioma presenting with persistent high fever[J]. J Zhejiang Univ Sci B, 2011, 12(5): 381-384. DOI:10.1631/jzus.B1000338 |
| [23] |
Li YC, Khashab T, Terhune J, et al. Preoperative thrombocytosis predicts shortened survival in patients with malignant peritoneal mesothelioma undergoing operative cytoreduction and hyperthermic intraperitoneal chemotherapy[J]. Ann Surg Oncol, 2017, 24(8): 2259-2265. DOI:10.1245/s10434-017-5834-2 |
| [24] |
Zell JA, Chang JC. Neoplastic fever: a neglected paraneoplastic syndrome[J]. Support Care Cancer, 2005, 13(11): 870-877. DOI:10.1007/s00520-005-0825-4 |
| [25] |
Zhang H, Wu Y, Lin Z, et al. Naproxen for the treatment of neoplastic fever: A PRISMA-compliant systematic review and meta-analysis[J]. Medicine (Baltimore), 2019, 98(22): e15840. DOI:10.1097/MD.0000000000015840 |
 2022, Vol. 49
2022, Vol. 49


