文章信息
- miR-155在骨肉瘤发生发展及肺转移进程中的作用及机制
- Role and Mechanism of miRNA-155 in Development, Progression and Lung Metastasis of Osteosarcoma
- 肿瘤防治研究, 2021, 48(12): 1087-1095
- Cancer Research on Prevention and Treatment, 2021, 48(12): 1087-1095
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2021.21.0608
- 收稿日期: 2021-05-31
- 修回日期: 2021-08-20
2. 100035 北京,北京积水潭医院病理科;
3. 100037 北京,阜外医院动物实验中心;
4. 100035 北京,北京积水潭医院胸外科
2. Department of Pathology, Beijing Jishuitan Hospital, Beijing 100035, China;
3. Animal Experimental Center, Fuwai Hospital, Beijing 100037, China;
4. Department of Thoracic Surgery, Beijing Jishuitan Hospital, Beijing 100035, China
骨肉瘤(osteosarcoma, OS),临床上又称为成骨肉瘤,是骨骼相关肿瘤中最常见的恶性肿瘤之一,常见于20岁以下的青少年及儿童,好发于血运丰富的长管状骨干骺端,临床表现为骨端的局部疼痛和肿胀,偶尔合并骨关节的功能障碍。在骨相关的小儿恶性肿瘤中,骨肉瘤最为常见,约占小儿所有恶性肿瘤的百分之五。骨肉瘤的治疗现阶段主要以外科治疗和化疗为主,而疾病的预后与是否合并肺转移具有密切的关系。近年来,随着手术技术及化疗药物的不断发展,原发骨肉瘤,即不合并肺转移及远处转移的患者,经规范及有效地治疗后,五年生存率能够达到百分之七十左右[1],但是既往临床相关研究发现,合并远处转移的患者,尤其是合并肺转移的患者,五年生存率显著降低,只有百分之三十左右,而骨肉瘤早期合并肺转移的患者预后更差。综述相关文献后发现:大约有40%的骨肉瘤患者在初诊时就合并远处转移,其中以肺转移最常见[2]。目前,骨肉瘤的发生发展及其肺转移的机制仍不明确,临床上也没有相关的标志物及指标予以预测及判断预后情况,骨肉瘤的发展及其肺转移仍是其临床治疗的难点及热点[3]。因此,明确骨肉瘤的发生发展及其肺转移的机制,对于探索其新的治疗靶点、改善疾病预后具有重要意义。
MicroRNA-155(miR-155)是新近发现的非编码RNA,可以影响转运RNA的相关转录、基因加工等多种生物过程。既往研究发现,miR-155参与了很多肿瘤发生发展的多种生物学过程。miR-155在胃癌、结直肠癌、乳腺癌等多种肿瘤中发挥着重要的作用[4],现已知其明确参与调控肿瘤相关的细胞增殖、凋亡、自噬等多种病理生理过程。通过相关文献查询发现,miR-155与骨肿瘤的相关研究亦有许多报道,有文章指出miR-155对骨肿瘤细胞的发生发展、复发和耐药性等生物学过程具有重要的影响作用[5],但是既往研究大多是miR-155与骨髓瘤细胞的相关研究,miR-155与骨肉瘤的相关研究较少,尤其未见miR-155与骨肉瘤的发生发展及其肺转移的影响及机制相关研究。
本研究将初步探究miR-155在骨肉瘤发生发展及其肺转移过程中的作用,并通过iTRAQ定量蛋白质组学技术探索其靶蛋白及相关机制。
1 资料与方法 1.1 临床资料、细胞与试剂收集2015年12月—2020年12月北京积水潭医院骨肉瘤患者临床标本,包括合并肺转移患者12例,无骨肿瘤疾病患者4例。骨肉瘤患者收集标本包括:血清、骨肉瘤组织(osteosarcoma-tissue, OS-T)、骨肉瘤瘤旁组织(osteosarcoma-paratumor tissue, OS-PT)、骨肉瘤肺转移组织(pulmonary metastasis tumor-tissue, PET-T)和骨肉瘤肺转移瘤旁组织(pulmonary metastasis tumor-paratumor tissue, PET-PT);健康者收集标本为血清。本试验项目通过北京积水潭医院伦理委员会审查,伦理审查批号为202103.49。所有患者均签署知情同意书并予以备案。
骨肉瘤患者入组标准:均为原发性骨肉瘤,无其他合并症。第一次手术:骨肉瘤根治手术,即肿瘤瘤段截除+关节重建手术。术前行PET/CT检查明确骨肉瘤病变情况,确定全身无骨肉瘤相关转移病灶;术前不进行新辅助化疗、放疗、靶向等相关治疗;术后化疗12次,化疗方案均为:甲氨蝶呤+顺铂+环磷酰胺,化疗药物剂量按照药物说明进行配制,化疗结束后每3月规律复查。手术前留取血清样本,术中留取骨肉瘤及瘤旁组织样本。
具体骨肉瘤根治手术方式及例数:8例股骨远端骨肉瘤患者均行“股骨远端瘤段截除+人工假体关节置换手术”:麻醉满意后,患者取平卧位,常规碘酒酒精消毒铺单,止血带下手术。取大腿前内侧纵行切口长20~30 cm,逐层切开皮肤、皮下组织及深筋膜,从股直肌与股内侧肌间分离,见软组织包块位于股骨下端内侧及后侧,切除部分骨内侧肌、并充分游离股骨下端肿瘤边缘,与内后侧分离并保护股血管神经束,注意保护腓总神经,切开关节囊,切断双侧副韧带、交叉韧带和后关节囊,距关节面15~25 cm截断股骨,取下股骨肿瘤瘤段,断端髓腔未见异常。股骨端扩髓,胫骨端扩髓,冲洗髓腔,置入股骨下段组配型人工膝关节旋转链型假体(力达康公司,重建长度15~25 cm,髓针长8~16 cm,直径8~16 mm),并以骨水泥固定,待凝固后组装假体。充分止血、冲洗伤口,留置伤口引流管2根,逐层缝合伤口,清点纱布、器械无误,术毕。
3例肱骨近端骨肉瘤患者均行“肱骨近端瘤段截除+肱骨近端人工假体重建术”:麻醉满意后, 患者平卧位,常规碘酒酒精消毒铺单。取上臂上段前侧纵行切口,逐层切开皮肤、皮下组织、深筋膜,切断胸大肌止点、三角肌于肱骨中上段止点,于内侧保护肱血管、保护后侧桡神经,充分游离肿瘤瘤段周边,于距肱骨头15~18 cm处截断肱骨;切断三角肌于锁骨及肩峰处起点,切断喙突处肌腱,切断肩盂周围肩袖诸肌充分显露肩盂,于肩胛颈前方、后方用超声骨刀、骨刀截断肩胛骨,行关节外切除,见肱骨近端连同肩盂完整切除,取下肿瘤瘤段。肱骨远端髓腔扩髓,冲洗髓腔,用肱骨近端人工假体重建(京航公司,重建长度15~20 cm,髓针长度6~8 cm、直径6~8 mm)置换,假体髓针用骨水泥固定。充分止血、冲洗伤口,近端用Mesh补片修复关节囊,用缝合锚钉入肩峰骨质内,尾端缝线缝合于Mesh补片上,将肱骨头固定于肩峰下,将胸大肌、三角肌止点缝合于Mesh上,冲洗伤口,放置伤口引流管2根,逐层缝合伤口,清点纱布器械无误,术毕。
1例肱骨近端骨肉瘤患者行“肱骨近端瘤段截除+人工全肱骨置换术”:麻醉满意后,患者取平卧位,常规碘酒酒精消毒铺单。取左上臂前侧纵行切口,逐层切开皮肤、皮下组织、深筋膜,切断部分三角肌,切断胸大肌止点、肱二头肌及肩袖诸肌,于内侧保护肱血管、保护后侧桡神经,充分游离肿瘤瘤段周边,于肱骨远端保护桡神经、正中神经及尺神经,将整个肱骨完整切除;以人工全肱骨假体(春立公司,重建肱骨长28 cm,肱骨头直径36 mm,尺骨侧长度7 cm、直径6 mm)置换,骨水泥固定尺骨侧髓针,术中尺骨侧有轻微劈裂,予以钛缆固定。充分止血、冲洗伤口,以止血纱布及凝血酶填充止血,近端用Mesh补片修复关节囊,放置伤口引流管2根,逐层缝合伤口,清点纱布器械无误,术毕。
第二次手术:经胸腔镜肺楔形切除术。入组患者为:第一次手术化疗结束后 > 12月,新发肺转移病灶。术前行PET/CT检查明确骨肉瘤原发病变无复发,且除肺部转移其余全身均无转移病灶。术前不进行新辅助化疗、放疗、靶向等相关治疗。手术前留取血清样本,术中留取骨肉瘤肺转移及瘤旁组织样本。
人正常成骨细胞系CP-H111和人骨肉瘤细胞系HOS-143B均购于武汉普诺赛生命科技有限公司,细胞培养基、胎牛血清均购于美国Gibco公司,CEBPB抗体和GAODH抗体及标记二抗均购自赛默飞世尔科技(中国)有限公司,蛋白显影液、脱脂奶粉等均购于上海生工生物科技有限公司,反转录荧光定量等相关试剂盒以及QPCR相关试剂购自北京庆凯华丰科技开发有限公司。
1.2 仪器设备高速低温离心机(美国,ABI公司),紫外分光光度仪(日本,Sanyo公司),真空干燥机(德国,Eppendorf公司);分析天平(瑞士,Sartorius公司),电热恒温水浴锅(北京长风仪器仪表公司,中国),高速离心机(德国,Eppendorf公司),Vortex QL-901微型涡旋混合仪(瑞士,Tecan公司),超声波清洗器(日本,JEOL公司),纯水系统(美国,Millipore公司),图像扫描仪(日本,Leica公司),高效液相系统(美国, Agillent公司),质谱仪(美国,Thermo Finnigan公司)。
1.3 骨肉瘤及其肺转移进程中miR-155的差异性检测 1.3.1 相关数据库分析利用Exiqon miRNome平台数据库分析系统以及GEO(Gene Expression Omnibus)数据库中的芯片测序数据统计分析miR-155在骨肉瘤组织与正常组织、骨肉瘤细胞HOS-143B与正常成骨细胞CP-H111中miR-155的差异性。
1.3.2 qPCR技术检测miR-155利用qPCR技术检测骨肉瘤组织与瘤旁组织、人正常成骨细胞系CP-H111和人骨肉瘤细胞系HOS-143B中miR-155的差异性。miR-155相关检测,扩增产物472 bp,miR-155引物序列如下:Forward primer: 5’-AGCTGAAGTCTACCTTGCCT-3’;Reverse primer: 5’-TGTGGGCTTGAAGTTGAGATGT-3’,以U6为内参。
1.4 应用iTRAQ定量蛋白质组学筛选骨肉瘤及其肺转移进程中miR-155的靶蛋白 1.4.1 制备样品蛋白样本选择组织中的全蛋白质进行组学分析。因为骨肉瘤起源于间叶组织细胞,所以骨肉瘤的瘤体组织中掺杂较多的血管、骨组织等不均一组织。基于此原因,骨肉瘤实验组织的取材常采取肿瘤瘤体组织与瘤旁组织进行差异性对比,其实质是多种细胞及组织的蛋白混合物的相关对比。所以本实验的组织取材为各组骨肉瘤及其瘤旁组织、肺转移瘤及其瘤旁组织、以及骨肉瘤患者的血清及健康者的血清。实验组为:骨肉瘤组织、骨肉瘤肺转移组织、骨肉瘤患者的血清;对照组为:骨肉瘤瘤旁组织、骨肉瘤肺转移瘤旁组织、健康者的血清。
1.4.2 样本蛋白的浓度测定及蛋白分离本实验检测的是不同组织及血清中蛋白含量的差异性,因此样品蛋白浓度的测定对实验结果至关重要,本实验采用的是BCA试剂盒来测定蛋白浓度。
蛋白浓度检测完成后进行蛋白分离实验:配制7 mm厚度为4%~12%的胶SDS-PAGE。等比例将两种蛋白混合,然后加入等体积的Loading buffer,进行混匀,随后煮沸5 min,进而离心(10 000 g, 10 min),取上清液,滴加至浓缩胶,蛋白上样量约为每泳道60 μg。电泳步骤:恒流10 mA, 运行30 min后,20 mA持续至分离胶末端,然后进行考马斯亮蓝染色。
1.4.3 蛋白质酶切标准将SDS-PAGE获得的分离胶按分子量由大到小的顺序,分解成15个部分,再把每部分剪切成1 mm左右的微粒,将微粒浸泡于50%ACN/25 mmol/L碳酸氢铵溶液中,颜色脱洗完全后氮气烘干,以便微粒脱水完全,体积减小;滴加DTT溶液,37℃水浴锅4 h,滴加55 mmol/L IAA溶液,避光室温存放1 h,滴加少量酶液,4℃冰箱存放1 h后除去上层酶液,37℃保温箱内存放16 h后,滴加2%TFA,再于60%ACN超声15 min,取上层清液。再次重复上述步骤后,两次上层清液合并。
1.4.4 蛋白酶切混合物的液相分离色谱分离需在Agillent系统上进行:利用自动上样器进行蛋白上样,蛋白体积约为20 µl,蛋白流速是10 µl/min;色谱洗脱在二元泵系统上进行:洗脱后成分通过ESI离子源进入质谱系统,液相色谱设置为:流动相A:0.1%的FA-98%水溶液;流动相B:0.1%的FA-80%ACN溶液;洗脱设置:0~90 min,流动相比例由2%B线性上升到40%B;90~105 min,流动相比例由40%B线性上升到100%B;维持15 min后,以100%流动相A平衡色谱柱30 min,流速为300 µl/min。
1.4.5 质谱分析检测质谱分析检测:质谱仪为线性离子阱-傅里叶变换离子回旋共振质谱仪(LTQ-FT, Thermo),设置的磁场强度:7 T。喷雾电压设置:1.8 kV;毛细管温度设置:180℃;扫描模式:Ⅰ级质谱依靠的是Ⅱ级质谱检测;质谱Ⅰ级全扫描质荷比范围为400~2 000 m/z(Mass range, m/z)。依次截取Ⅰ级质谱筛选的强度排名前十的离子进行Ⅱ级质谱串联,实验通过质谱串联扫描的动态排除方法,排除时间为30秒;离子自动增益控制设置为:一级质谱扫描为1×106个电荷,二级串联质谱为1×103个电荷。Ⅰ级质谱在400 m/z处的分辨率设置为100 000;Ⅱ级串联质谱归一化碰撞能量设置为35%。
1.4.6 蛋白检测、矫正及定量检测蛋白检测、矫正及定量利用MASCOT相关软件,通过对质谱相关文件的结果进行检测。蛋白质检测设置为:酶切点为胰酶切点;最长漏切位点为2;Ⅰ级相关离子误差为12 ppm;Ⅱ级离子误差为0.4 Da;存在可变修饰检测:存在固定修饰检测;检测结束后再对相关蛋白进行定量:最小定量的肽段数为3氨基酸时,蛋白及肽段检测的假阳性率需降低到1%及以下;最小定量的肽段数为6氨基酸时,蛋白定量需保证至少有一条非冗余肽及锑刀肽。
1.5 筛选miR-155在骨肉瘤及其肺转移进程中靶蛋白实验参考miRNA靶基因数据库[6](miRanda、TargetScan和PicTar)进行靶蛋白预测。将骨肉瘤及肺转移组织中表达量降低50%以上的蛋白分别与miR-155数据库中预测的靶基因进行对比分析,查看其是否具有miR-155的结合位点。
1.6 骨肉瘤及其肺转移进程中miR-155筛选蛋白的验证利用Western blot检测骨肉瘤组织与瘤旁组织、肺转移瘤与瘤旁组织、人正常成骨细胞系CP-H111和人骨肉瘤细胞系HOS-143B中筛选蛋白的差异性。各组细胞或组织中分别加入RIPA裂解液,冰上裂解20 min,4℃,18 000 g,离心20 min(r=10 cm),取上清液并采用BCA试剂盒测定蛋白含量。取35 μg蛋白液进行SDS-PAGE,转膜,用封闭液(质量分数2%,BSA)封闭,分别加入一抗4℃过夜(以GAPDH抗体为参照),洗涤后,再加入二抗室温孵育1 h。ECL曝光成像,最后采用凝胶成像系统分析结果。
1.7 统计学方法数据采用GraphPad Prism 6软件处理。采用(x±s)表示正态分布且方差齐的计量资料,行t检验;采用百分数表示计数资料,行χ2检验;P < 0.05为差异有统计学意义。
2 结果 2.1 骨肉瘤及肺转移进程中miR-155的差异性检测结果 2.1.1 临床样本miR-155的差异性检测结果分析骨肉瘤肺转移患者的血清样本数据(GSE65071),利用Exiqon miRNome平台(human panelsⅠ+Ⅱ, V3)对比来自10例骨肉瘤肺转移患者和15例正常对照的血清中miR-155的表达水平。结果提示,正常对照组血清中miR-155的含量仅为肺转移患者血清中的0.292倍,差异有统计学意义(P=0.0032),见图 1A。
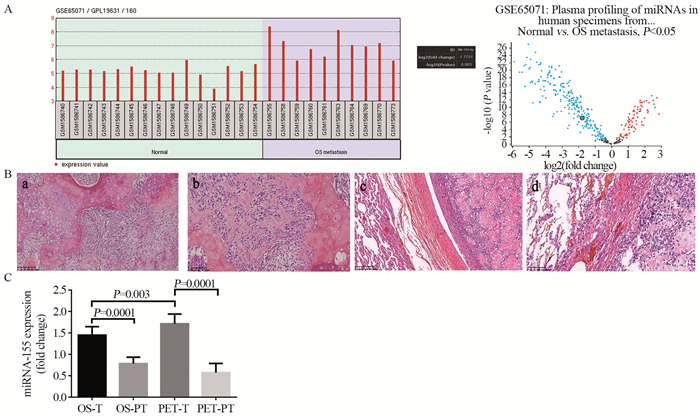
|
| A: the level of miR-155 in serum of patients with lung metastasis of osteosarcoma and normal control. The volcanic map showed that miR-155 expression was significantly increased in serum of patients with lung metastasis of osteosarcoma; B: (a) HE staining of left humerus osteosarcoma-10X; (b) HE staining for pathological of the left humerus osteosarcoma-20X; (c) HE staining of lung metastasis of the right distal humerus osteosarcoma-10X; (d) HE staining of lung metastasis of the right distal humerus osteosarcoma-20X;C: OS-T: osteosarcomatissue, OS-PT: osteosarcomaparatumor tissue, PET-T: pulmonary metastasis tumor-tissue, PET-PT: pulmonary metastasis tumor paratumor tissue, The level of miR-155 in various tissues of osteosarcoma and osteosarcoma lung metastases. 图 1 骨肉瘤及其肺转移进程临床样本miR-155的差异性检测分析结果 Figure 1 Expression of miR-155 in clinical samples of osteosarcoma and its pulmonary metastasis process |
共收集骨肉瘤患者12例:肱骨近端骨肉瘤4例,股骨远端骨肉瘤8例,男: 女=7:5,年龄分布15~43岁,平均年龄28.33±2.87岁。收集入组骨肉瘤患者两次手术术前的血清,以评估患者在出现肺转移前后血清中miR-155含量的差异性,结果显示:miR-155在出现肺转移前为1.87±0.09;肺转移后为2.05±0.11,差异无统计学意义(P=0.78)。为进一步证实miR-155在骨肉瘤及其肺转移进程中的差异性,qRT-PCR检测骨肉瘤组织与其瘤旁组织、骨肉瘤肺转移瘤组织与其瘤旁组织中的miR-155含量。病理切片HE染色,确诊为骨肉瘤或骨肉瘤转移组织。
结果显示,miR-155表达量在骨肉瘤组织:1.45±0.06;骨肉瘤瘤旁组织:0.78±0.05;肺转移瘤组织:1.71±0.07;肺转移瘤旁组织:0.60±0.05。miR-155含量在骨肉瘤组织和肺转移瘤组织中,较对照组瘤旁组织均明显升高,差异有统计学意义(P=0.0001, P=0.0001);肺转移瘤组织中较骨肉瘤组织中miR-155含量亦出现明显升高,差异有统计学意义(P=0.003),见图 1B~C。
2.1.2 骨肉瘤细胞与正常成骨细胞中miR-155的差异性检测结果分析GEO(Gene Expression Omnibus)数据库中的芯片测序数据。发现骨肉瘤细胞系中miR-155的表达量显著上调。对比三个常见的骨肉瘤细胞系与正常骨组织的microRNAs表达(Agilent-019118 Human miRNA Microarray 2.0 G4470B, GSE28425),分析发现在骨肉瘤细胞系HOS-143B、HOS-MNNG和MG-63中miR-155的表达水平是正常骨组织中的15.57倍,差异有统计学意义(P=0.0043, FDR=0.036),见图 2A。
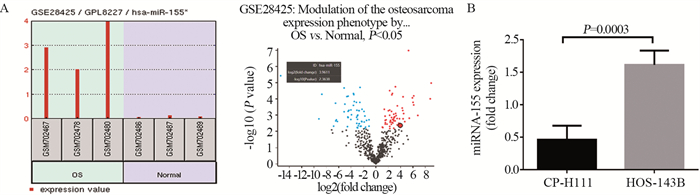
|
| A: expression levels of miR-155 in osteosarcoma cell lines HOS-143B, HOS-MNNG, MG-63 and normal bone tissues. The volcanic map showed that miR-155 expression was significantly increased in osteosarcoma cell lines; B: the level of miR-155 in human osteosarcoma cell line HOS-143B and human normal osteoblast cell line CP-H111. 图 2 人骨肉瘤细胞系与人正常成骨细胞系miR-155的差异性 Figure 2 Comparison of miR-155 expression between human osteosarcoma cell lines and human normal osteoblast cell lines |
为进一步证实miR-155在骨肉瘤及其肺转移进程中的差异性,qRT-PCR检测结果显示,miR-155表达量在人骨肉瘤细胞系HOS-143B中为1.61±0.07,在人正常成骨细胞系CP-H111中为0.46±0.06,差异有统计学意义(P=0.0003),见图 2B。
2.2 骨肉瘤及其肺转移进程中miR-155靶蛋白的筛选结果 2.2.1 质谱鉴定检测结果利用蛋白质组学对骨肉瘤组织和正常骨组织进行蛋白鉴定,结果显示:共检测收集到194 867张质谱图,从中鉴定到46 895条肽段,其中10 985条为非冗余肽,肽段的平均质量误差为0.89 ppm。实验结果最终鉴定到3 714个蛋白组。
2.2.2 差异表达蛋白鉴定结果在骨肉瘤组织中,根据FDR < 0.05,倍数变化大于2倍为标准,骨肉瘤组织中共筛选出差异表达蛋白253个,其中上调144个,下调109个,见图 3A~B。
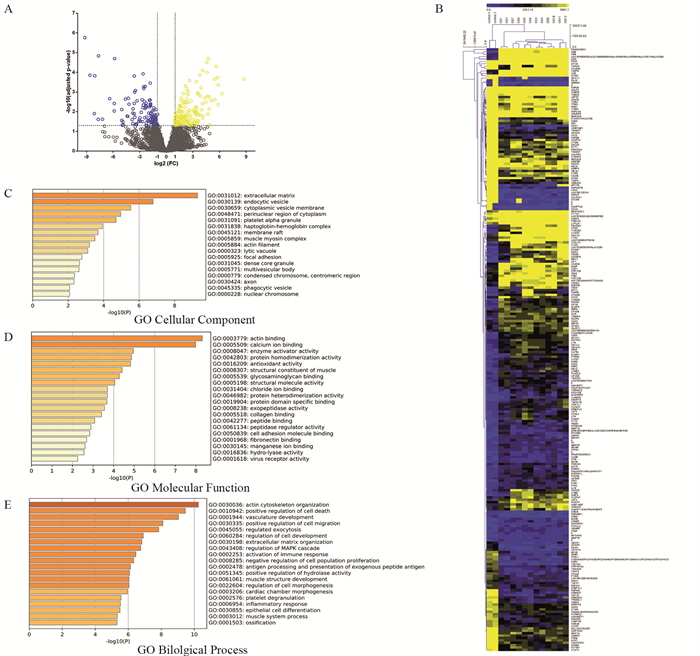
|
| A: volcano map showed that CEBPB expression was significantly reduced in osteosarcoma tissues; B-C: gene expression in osteosarcoma tissue and normal bone tissue after standardization; D: expression level of CEBPB in osteosarcoma tissue and normal bone tissue; E: GO BP and KEGG enrichment analysis results. 图 3 miR-155在骨肉瘤及其肺转移进程组织中靶蛋白的筛选 Figure 3 Screening of target proteins of miR-155 in osteosarcoma and its pulmonary metastasis process |
基因GO注释分析显示,差异表达蛋白主要富集于细胞骨架、细胞黏附、细胞增殖和凋亡、细胞迁移等注释,见图 3C~E。差异表达蛋白中还存在一些参与肿瘤行为调控的蛋白,如:烟酰胺N-甲基转移酶(nicotinamide N-methyltransferase, NNMT)参与调控肿瘤细胞的增殖、分化及凋亡等多种生物学过程,在癌细胞的胞质中出现高表达;同源框蛋白CDX-10(Homeobox protein CDX-10)能够调控肿瘤相关的特异性基因表达和上皮细胞分化;B淋巴细胞瘤-2基因(B-cell lymphoma-2, bcl-2),与细胞凋亡密切相关;基因沉默调节蛋白(Sirtuin 1, SIRT1)活化后可以从细胞质进入细胞核内,进而调节核转录因子活性,参与调节细胞的增殖、分化的相关生物学过程;eIF4E(eukaryotic translation initiation factor 4E)可在蛋白质翻译过程中,通过与转运RNA结合影响和调控蛋白质的翻译进程;细胞周期检测点激酶1和2(checkpoint kinase 1 and 2, Chk 1 and 2)为丝氨酸/苏氨酸蛋白激酶家族相关成员,广泛参与细胞代谢相关生物学过程,尤其是在多种信号通路中影响及调节下游蛋白的表达,进而使细胞代谢出现相关障碍;EHD2(C-terminal EH domain-containing protein 2)是一种细胞膜转运相关蛋白,在细胞膜水平参与蛋白转运,进入细胞核内后,仍影响核内的蛋白转录及翻译过程;组蛋白甲基转移酶(SET and MYND domain containing 3, SMYD3)能够使组蛋白甲基化,进而调控细胞凋亡相关代谢周期,在蛋白质的转录调控中具有重要作用。
2.2.4 miR-155在骨肉瘤及其肺转移进程中靶蛋白的筛选miRanda的预测结果显示,有3个靶基因具有miR-155的靶位点:CCAAT增强子结合蛋白β(C/EBPβ,基因CEBPB),发现C/EBPβ是细胞内一种重要的转录调节因子,广泛参与细胞黏附、细胞增殖等相关通路;B淋巴细胞瘤-10(B-cell lymphoma-10, bcl-10)参与肿瘤细胞的凋亡调控等生物学过程;异戊二烯基二磷酸合酶亚基2(prenyl/decaprenyl diphosphate synthase 2, PDSS 2)在多种肿瘤细胞中呈现差异性表达。TargetScan的预测结果显示,有2个基因具有miR-155的靶位点:C/EBPβ(与miRanda相同);细胞因子信号传导抑制蛋白1(suppressor of cytokine signaling 1, SOCS 1)能够阻断部分肿瘤细胞的信号转导因子,进而降低肿瘤相关代谢进程。PicTar的预测结果显示,有2个基因具有miR-155的靶位点:C/EBPβ(与miRanda和TargetScan均相同);PDSS2(与miRanda相同)。其余蛋白未找到相匹配的结果,这可能是因为miR-155通过间接调节的方式抑制了某些基因及蛋白的表达,或者通过其他非结合的方式进而影响相关蛋白的表达。
2.3 miR-155筛选蛋白C/EBPβ的Western blot验证结果与瘤旁组织相比,骨肉瘤及肺转移瘤组织中C/EBPβ的表达显著降低,差异有统计学意义(P=0.0003, P=0.0002),见图 4A;与人正常成骨细胞系CP-H111相比,人骨肉瘤细胞系HOS-143B中C/EBPβ表达亦显著降低,差异有统计学意义(P=0.004),见图 4B。
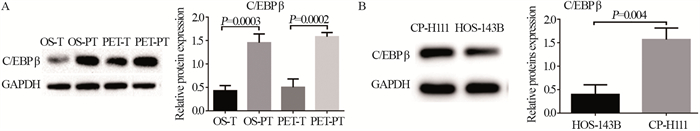
|
| 图 4 miR-155筛选蛋白C/EBPβ的Western blot验证结果 Figure 4 Western blot validation results of miR-155 screening protein C/EBP β |
骨肉瘤因其发病年龄偏小且预后不佳,一直是骨相关肿瘤研究的热点及难点。近年来,随着科学技术的不断发展,miRNAs对肿瘤的相关影响研究逐渐进入人们的视野[7]。miRNAs是广泛存在于真核生物中的非编码小RNAs,长度为19~24个核苷酸序列,能在转录后水平影响靶基因的表达及翻译,通过与mRNA的不完全碱基配对,从而影响其生物学过程[8]。近年来,miRNAs越来越受到重视,研究发现其在机体生理及病理学过程中发挥重要作用,广泛参与调节细胞增殖、凋亡、自噬、肿瘤复发等多种生物学过程[9]。
miR-155是一类多功能的miRNA,参与了包括炎性反应、细胞调控、肿瘤复发、自噬、细胞凋亡等[10]多种生物学过程。综述相关文献发现:miR-155在多种肿瘤的发生发展及转移中发挥重要作用[11]。Shi等[12]发现膜蛋白可以通过调控miR-155抑制胃癌细胞中Smad2的表达;Ulivi等[13]研究发现miR-155能够作为判断贝伐单抗治疗转移性结直肠癌疗效的相关预测因子之一;Santos等[14]指出外泌体介导的miR-155移位能够影响乳腺癌化疗的药物耐受性;Wei等[15]研究发现miR-155可以阻断TGF-β1信号通路,进而缓解肺癌细胞的纤维化进程;Xue等[16]研究发现miR-155能够降低SOCS1、SOCS6和PTEN的表达,进而加速非小细胞肺癌的复发和转移。
研究表明miR-155能够影响与肿瘤相关的多种生理病理过程。Yu等[17]利用miR-155基因敲除小鼠建立骨髓瘤相关实验动物模型,发现通过抑制骨髓中miR-155基因能够显著增加肿瘤的复发及转移;Wang等[18]利用miR-155基因敲除小鼠建立骨髓瘤相关实验动物模型,通过沉默miR-155基因显著促进了骨髓肿瘤的发生发展及生长。
本实验阐释miR-155在骨肉瘤及其肺转移进程中的作用,并利用iTRAQ定量蛋白质组学技术,筛选miR-155在骨肉瘤及其肺转移进程中潜在的靶蛋白,最终鉴定到蛋白3 714个,骨肉瘤组织中差异表达蛋白253个。通过与miRNA靶基因的数据库的匹配分析,经临床样本实验与细胞相关实验的蛋白定量验证,提示C/EBPβ是miR-155潜在的作用靶蛋白。
C/EBPβ是碱性亮氨酸拉链蛋白(bZIP)的家族成员之一。CEBPB的转运RNA能够经过差异性剪切形成4种蛋白异构体(LAP、LIP、LAP2及14 kDa的蛋白)。C/EBPβ也被发现在许多组织及器官内广泛表达,参与调控许多病理生理进程,其中包括细胞分化及增殖、组织及细胞再生、肿瘤、炎性反应等。另外,C/EBPβ已被证实与乳腺癌、胰腺癌、软骨肉瘤等多种肿瘤的复发及转移相关[19],尤其是能够参与调控肿瘤细胞的上皮-间充质转化(epithelial mesenchymal transition, EMT)过程。Zhang等[20]研究发现C/EBPβ参与调控尼古丁诱发的乳腺上皮细胞的EMT激活过程,从而影响乳腺癌的发展;Cheng等[21]研究指出C/EBPβ能够激活CDKN2A转录并抑制胰腺肿瘤细胞EMT,进而抑制胰腺导管腺癌的发生及发展;Lu等[22]研究发现对骨肉瘤细胞转染C/EBPβ可以下调CLEC5A,进而缓解骨肉瘤细胞的增殖,但对其作用机制并未作深入的相关研究。
骨肉瘤为恶性骨肿瘤之一,肿瘤切除术后需进行化疗等进一步治疗。临床上需首先保证患者得到有效且及时的治疗,故在本实验中无法收集无化疗的肺转移瘤及瘤旁组织样本,因此不能完全避免化疗对实验结果的影响。但是本项目制定了严格的入组标准及实验方案,以减少实验结果的偏移。首先,所有入组的骨肉瘤患者,第一次手术前均无新辅助化疗等相关治疗,术后化疗的方案、剂量、次数均无差异,以保证实验过程的均一性;其次,入组为化疗后 > 12月新发肺转移的患者,保证新发肺转移瘤与化疗治疗具有较长的时间间隔,以减轻化疗治疗因素的干扰和偏移;最后,肺转移瘤手术前不进行化疗等相关治疗,且PET/CT明确骨肉瘤无复发且除肺转移外无其他转移,以排除化疗及其他因素对肺转移瘤体的影响。项目初期进入临床观察的患者96例,因入组标准较严格,最后入组的仅有12例患者。本实验结果虽然不能完全避免化疗治疗对实验结果的影响,但是通过严格的入组管理和长时间的临床随访最大限度地降低其对实验结果的偏移,实验结果具有较高的可信性及准确性。
本研究揭示了miR-155在骨肉瘤发生发展及其肺转移过程中的作用,并成功筛选其靶向蛋白C/EBPβ。基于此研究,进而探究在骨肉瘤肺转移过程中miR-155及其相关靶蛋白具体的通路及相关机制,不但可以明确miR-155在骨肉瘤及其肺转移中的生物学分子基础,而且对开发其新的治疗策略具有重要意义。
作者贡献:
杨华杰:临床标本的收集与管理,论文撰写
李兰:实验病理检测
李彬:细胞相关实验
张冬、张强:项目统筹及指导论文撰写
| [1] |
Yang C, Tian Y, Zhao F, et al. Bone Microenvironment and Osteosarcoma Metastasis[J]. Int J Mol Sci, 2020, 21(19): 6985. DOI:10.3390/ijms21196985 |
| [2] |
Lin W, Wang L, Yang S, et al. Analysis of miR-148b expression differences in stage-Ⅰ and Ⅱ parosteal osteosarcoma[J]. Oncol Lett, 2018, 16(1): 998-1002. |
| [3] |
Harrison DJ, Geller DS, Gill JD, et al. Current and future therapeutic approaches for osteosarcoma[J]. Expert Rev Anticancer Ther, 2018, 18(1): 39-50. DOI:10.1080/14737140.2018.1413939 |
| [4] |
Shi Q, Zhang Y, Liu W, et al. Latent membrane protein 2A inhibits expression level of Smad2 through regulating miR-155-5p in EBV-associated gastric cancer cell lines[J]. J Med Virol, 2020, 92(1): 96-106. DOI:10.1002/jmv.25579 |
| [5] |
Wang L, Tang B, Han H, et al. miR-155 Affects Osteosarcoma MG-63 Cell Autophagy Induced by Adriamycin Through Regulating PTEN-PI3K/AKT/mTOR Signaling Pathway[J]. Cancer Biother Radiopharm, 2018, 33(1): 32-38. DOI:10.1089/cbr.2017.2306 |
| [6] |
Jiang Y, Xu B, Chen J, et al. Micro-RNA-137 Inhibits Tau Hyperphosphorylation in Alzheimer's Disease and Targets the CACNA1C Gene in Transgenic Mice and Human Neuroblastoma SH-SY5Y Cells[J]. Med Sci Monit, 2018, 24: 5635-5644. DOI:10.12659/MSM.908765 |
| [7] |
Bozec A, Zangari J, Butori-Pepino M, et al. MiR-223-3p inhibits angiogenesis and promotes resistance to cetuximab in head and neck squamous cell carcinoma[J]. Oncotarget, 2017, 8(34): 57174-57186. DOI:10.18632/oncotarget.19170 |
| [8] |
Bartel DP. MicroRNAs: genomics, biogenesis, mechanism, and function[J]. Cell, 2004, 116(2): 281-197. DOI:10.1016/S0092-8674(04)00045-5 |
| [9] |
Das S, Halushka MK. Extracellular vesicle microRNA transfer in cardiovascular disease[J]. Cardiovasc Pathol, 2015, 24(4): 199-206. DOI:10.1016/j.carpath.2015.04.007 |
| [10] |
Shen Y, Wang J, Yuan J, et al. Anemia among Chinese patients with chronic kidney disease and its association with quality of life-results from the Chinese cohort study of chronic kidney disease (C-STRIDE)[J]. BMC Nephrol, 2021, 22(1): 64. DOI:10.1186/s12882-021-02247-8 |
| [11] |
Huang F, Chen Z, Chen H, et al. Cypermethrin Promotes Lung Cancer Metastasis via Modulation of Macrophage Polarization by Targeting MicroRNA-155/Bcl6[J]. Toxicol Sci, 2018, 163(2): 454-465. DOI:10.1093/toxsci/kfy039 |
| [12] |
Shi Q, Zhang Y, Liu W, et al. Latent membrane protein 2A inhibits expression level of Smad2 through regulating miR-155-5p in EBV-associated gastric cancer cell lines[J]. J Med Virol, 2020, 92(1): 96-106. DOI:10.1002/jmv.25579 |
| [13] |
Ulivi P, Canale M, Passardi A, et al. Circulating Plasma Levels of miR-20b, miR-29b and miR-155 as Predictors of Bevacizumab Efficacy in Patients with Metastatic Colorectal Cancer[J]. Int J Mol Sci, 2018, 19(1): 307. DOI:10.3390/ijms19010307 |
| [14] |
Santos JC, Lima N, Sarian LO, et al. Exosome-mediated breast cancer chemoresistance via miR-155 transfer[J]. Sci Rep, 2018, 8(1): 829. DOI:10.1038/s41598-018-19339-5 |
| [15] |
Wei Y, Kim TJ, Peng DH, et al. Fibroblast-specific inhibition of TGF-β1 signaling attenuates lung and tumor fibrosis[J]. J Clin Invest, 2017, 127(10): 3675-3688. DOI:10.1172/JCI94624 |
| [16] |
Xue X, Liu Y, Wang Y, et al. MiR-21 and MiR-155 promote non-small cell lung cancer progression by downregulating SOCS1, SOCS6, and PTEN[J]. Oncotarget, 2016, 7(51): 84508-84519. DOI:10.18632/oncotarget.13022 |
| [17] |
Yu F, Jia X, Du F, et al. miR-155-deficient bone marrow promotes tumor metastasis[J]. Mol Cancer Res, 2013, 11(8): 923-936. DOI:10.1158/1541-7786.MCR-12-0686 |
| [18] |
Wang J, Yu F, Jia X, et al. MicroRNA-155 deficiency enhances the recruitment and functions of myeloid-derived suppressor cells in tumor microenvironment and promotes solid tumor growth[J]. Int J Cancer, 2015, 136(6): E602-E613. DOI:10.1002/ijc.29151 |
| [19] |
Ndoja A, Reja R, Lee SH, et al. Ubiquitin Ligase COP1 Suppresses Neuroinflammation by Degrading c/EBPβ in Microglia[J]. Cell, 2020, 182(5): 1156-1169, e12. DOI:10.1016/j.cell.2020.07.011 |
| [20] |
Zhang N, Zhu T, Yu K, et al. Elevation of O-GlcNAc and GFAT expression by nicotine exposure promotes epithelial-mesenchymal transition and invasion in breast cancer cells[J]. Cell Death Dis, 2019, 10(5): 343. DOI:10.1038/s41419-019-1577-2 |
| [21] |
Cheng P, Chen Y, He TL, et al. Menin Coordinates C/EBPβ-Mediated TGF-β Signaling for Epithelial-Mesenchymal Transition and Growth Inhibition in Pancreatic Cancer[J]. Mol Ther Nucleic Acids, 2019, 18: 155-165. DOI:10.1016/j.omtn.2019.08.013 |
| [22] |
Lu J, Chen W, Liu H, et al. Transcription factor CEBPB inhibits the proliferation of osteosarcoma by regulating downstream target gene CLEC5A[J]. J Clin Lab Anal, 2019, 33(9): e22985. |
 2021, Vol. 48
2021, Vol. 48


