文章信息
- 应用不平衡法检测赣南地区原发性肺腺癌ALK融合突变
- 5′/3′ Imbalance Strategy for qRT-PCR to Detect ALK Fusion Mutation in Primary Lung Adenocarcinoma in Gannan Region
- 肿瘤防治研究, 2021, 48(12): 1066-1070
- Cancer Research on Prevention and Treatment, 2021, 48(12): 1066-1070
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2021.21.0455
- 收稿日期: 2021-04-19
- 修回日期: 2021-08-13
2. 341000 赣州,赣州市妇幼保健院门诊部
2. Outpatient Department, Ganzhou Maternity and Child Health Hospital, Ganzhou 341000, China
肺癌是目前我国发病率和死亡率最高的恶性肿瘤,作为非小细胞肺癌(NSCLC)继表皮生长因子受体(epidermal growth factor receptor, EGFR)基因突变之后被发现的第二大突变基因—棘皮动物微管相关蛋白4-间变淋巴瘤激酶(echinoderm microtubule-associated protein-like 4-anaplastic lymphoma kinase, EML4-ALK)融合基因在NSCLC发生、发展、预后及转归中扮演着重要角色,尤其是肺腺癌最具有特点的致癌基因。文献[1-4]报道不同地区的NSCLC患者中EML4-ALK融合突变存在差异,目前赣南地区尚无ALK融合基因的相关报道。本研究通过不平衡法(即基于3'端和5'端的表达水平不平衡策略的qRT-PCR方法)检测赣南地区原发性肺腺癌组织中ALK融合基因的表达情况,回顾性分析其临床病理特征,旨在探讨赣南地区原发性肺腺癌ALK融合基因的特点,科学指导此类患者优选靶向用药。
1 资料与方法 1.1 一般资料选取赣南医学院第一附属医院2016年—2020年经病理检查确诊为原发性肺腺癌的病例233例,其中男127例(54.51%),女106例(45.49%),平均年龄(60.3±10.618)岁,中位年龄61岁(34~89岁);无吸烟史142例(60.94%),有吸烟史91例(39.06%);临床分期按国际肺癌研究协会第八版国际肺癌TNM分期标准执行:Ⅰ期42例(18.02%)、Ⅱ期17例(7.30%)、Ⅲ期21例(9.01%)、Ⅳ期153例(65.67%)。入组患者分布于赣南地区,均为初治,未接受过化疗、放疗或靶向治疗。
1.2 方法 1.2.1 筛选病例经外科手术切除或CT引导下经皮肺穿刺活检或电子支气管镜活检组织标本233例,其中石蜡切片组织标本201例,新鲜活检组织标本32例。经赣南医学院第一附属医院科学研究伦理委员会审查批准(编号:LLSC-2021081601)。
1.2.2 标本固定由医院病理科进行石蜡包埋固定,按至少5 μm厚度切取病理白片15张外送。32例新鲜组织标本离体后储存在RNAfixer组织保存液中固定后外送。经患者知情同意后,233例样本先后外送至浙江鼎晶医学检验所进行ALK融合基因检测。
1.2.3 总RNA提取采用组织RNA抽提kit(Qiagen)试剂盒提取样本总RNA,紫外分光光度仪测定模板总RNA的浓度(> 30 ng/μl)和纯度(OD260/OD280值为1.8~2.0)。
1.2.4 反转录(reverse transcription, RT)合成cDNA参照M-MLV反转录试剂盒说明书设置RT程序:25℃ 5 min;42℃ 60 min;75℃ 5 min;4℃ 5 min。
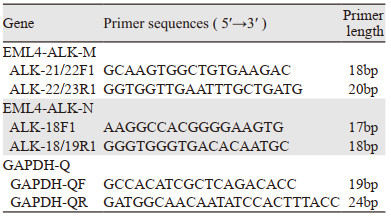
1.2.5 Real-time PCR体系RT产物通过SYBR Green PCR master mix(Applied Biosystems)试剂进行PCR反应,反应体系中加入荧光物质并采用ABI 7500 PCR仪检测。PCR程序参照人EML4-ALK融合基因检测试剂盒(real time PCR)使用说明书进行设置:(1)UNG酶反应:50℃ 2 min 1个循环;(2)预变性:95℃ 10 min 1个循环;(3)变性:95℃ 15 s;退火、延伸及检测荧光(荧光通道为FAM)60℃ 32 s,共45个循环;(4)溶解曲线(60℃~95℃按1%的速度递增,此阶段吸收荧光信号):95℃ 15 s 1个循环;60℃ 1 min 1个循环;95℃ 30 s 1个循环;60℃ 15 s 1个循环。引物序列见表 1。
本组资料为计数资料,以百分数表示。应用SPSS24.0软件,采用χ2检验或确切概率法进行统计学分析,以P < 0.05为差异有统计学意义。
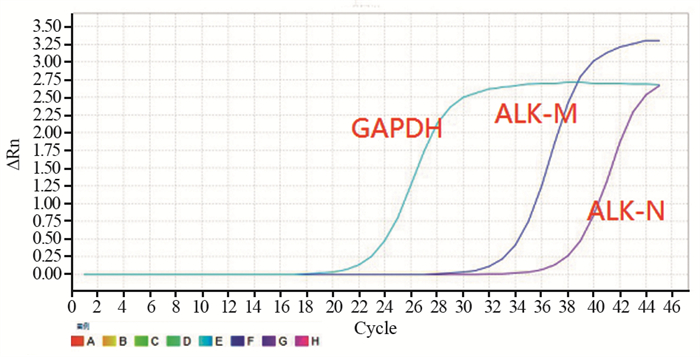
2 结果 2.1 ALK融合基因的表达情况入组233例样本,共检测出21例ALK基因融合,表达率为9.01%,见图 1。
|
| 图 1 ALK融合突变Real-time PCR图 Figure 1 Real-time PCR pictures of ALK fusion mutation |
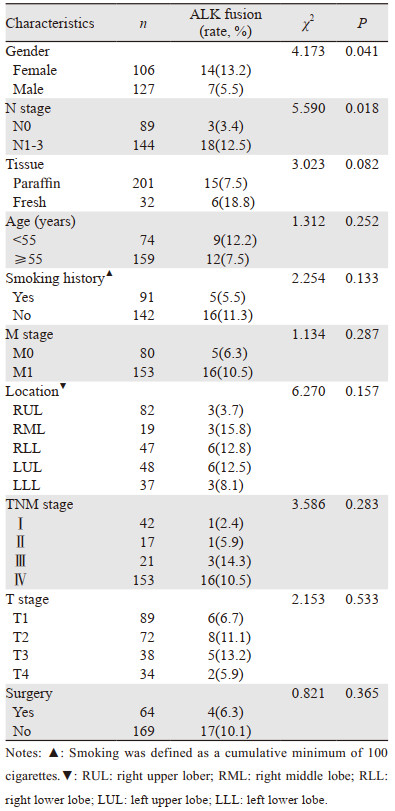
女性、N1-3患者ALK融合基因表达率为13.2%(14/106)、12.5%(18/144),均显著高于男性(5.5%)、N0(3.4%)患者,差异有统计学意义(P < 0.05);ALK融合基因在新鲜组织标本、年龄 < 55岁、无吸烟史以及M1期患者中的表达率相对较高,但未达统计学意义(P > 0.05);ALK融合基因的表达与TNM分期、T分期、是否手术治疗以及肿瘤分布位置均无相关性(P > 0.05),见表 2。
|
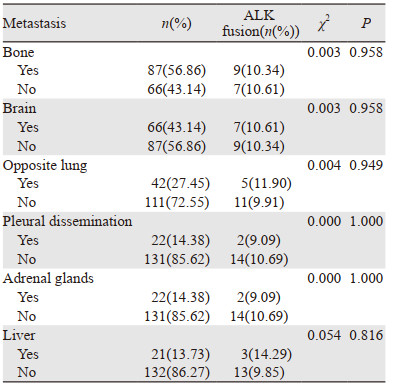
在153例M1期病例中,肺癌常见转移部位按发生率大小依次是骨转移、脑转移、对侧肺转移、胸膜播散(恶性胸水、心包积液或胸膜结节)/肾上腺转移以及肝转移,亚组分析均未发现ALK融合突变与肺癌常见部位转移的相关性(均P > 0.05),见表 3。
|
目前肺癌的诊疗已迈入了精准医学时代,EML4-ALK是继EGFR之后第二受关注的基因,也是NSCLC中最常见的ALK融合基因,亦是在NSCLC中第一个发现的融合基因激酶抑制靶点。在EML4-ALK融合基因中,EML4的N端与ALK胞内的络氨酸激酶区发生融合,导致ALK融合基因异常表达,此外融合伴侣EML4可促进融合蛋白的二聚和低聚反应,导致ALK酪氨酸激酶区及下游PI3K/AKT及MAPK等信号通路激活,从而引起细胞异常增殖和分化[5]。在NSCLC中被发现的ALK融合基因还包括KIF5B-ALK、TFG-ALK、KLC1-ALK等[6-7]。近年来,针对ALK融合基因的靶向治疗药物发展迅速,克唑替尼[8]、阿来替尼[9]、劳拉替尼[10]等ALK-TKIs的临床使用显著改善了ALK阳性晚期NSCLC患者的生存,对ALK融合突变NSCLC具有类似于EGFR-TKIs的疗效,ALK-TKIs通过竞争性结合于ALK激酶区,阻断ALK下游的信号转导通路,从而达到治疗效果。
本研究入组病例来自赣南地区十八县市区,以客家人居多,ALK融合基因的表达率为9.01%(21/233),高于ALK融合基因的整体表达水平(3%~7%)[11],提示ALK融合突变可能存在一定的区域或人种差异。回顾性分析发现,女性患者ALK融合基因的表达率明显高于男性患者(P < 0.05),与王惠宇等[12]研究结果类似,Ke等[13]研究亦表明ALK融合基因更多见于女性。ALK融合突变的性别差异可能与雌激素相关,有研究[14]表明雌激素受体表达增加可能与性别相关的NSCLC发生风险增加有关。同时,有淋巴结转移(即N1-3)患者ALK融合基因的表达率显著高于无淋巴结转移(即N0)患者,Tian等[15]回顾性研究亦表明ALK融合突变肺腺癌患者可能有淋巴结转移倾向。
既往研究[16-18]表明ALK融合突变多见于年轻NSCLC患者,且ALK融合突变阳性患者的年龄较阴性患者小4~5岁[19-20]。本研究选取55岁作为年龄界定点进行统计分析,未发现ALK融合突变在不同年龄组间的显著差异(P > 0.05)。
吸烟作为肺癌最密切的致病因素,Sasaki等[21]报道非吸烟NSCLC患者具有更高的ALK融合突变风险。本研究结果显示,ALK融合基因在无吸烟史患者中的表达率相对较高,但差异无统计学意义(P > 0.05)。
目前,手术大标本和新鲜活检组织标本是肺癌基因检测的理想标本,肿瘤细胞含量较多,检出率更高,结果更为可靠[22]。本研究比较了新鲜活检组织和石蜡切片组织标本中的ALK融合基因表达水平,前者相对较高,但差异无统计学意义(P > 0.05),可能与入组病例中新鲜活检组织样本量比例低有关。此外,赣南地区原发性肺腺癌中ALK融合基因的表达与临床分期、T分期、M分期、是否手术治疗以及肿瘤分布位置均无相关性,可能与入组病例的筛选、检测方法的选择以及地域、种族差异等因素有关。
ALK融合突变一般与肿瘤的恶性程度相关,且更易发生淋巴结转移、胸膜转移及脑转移[23],ALK融合突变患者的预后相对更差。本研究亚组分析未发现ALK融合突变与肺癌常见部位(骨、脑、对侧肺、胸膜播散、肾上腺及肝)转移的相关性(P > 0.05),可能是由样本量的差异、回顾性研究的偏倚等因素造成的。
本实验采用基于3'端和5'端的表达水平不平衡策略的qRT-PCR方法[24]检测肿瘤组织中ALK基因在3'端和5'端的表达差异,分析二者之间的不平衡现象,进而明确是否存在ALK融合基因。只要存在ALK融合基因,即无论是已知的ALK融合基因,还是新的ALK融合基因,不平衡法就可以检测到,而且与肿瘤靶基因高通量测序、FISH等比较,其检测时间更短,对仪器设备和人员要求更低,值得在临床中广泛应用并积极推广。
综上所述,赣南地区原发性肺腺癌患者ALK融合基因的表达率相对较高,好发于女性、有淋巴结转移患者。明确赣南地区原发性肺腺癌患者ALK融合基因的临床特点,科学指导赣南地区NSCLC患者个体化治疗,为此类患者优选靶向用药提供理论依据,进而建立赣南地区肺癌靶向治疗模式并推广应用于临床。
(致谢: 感谢鼎晶医学检验所为本研究提供实验部分的支持与帮助!)
作者贡献:
钟炜祥:实验设计、实施及评估,数据统计分析及文章执笔
韦晰凤:筛选病例,收集、整理及汇总病例临床资料及其基因检测结果,文章审校
| [1] |
李秀忠, 赵志军, 郭雅琪, 等. 宁夏地区非小细胞肺癌EML4-ALK融合基因的表达特征分析[J]. 宁夏医学杂志, 2019, 41(11): 970-972. [Li XZ, Zhao ZJ, Guo YQ, et al. Analysis of expression characteristics of EML4-ALK fusion gene in non-small cell lung cancer in Ningxia[J]. Ningxia Yi Xue Za Zhi, 2019, 41(11): 970-972.] |
| [2] |
刘光峨, 杨玲, 李佩洁, 等. 贵州黔北地区922例非小细胞肺癌EGFR、ALK、ROS-1基因突变状态及其临床病理特征分析[J]. 中华肿瘤防治杂志, 2020, 27(21): 1691-1697. [Liu GE, Yang L, Li PJ, et al. Analysis of the mutaiton status of EGFR, ALK and ROS-1 genes and their clinicopathological characteristics in 922 cases of non-small cell lung cancer in northern Guizhou province[J]. Zhonghua Zhong Liu Fang Zhi Za Zhi, 2020, 27(21): 1691-1697.] |
| [3] |
王娟, 苏国苗, 潘国庆, 等. 云南地区非小细胞肺癌EGFR、ALK和ROS1基因突变联合检测[J]. 昆明医科大学学报, 2020, 41(9): 1-6. [Wang J, Su GM, Pan GQ, et al. Combined Detections and Analysis to the Genetic Mutation of EGFR, ALK and ROS1 in Non-small Cell Lung Cancer in Yunnan[J]. Kunming Yi Ke Da Xue Xue Bao, 2020, 41(9): 1-6.] |
| [4] |
冯征, 文苗苗, 王雪娇, 等. 中国西北地区非小细胞肺癌EGFR、ALK、ROS1基因突变和临床病理特征分析[J]. 临床肿瘤学杂志, 2021, 26(1): 29-33. [Feng Z, Wen MM, Wang XJ, et al. Mutation analysis and clinicopathological features of EGFR, ALK, ROS1 in patients with non-small cell lung cancer in northwest of China[J]. Lin Chuang Zhong Liu Xue Za Zhi, 2021, 26(1): 29-33. DOI:10.3969/j.issn.1009-0460.2021.01.005] |
| [5] |
Golding B, Luu A, Jones R, et al. The function and therapeutic targeting of anaplastic lymphoma kinase (ALK) in non-small cell lung cancer(NSCLC)[J]. Mol Cancer, 2018, 17(1): 52. DOI:10.1186/s12943-018-0810-4 |
| [6] |
Su Y, Long X, Song Y, et al. Distribution of ALK Fusion Variants and Correlation with Clinical Outcomes in Chinese Patients with Non-Small Cell Lung Cancer Treated with Crizotinib[J]. Target Oncol, 2019, 14(2): 159-168. DOI:10.1007/s11523-019-00631-x |
| [7] |
祁春艳, 吴涛, 齐晓光. ALK融合基因阳性肺腺癌患者耐药核心基因鉴定及药物靶点分析[J]. 肿瘤防治研究, 2021, 48(5): 451-456. [Qi CY, Wu T, Qi XG. Identification of Drug-resistance Core Genes and Drug Targets in Lung Adenocarcinoma Patients Harboring ALK Fusion Gene[J]. Zhong Liu Fang Zhi Yan Jiu, 2021, 48(5): 451-456. DOI:10.3971/j.issn.1000-8578.2021.20.1206] |
| [8] |
Wu Y, Lu S, Lu Y, et al. Results of PROFILE 1029, a Phase ⅢComparison of First-Line Crizotinib versus Chemotherapy in East Asian Patients with ALK -Positive Advanced Non–Small Cell Lung Cancer[J]. J Thorac Oncol, 2018, 13(10): 1539-1548. DOI:10.1016/j.jtho.2018.06.012 |
| [9] |
Zhou C, Kim SW, Reungwetwattana T, et al. Alectinib versus crizotinib in untreated Asian patients with anaplastic lymphoma kinase-positive non-small-cell lung cancer (ALESIA): a randomised phase 3 study[J]. Lancet Respir Med, 2019, 7(5): 437-446. DOI:10.1016/S2213-2600(19)30053-0 |
| [10] |
Shaw AT, Bauer TM, de Marinis F, et al. First-Line Lorlatinib or Crizotinib in AdvancedALK-Positive Lung Cancer[J]. N Engl J Med, 2020, 383(21): 2018-2029. DOI:10.1056/NEJMoa2027187 |
| [11] |
Solomon B. First-line treatment options for ALK-rearranged lung cancer[J]. Lancet, 2017, 389(10072): 884-886. DOI:10.1016/S0140-6736(17)30124-1 |
| [12] |
王惠宇, 夏丹丹, 王润洁, 等. 非小细胞肺癌患者EML4-ALK和EGFR共存突变的检测及其与临床病理特征的关系[J]. 现代肿瘤医学, 2018, 26(19): 3058-3061. [Wang HY, Xia DD, Wang RJ, et al. Detection of co-existing mutation of EML4-ALK and EGFR and its relationship with clinicopathological features in patients with non-small cell lung cancer[J]. Xian Dai Zhong Liu Yi Xue, 2018, 26(19): 3058-3061. DOI:10.3969/j.issn.1672-4992.2018.19.015] |
| [13] |
Ke L, Xu M, Jiang X, et al. Epidermal Growth Factor Receptor (EGFR) Mutations and Anaplastic Lymphoma Kinase/Oncogene or C-Ros Oncogene 1 (ALK/ROS1) Fusions Inflict Non-Small Cell Lung Cancer (NSCLC) Female Patients Older Than 60 Years of Age[J]. Med Sci Monit, 2018, 24: 9364-9369. DOI:10.12659/MSM.911333 |
| [14] |
靳科, 詹钦文, 刘星, 等. 非小细胞肺癌雌激素受体表达与性别关系的Meta分析[J]. 现代肿瘤医学, 2019, 27(23): 4205-4209. [Jin K, Zhan QW, Liu X, et al. Meta analysis of the association between estrogen receptor expression and gender in non-small cell lung cancer[J]. Xian Dai Zhong Liu Yi Xue, 2019, 27(23): 4205-4209. DOI:10.3969/j.issn.1672-4992.2019.23.018] |
| [15] |
Tian G, Zhao X, Nie J, et al. Clinical characteristics associated with non-small-cell lung cancer harboring ALK rearrangements in Chinese patients[J]. Future Oncol, 2016, 12(10): 1243-1249. DOI:10.2217/fon.15.361 |
| [16] |
黄清洁, 陈天东, 陈海瑞, 等. 基于二代测序的300例非小细胞肺癌中驱动基因突变与临床病理特征关系[J]. 临床与实验病理学杂志, 2019, 35(3): 286-290. [Huang QJ, Chen TD, Chen HR, et al. Relationship between driver gene mutation and clinicopathological features in 300 cases of non-small cell lung cancer based on next generation sequencing[J]. Lin Chuang Yu Shi Yan Bing Li Xue Za Zhi, 2019, 35(3): 286-290.] |
| [17] |
贺佳子, 黄清洁, 李莉, 等. 396例非小细胞肺癌EGFR, KRAS, ALK和BRAF基因突变状态及其临床病理特征[J]. 临床与病理杂志, 2020, 40(9): 2252-2258. [He JZ, Huang QJ, Li L, et al. Mutation status of EGFR, KRAS, ALK and BRAF genes and their clinicopathological characteristics in 396 patients with non-small cell lung cancer[J]. Lin Chuang Yu Bing Li Za Zhi, 2020, 40(9): 2252-2258.] |
| [18] |
王勇, 冯佳, 钱粒, 等. 非小细胞肺癌中ALK阳性病例临床病理特征分析[J]. 交通医学, 2019, 33(6): 568-571. [Wang Y, Feng J, Qian L, et al. Analysis of clinicopathological features of ALK positive cases of non-small cell lung cancer[J]. Jiao Tong Yi Xue, 2019, 33(6): 568-571.] |
| [19] |
Wong DW, Lai-Han LE, Kam-Ting SK, et al. The EML4-ALK fusion gene is involved in various histologic types of lung cancers from nonsmokers with wild-type EGFR and KRAS[J]. Cancer, 2009, 115(8): 1723-1733. DOI:10.1002/cncr.24181 |
| [20] |
Inamura K, Takeuchi K, Togashi Y, et al. EML4-ALK Fusion Is Linked to Histological Characteristics in a Subset of Lung Cancers[J]. J Thorac Oncol, 2008, 3(1): 13-17. DOI:10.1097/JTO.0b013e31815e8b60 |
| [21] |
Sasaki T, Rodig SJ, Chirieac LR, et al. The biology and treatment of EML4-ALK non-small cell lung cancer[J]. Eur J Cancer, 2010, 46(10): 1773-1780. DOI:10.1016/j.ejca.2010.04.002 |
| [22] |
符萌, 冷再君, 李传应, 等. 非小细胞肺癌患者eml4-alk基因检测及eml4-alk阳性患者临床特征分析[J]. 安徽医科大学学报, 2017, 52(4): 528-533. [Fu M, Leng ZJ, Li CY, et al. Detection of eml4-alk fusion gene and analysis of its clinical features in NSCLC patients with eml4-alk fusion gene[J]. Anhui Yi Ke Da Xue Xue Bao, 2017, 52(4): 528-533.] |
| [23] |
高歌, 邓立力. 非小细胞肺癌EGFR、KRAS、ALK基因突变与不同转移器官分布的相关性研究进展[J]. 中国肺癌杂志, 2018, 21(7): 536-542. [Gao G, Deng LL. Association between EGFR, ALK and KRAS GeneStatus and Synchronous Distant Organ Metastasis in Non-small Cell Lung Cancer[J]. Zhongguo Fei Ai Za Zhi, 2018, 21(7): 536-542.] |
| [24] |
Tong Y, Zhao Z, Liu B, et al. 5'/3' imbalance strategy to detect ALK fusion genes in circulating tumor RNA from patients with non-small cell lung cancer[J]. J Exp Clin Cancer Res, 2018, 37(1): 68. DOI:10.1186/s13046-018-0735-1 |
 2021, Vol. 48
2021, Vol. 48