文章信息
- PD-1/PD-L1抑制剂相关的内分泌紊乱及其治疗的研究进展
- Endocrine Disorders Induced by PD-1/PD-L1 Inhibitor and Related Treatment
- 肿瘤防治研究, 2021, 48(11): 1035-1040
- Cancer Research on Prevention and Treatment, 2021, 48(11): 1035-1040
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2021.21.0365
- 收稿日期: 2021-04-02
- 修回日期: 2021-07-07
肿瘤的免疫治疗是传统的恶性肿瘤治疗方法如手术、放疗和化疗之外的一种新的治疗模式,免疫检查点抑制剂(immune checkpoint inhibitors, ICPis)已成为目前最热门的肿瘤免疫治疗手段之一,其中程序性细胞死亡受体-1(programmed cell death1, PD-1)/程序性细胞死亡受体配体-1(programmed cell death ligand 1, PD-L1)抑制剂是其中研究最热门、成绩最喜人的一类新药[1-2]。目前已经有多种PD-1/PD-L1抑制剂获批进入临床,还有多个PD-1/PD-L1抑制剂正在或即将进入临床试验,预示着未来会有更多种类的PD-1/PD-L1抑制剂将为肿瘤患者带来新的福音。我国在PD-1/PD-L1药物的研发中也走在世界前列,目前已经有多个我国自主研发的该类药物在中国获批上市。然而,在临床使用过程中发现该类新药对内分泌腺体有着明显的损害作用,其机制、识别及处理或尚不明了或存在不同的特点,本文就目前的相关研究进行综述,以为免疫检查点抑制剂的临床应用提供参考。
1 PD-1/PD-L1抑制剂与肿瘤治疗PD-1也称CD279,是一种Ⅰ型跨膜蛋白,属于免疫球蛋白B7-CD28受体家族,是主要在T细胞上表达的一种跨膜受体[1]。同样是Ⅰ型跨膜蛋白且同属于B7家族成员的PD-L1(CD274)和PD-L2(CD273)是PD-1的两种配体,主要在机体免疫细胞及肿瘤细胞表面表达,二者具有37%的同源序列,PD-L2比PD-L1与PD-1作用的亲和力强但是表达部位局限、表达水平较低,PD-L1表达范围较广,故目前认为PD-1的主要配体为PD-L1[3]。正常情况下,T细胞通过双重信号的刺激发挥免疫效应,使得机体的免疫激活与免疫抑制处在一个平衡的状态,当T细胞激活时诱导PD-1表达,与配体PD-L1或PD-L2结合后,抑制T淋巴细胞的活化,调节T淋巴细胞和抗原呈递细胞或效应细胞的接触,促进了具有免疫抑制作用的一种特殊免疫细胞—调节性T细胞的增殖,从而抑制机体的免疫效应。在肿瘤的发生发展过程中,免疫逃逸是一项重要的过程,肿瘤细胞通过各种机制躲过机体的免疫监视,其中一种就是肿瘤细胞通过上调PD-L1,形成PD-1/PD-L1通路达到免疫逃逸[1, 4]。故PD-1/PD-L1抑制剂抗肿瘤的作用机制就是通过抑制PD-1/PD-L1通路限制肿瘤细胞的免疫逃逸,恢复机体对肿瘤细胞的免疫监视功能。
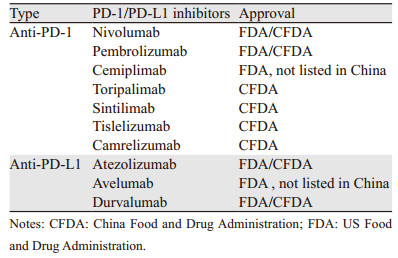
从2014年第一个PD-1抑制剂在美国上市,至今已有6个国外研发的PD-1/PD-L1抑制剂获批。2018我国研制的特瑞普利单抗注射液上市,成为首个国产的PD-1抑制剂,打开了国内的研发热潮,其后陆续有4个国内研发的PD-1抑制剂上市,我国及美国食品药品监督管理局已批准的PD-1/PD-L1抑制剂见表 1,截至目前,国产PD-L1抑制剂仍在研发中[5]。
与传统的化疗药物相比,总体上PD-1/PD-L1抑制剂的不良反应较小,但由于其治疗机制的原因,其免疫相关不良反应大于传统化疗。PD-1/PD-L1抑制剂阻断T细胞负性调控信号解除免疫抑制,从而达到抗肿瘤效应的同时,也可能异常增强了自身正常的免疫反应,导致机体正常的免疫耐受失衡,累及到正常组织时表现出自身免疫样的炎性反应,称为免疫相关不良反应(immune-related adverse events, irAEs)[6]。近年来随着多种PD-1/PD-L1抑制剂的问世及应用,有越来越多的irAEs被报道,累及皮肤、消化道、肝脏、肺部、内分泌腺体等在内的多个器官[7],引起皮炎、结肠炎、免疫介导性肝炎、免疫相关性肺炎等,还有个别引起胰腺炎、脑炎、眼炎、关节炎、心肌炎、血管炎的报道。
PD-1/PD-L1抑制剂可以累及多个内分泌腺体,如胰腺、甲状腺、垂体、肾上腺,引起相关腺体的功能紊乱。研究显示,在接受PD-1抑制剂治疗的患者中,有约10%的患者出现了不同级别免疫相关内分泌紊乱,较为常见的是甲状腺功能异常,自身免疫性糖尿病、垂体炎、原发性肾上腺皮质功能不全等也屡有报道[6, 8]。PD-L1抑制剂情况与PD-1抑制剂类似,但因PD-L1抑制剂处于通路下游且阻断较少的检查点信号,因此,PD-L1抑制剂irAEs发病率比PD-1抑制剂低[9]。PD-1/PD-L1抑制剂引起的内分泌功能紊乱具有如下特点:(1)内分泌功能紊乱通常与免疫紊乱相关,同时具有迟发性和持续性特点。(2)ICPis的种类、剂量及联用均会影响内分泌腺体相关irAEs的发病率,见表 2[6, 10]。(3)内分泌腺体相关不良反应通常在用药6~7周后才出现,大部分发生于治疗开始后12周内,也有可能发生在治疗开始后数月甚至数年[10]。(4)部分内分泌紊乱可能会自行恢复,但另一部分紊乱会持续存在[10]。(5)内分泌功能紊乱治疗效果与预后有赖于早期诊断和及时干预。PD-1/PD-L1抑制剂引起的内分泌功能紊乱作为一个内分泌学和肿瘤学的学科交叉点,有赖于多学科的积极合作,以期为患者制定更科学的方案、寻求更好的预后。

|
在疾病监测和诊疗上,近两三年我国已经有多个会议报告及期刊文献提醒我国的肿瘤、内分泌相关从业医师警惕ICPis相关的内分泌紊乱[11-13]。早在2017年,美国肿瘤免疫治疗学会就率先发布了免疫检查点抑制剂相关毒性的管理建议,近年国内最常参考的是英国内分泌学会2018年发布的《免疫检查点抑制剂治疗内分泌并发症的急性管理》指南。2020年,癌症支持疗法多国学会发布了《临床实践建议:免疫检查点抑制剂内分泌病管理及高级实践提供者在免疫介导毒性管理中的作用》也对处理ICPis相关的内分泌紊乱有一定的提示[14-16]。2021年1月我国发布了《免疫检查点抑制剂引起的内分泌系统免疫相关不良反应专家共识(2020)》,给我国的临床医生提供了多条详细实用的参考建议[17]。
3 PD-1/PD-L1抑制剂与甲状腺功能异常甲状腺功能异常是目前报道的PD-1/PD-L1抑制剂治疗中发生率最高的内分泌腺体irAEs,发生率可达1.8%~9%[18],可以表现为甲状腺功能减退、甲状腺功能亢进及急性甲状腺炎。研究显示,ICPis引起甲减的发生率约6.8%,而甲亢的发生率约3.9%,不同PD-1/PD-L1抑制剂引起的甲状腺功能异常发生率略有差别,相对而言PD-L1抑制剂比PD-1抑制剂引起甲亢、甲减的发生率更高,联合用药时更会导致甲状腺功能紊乱发生率增加[6, 9]。出现甲状腺功能紊乱的时间在接受治疗后的1周至3年不等,多出现在用药后8至12周内[10]。其临床表现多样,可表现为甲亢症状如心悸、怕热多汗、烦躁易怒、食欲亢进,也可表现为甲减症状如乏力、嗜睡、厌食、便秘、体重增加,也可为一过性甲状腺毒症表现后出现甲减,部分患者还可以出现甲状腺过氧化物酶抗体阳性等自身免疫性甲状腺炎表现。大部分患者均表现为轻症,国外也曾有发生甲状腺危象及黏液性水肿昏迷的报道[19-20]。
PD-1/PD-L1抑制剂引起甲状腺功能紊乱的机制尚不明确。有研究认为可能与PD-L1在甲状腺中的表达有关,这也解释了为何虽然总体PD-1抑制剂相对PD-L1抑制剂发生irAEs发病率更高,但PD-L1抑制剂发生甲状腺功能异常发病率高于PD-1抑制剂[9, 21]。有报道患者应用PD-1抑制剂后甲状腺球蛋白水平明显增加、甲状腺过氧化物酶抗体转为阳性或甲状腺球蛋白抗体水平升高,且与甲状腺毒症发生时间同步,提示甲状腺自身抗体可能参与了PD-1抑制剂相关甲状腺炎的发生[22]。但是也有人认为甲状腺自身免疫相关抗体阳性与PD-1/PD-L1抑制剂相关的甲状腺irAEs是通过两种不相关的发病机制影响甲状腺功能,不能同一而论[23]。
综合病例报道结果和专家共识,建议应用PD-1/PD-L1抑制剂患者定期监测甲状腺功能,具体监测频率目前尚无定论,多数文献中推荐4~6周,甲状腺相关自身抗体的监测可能对预测患者的预后及指导治疗有一定作用。有文献报道患者初期可出现甲状腺彩色多普勒形态学异常,且可能早于甲状腺功能异常,提示甲状腺彩色多普勒检测可能在早期发现该并发症上有一定作用,如有条件也可一并监测[24]。英国内分泌学会2018年指南还推荐摄碘率测定用于鉴别诊断[15]。在治疗上对于表现为甲状腺毒症患者,推荐应用β受体阻滞剂改善症状并且监测甲状腺功能,因为这部分患者多半最终会转为亚临床或者临床甲减,一般不推荐应用抗甲状腺药物; 对于出现甲减者,则需要甲状腺激素替代治疗。值得注意的是,PD-1/PD-L1抑制剂也可以引起肾上腺相关功能紊乱,所以在开始补充甲状腺激素前需要排除肾上腺皮质功能不全,否则可能导致肾上腺危象的发生; 对于一些极端的甲状腺功能异常可能需要考虑应用糖皮质激素甚至手术切除甲状腺[15-16]。大多数甲状腺功能异常可以通过相应治疗于短期内纠正,一般无需停用PD-1/PD-L1抑制剂。
4 PD-1/PD-L1抑制剂与自身免疫性糖尿病PD-1/PD-L1抑制剂可以影响胰腺外分泌功能导致胰腺炎,也可以影响胰腺内分泌功能导致糖尿病的发生。早在2014年FDA批准两种PD-1抑制剂上市不满一周年,国外就报道了首例PD-1抑制剂相关的自身免疫性糖尿病[25]。此后国内外均有多例使用PD-1/PD-L1抑制剂后发生自身免疫性糖尿病的报道,由于多为个案报道或小样本研究,目前尚无较为可靠的发病数据,估计其发病率大约 < 1%[6]。在已报道的病例中,从PD-1抑制剂开始治疗到诊断糖尿病的时间为1周至1年不等,多数患者于开始治疗3~12周后起病,临床表现多为烦渴、多饮、多尿以及酮症酸中毒相关症状如恶心、呕吐。PD-1/PD-L1抑制剂导致的自身免疫性糖尿病具有以下几个重要临床特征:(1)血糖升高迅速,发病急,进展快,酮症酸中毒发生率高达59%~71%;(2)内源性胰岛素缺乏进展迅速,大部分患者C肽水平低且迅速持续性减低甚至检测不到; (3)如果不及时发现并应用胰岛素治疗,糖尿病酮症酸中毒风险较高,而酮症起病者多表现为恶心呕吐,可能会被误诊为药物相关的胃肠道反应[12, 26]。结合以上特征,PD-1/PD-L1抑制剂诱发的自身免疫性糖尿病与一类特殊的自身免疫性糖尿病——暴发性1型糖尿病在临床特征上有许多相似之处。我国也有PD-1/PD-L1抑制剂引起暴发性1型糖尿病的病例报道[27]。有研究发现暴发性1型糖尿病的常见特征如缺乏糖尿病相关自身抗体、血清胰酶的升高等在PD-1/PD-L1抑制剂相关自身免疫性糖尿病中表现不明显[28-29]。但也有统计研究发现接受ICPis治疗后发生自身免疫性糖尿病的患者中约有三分之一的人有至少一种糖尿病相关自身抗体阳性[29]。还有学者通过分析6例接受ICPis治疗后发生糖尿病的患者的免疫学特征,发现免疫检查点治疗诱导的糖尿病与糖尿病相关自身抗体无关[30]。PD-1/PD-L1抑制剂相关性糖尿病与暴发性1型糖尿病之间的关系,以及它与糖尿病自身抗体的联系,有待进一步研究证实。
PD-1/PD-L1抑制剂诱发糖尿病的原因目前尚不明确。早在PD-1抑制剂上市前十多年,已有研究发现PD-1/PD-L1抑制途径与自身免疫性糖尿病的发病有一定关系,早年甚至有人提出通过激活PD-1/PD-L1抑制途径可能治疗自身免疫性糖尿病[31]。在PD-1/PD-L1抑制剂逐渐应用于多种肿瘤治疗后,其相关自身免疫性糖尿病再次引起了人们对PD-1/PD-L1抑制途径与糖尿病发生关系的关注。目前普遍认为,PD-1/PD-L1抑制剂诱发糖尿病与PD-1/PD-L1介导的免疫调节负性信号受抑制引起自身反应性淋巴细胞的攻击有关[12]。目前,PD-1/PD-L1抑制途径与糖尿病发生的直接证据仍仅来自多年前的动物实验研究结果,有待于更多的研究给出新的证据。
由于PD-1/PD-L1抑制剂可以诱发糖代谢紊乱且发病急、进展快,尽早诊断和治疗很关键。建议所有接受本药治疗的患者常规监测血糖,尤其出现不适症状时,如有酮症或者酮症酸中毒表现,应立即治疗。另外当超生理剂量的糖皮质激素用于治疗此药物所致其他免疫介导并发症时,更要关注患者的血糖水平[15]。糖化血红蛋白、C肽水平监测可作为补充,糖尿病相关自身抗体的检测则可用于发病后的预后评估和鉴别诊断[12]。研究发现,与胰岛自身抗体阴性者相比,抗体阳性的患者出现该并发症时发病时间更短,酮症酸中毒发生率更高,尤其是谷氨酸脱羧酶抗体阳性者[32]。早期腹部CT/MRI可见胰腺肿胀,也可作为早期诊断的线索之一[27]。PD-1/PD-L1抑制剂引起的自身免疫性糖尿病患者,其胰岛B细胞破坏具有组织特异性,而随着破坏完成会自行终止这种自身免疫反应,所以通常不需要使用激素来抑制自身免疫反应,因此治疗的方向主要是针对高血糖等代谢紊乱本身[12]。考虑到PD-1/PD-L1抑制剂所引起的胰岛素缺乏明显,在急性期更倾向于选择胰岛素来安全平稳地控制血糖,谨慎选择其他口服降糖药物。由于本病可导致完全性胰岛功能损害,很可能需要长期胰岛素治疗,所以在患者血糖控制平稳后需要进一步评估胰岛功能水平并且持续随访。
5 PD-1/PD-L1抑制剂与垂体炎虽然广受关注的PD-1/PD-L1抑制剂相关内分泌紊乱主要表现为甲状腺功能异常和自身免疫性糖尿病,但其引起的垂体、肾上腺功能紊乱也不容忽视,尤其是垂体炎的发生并不罕见,国外报道其在病例数上甚至有超越自身免疫性糖尿病的趋势[6, 33]。研究显示,PD-1/PD-L1抑制剂相关的垂体炎中,PD-1抑制剂治疗的发生率为0.4%,PD-L1抑制剂治疗的发生率则不足0.1%[6]。我国此方面的报道较少,2017年华山医院曾经报道过1例,2019年北京协和医院曾经报道过1例我国自主研发的PD-1抑制剂特瑞普利单抗Ⅱ期临床试验中发生垂体炎的病例[34-35]。PD-1/PD-L1抑制剂治疗者垂体炎发生时间多在治疗后3~5月出现,最迟甚至可以出现在治疗后11月[6, 35]。60岁以上的男性是其高危人群[14]。该病临床上主要表现为垂体前叶功能减退,多为促肾上腺皮质激素(adrenocorticotropic hormone, ACTH)、促甲状腺素、促性腺激素缺乏表现,尤其是ACTH缺乏,表现为纳差、乏力、恶心、低钠血症、低血糖、低血压等,而催乳素、生长激素异常及垂体后叶功能受累者较为罕见。另一种ICPis CTLA-4抑制剂发生垂体炎的可能性更大,所以目前针对免疫检查点抑制剂引起垂体炎的机制研究主要集中在CTLA-4抑制剂上,对于PD-1/PD-L1抑制剂引起垂体炎的相关机制有待进一步研究。
PD-1/PD-L1抑制剂相关垂体炎的临床诊断主要根据临床症状、垂体影像学检查及相关激素检验。急性期垂体MRI可表现为垂体增大(需排除垂体肿瘤及转移瘤的可能)。如果MRI有垂体炎的表现但临床激素检验提示无垂体功能减退证据时,需密切监测激素水平[16]。在治疗上,需关注ACTH缺乏导致的继发性肾上腺皮质功能不足,严重时可发生肾上腺皮质危象甚至危及生命,需要紧急的糖皮质激素替代治疗,而其他激素如促甲状腺激素、促性腺激素不足的治疗可在评估临床情况和观察进展水平后再制定[36]。既往研究认为,ICPis相关性垂体炎一旦发生,需要停用ICPis并且应用大剂量糖皮质激素[37]; 现在研究发现,症状较轻的垂体炎患者并不需要中断治疗,大剂量糖皮质激素在治疗上也并不比生理剂量或稍高于生理剂量的糖皮质激素能获得更好的预后[35, 38]。对于出现较为严重垂体炎的患者,PD-1/PD-L1抑制剂也并不是绝对的使用禁忌,可在急性期暂停使用ICPis类药物,在适当的糖皮质激素替代治疗至症状改善病情稳定后,即可重新开始治疗[39]。总体而言,促甲状腺素和促性腺激素缺乏通常会逐渐恢复,但促肾上腺皮质激素缺乏症常持续存在,需要长期随访和规范的激素替代治疗。
6 PD-1/PD-L1抑制剂与肾上腺皮质功能不全与PD-1/PD-L1抑制剂引起的甲状腺功能障碍可表现为甲减也可表现甲亢类似,其所引起的肾上腺功能障碍除了可表现为原发性肾上腺皮质功能不全,也有可能会表现为皮质醇增多,但目前皮质醇增多症的报道极少,有待进一步研究[40]。据统计,PD-1/PD-L1抑制剂相关的肾上腺皮质功能不全的总体发生率约1%,基本为继发性肾上腺皮质功能不全,原发性肾上腺皮质功能不全的占比很低,大部分是药物诱发的自身免疫性肾上腺炎[23]。单药治疗时本并发症发生率低,若联合应用多种ICPis会使得本并发症发生率升高到5.2%~7.6%[41]。本并发症发生率虽低,但可能引起肾上腺危象等严重并发症,也值得我们高度警惕[25]。原发性肾上腺皮质功能不全在临床上也表现为纳差、乏力等非特异性表现,需要注意与垂体炎导致的继发性肾上腺皮质功能不全相鉴别。建议接受PD-1/PD-L1抑制剂治疗的患者,在监测血糖、甲状腺功能、垂体功能的基础上,同时定期监测肾上腺功能,可每2~3周评估早晨8点血皮质醇、ACTH和血清电解质,如诊断不明确则进一步完善ACTH兴奋试验[17]。一旦诊断为原发性或者继发性肾上腺皮质功能不全,需要尽快开始糖皮质激素替代治疗,部分患者可能还需要考虑应用盐皮质激素治疗[12]。
7 小结与展望作为治疗恶性肿瘤的新希望,ICPis的代表药物PD-1/PD-L1抑制剂近年来不断被广泛应用到多种肿瘤的治疗中,在临床应用中这类药物所带来的不良反应也被我们逐渐认识。作为免疫相关的药物,它可以引起多个irAEs,其中包括多种内分泌紊乱。PD-1/PD-L1抑制剂能够影响到几乎所有的内分泌腺,导致不同表现形式及不同程度的内分泌紊乱,这提示我们在应用此类药物的过程中应该加强内分泌疾病相关监测,在患者出现可疑的临床症状时应开阔思维,才能够及时全面地诊断处理其内分泌相关并发症,保证患者的治疗。在医疗研究中,PD-1/PD-L1抑制剂相关的内分泌紊乱的发病机制有待进一步深入研究,或许这方面的研究会为其他人群内分泌疾病的治疗提供新的思路。
作者贡献:
赖妍靓:查阅文献,整理信息,撰写论文
耿艳:提出修改建议,修改论文
杨兵全:提出观点,修改论文
| [1] |
杨占菊, 黄长江, 王名雪. 以PD-1和PD-L1为靶点的肿瘤免疫治疗研究进展[J]. 癌症进展, 2020, 18(8): 772-777. [Yang ZJ, Huang CJ, Wang MX. Research progress of tumor immunotherapy targeting PD-1 and PD-L1[J]. Ai Zheng Jin Zhan, 2020, 18(8): 772-777.] |
| [2] |
Chen L, Han X. Anti-PD-1/PD-L1 therapy of human cancer: past, present, and future[J]. J Clin Invest, 2015, 125(9): 3384-3391. DOI:10.1172/JCI80011 |
| [3] |
Bardhan K, Anagnostou T, Boussiotis VA. The PD1: PD-L1/2 pathway from discovery to clinical implementation[J]. Front Immunol, 2016, 7: 550. DOI:10.3389/fimmu.2016.00550/pdf |
| [4] |
黄聪, 白丽. PD-1/PD-L1信号通路与肿瘤免疫逃逸[J]. 现代免疫学, 2020, 40(4): 329-333, 340. [Huang C, Bai L. PD-1/PD-L1 signaling pathway and tumor immune escape[J]. Xian Dai Mian Yi Xue, 2020, 40(4): 329-333, 340.] |
| [5] |
Keam SJ. Toripalimab: first global approval[J]. Drugs, 2019, 79(5): 573-578. DOI:10.1007/s40265-019-01076-2 |
| [6] |
Barroso-Sousa R, Barry WT, Garrido-Castro AC, et al. Incidence of endocrine dysfunction following the use of different immune checkpoint inhibitor regimens[J]. JAMA Oncol, 2018, 4(2): 173-182. DOI:10.1001/jamaoncol.2017.3064 |
| [7] |
王雪, 袁芃, 岳健, 等. 20例晚期肿瘤患者免疫检查点抑制剂不良反应临床观察并文献复习[J]. 肿瘤防治研究, 2020, 47(6): 427-431. [Wang X, Yuan P, Yue J, et al. Clinical Observation of Adverse Events of Immune Checkpoint Inhibitors in 20 Advanced Tumor Patients and Literature Reviews[J]. Zhong Liu Fang Zhi Yan Jiu, 2020, 47(6): 427-431.] |
| [8] |
Ruggeri RM, Campennì A, Giuffrida G, et al. Endocrine and metabolic adverse effects of immune checkpoint inhibitors: an overview (what endocrinologists should know)[J]. J Endocrinol Invest, 2019, 42(7): 745-756. DOI:10.1007/s40618-018-0984-z |
| [9] |
Yang Y, Liu J, Yang K, et al. Endocrine adverse events caused by different types and different doses of immune checkpoint inhibitors in the treatment of solid tumors: a meta-analysis and systematic review[J]. J Clin Pharmacol, 2021, 61(3): 282-297. DOI:10.1002/jcph.1804 |
| [10] |
Chang LS, Barroso-Sousa R, Tolaney SM, et al. Endocrine toxicity of cancer immunotherapy targeting immune checkpoints[J]. Endocr Rev, 2019, 40(1): 17-65. DOI:10.1210/er.2018-00006 |
| [11] |
李佳蓉, 关海霞. 内分泌学与肿瘤学医师须知: 免疫检查点抑制剂致内分泌腺体损伤[J]. 中华内分泌代谢杂志, 2019, 35(7): 548-553. [Li JR, Guan HX. Endocrine-related injuries associated with immune checkpoint inhibitors: what endocrinologists and oncologists should know[J]. Zhonghua Nei Fen Mi Dai Xie Za Zhi, 2019, 35(7): 548-553. DOI:10.3760/cma.j.issn.1000-6699.2019.07.002] |
| [12] |
方晨, 郭鹤鸣, 黄韵, 等. 警惕肿瘤免疫治疗的内分泌系统不良反应[J]. 国际内分泌代谢杂志, 2019, 39(5): 327-331, 336. [Fang C, Guo HM, Huang Y, et al. Be aware of endocrinological side effects of cancer immunotherapy[J]. Guo Ji Nei Fen Mi Dai Xie Za Zhi, 2019, 39(5): 327-331, 336. DOI:10.3760/cma.j.issn.1673-4157.2019.05.010] |
| [13] |
刘艳, 张瑞, 蔡晓凌, 等. 免疫疗法治疗肿瘤引起的内分泌系统不良反应[J]. 中国糖尿病杂志, 2020, 28(4): 309-314. [Liu Y, Zhang R, Cai XL, et al. Adverse effects of immune checkpoint inhibitors in endocrine system[J]. Zhongguo Tang Niao Bing Za Zhi, 2020, 28(4): 309-314. DOI:10.3969/j.issn.1006-6187.2020.04.014] |
| [14] |
Puzanov I, Diab A, Abdallah K, et al. Managing toxicities associated with immune checkpoint inhibitors: consensus recommendations from the Society for Immunotherapy of Cancer(SITC) Toxicity Management Working Group[J]. J Immunother Cancer, 2017, 5(1): 95. DOI:10.1186/s40425-017-0300-z |
| [15] |
Higham CE, Olsson-Brown A, Carroll P, et al. Society for Endocrinology Endocrine Emergency guidance: acute management of the endocrine complications of checkpoint inhibitor therapy[J]. Endocr Connect, 2018, 7(7): G1-G7. DOI:10.1530/EC-18-0068 |
| [16] |
Cooksley T, Girotra M, Ginex P, et al. Multinational Association of Supportive Care in Cancer (MASCC) 2020 clinical practice recommendations for the management of immune checkpoint inhibitor endocrinopathies and the role of advanced practice providers in the management of immune-mediated toxicities[J]. Support Care Cancer, 2020, 28(12): 6175-6181. DOI:10.1007/s00520-020-05709-1 |
| [17] |
中华医学会内分泌学分会免疫内分泌学组. 免疫检查点抑制剂引起的内分泌系统免疫相关不良反应专家共识(2020)[J]. 中华内分泌代谢杂志, 2021, 37(1): 1-16. [Immune-endocrinology Group, Chinese Society of Endocrinology, Chinese Medical Association. Chinese expert consensus on the immune checkpoint inhibitors-induced endocrine immune-related adverse events(2020)[J]. Zhonghua Nei Fen Mi Dai Xie Za Zhi, 2021, 37(1): 1-16.] |
| [18] |
Torino F, Corsello SM, Salvatori R. Endocrinological side-effects of immune checkpoint inhibitors[J]. Curr Opin Oncol, 2016, 28(4): 278-287. DOI:10.1097/CCO.0000000000000293 |
| [19] |
McMillen B, Dhillon MS, Yong-Yow S, et al. A rare case of thyroid storm[J]. BMJ Case Rep, 2016, 2016: 10. |
| [20] |
Khan U, Rizvi H, Sano D, et al. Nivolumab induced myxedema crisis[J]. J Immunother Cancer, 2017, 5: 13. DOI:10.1186/s40425-017-0213-x |
| [21] |
Yamauchi I, Sakane Y, Fukuda Y, et al. Clinical features of nivolumab-induced thyroiditis: a case series study[J]. Thyroid, 2017, 27(7): 894-901. DOI:10.1089/thy.2016.0562 |
| [22] |
孙潇泱, 蒋晶晶, 蔡青青, 等. PD-1抑制剂所致甲状腺毒症1例报告[J]. 中国临床医学, 2019, 26(3): 511-513. [Sun XY, Jiang JJ, Cai QQ, et al. Thyrotoxicosis induced by PD-1 inhibitor: a case report[J]. Zhongguo Lin Chuang Yi Xue, 2019, 26(3): 511-513.] |
| [23] |
Kobayashi T, Iwama S, Yasuda Y, et al. Patients with antithyroid antibodies are prone to develop destructive thyroiditis by Nivolumab: a prospective study[J]. J Endocr Soc, 2018, 2(3): 241-251. DOI:10.1210/js.2017-00432 |
| [24] |
Narita T, Oiso N, Taketomo Y, et al. Serological aggravation of autoimmune thyroid disease in two cases receiving nivolumab[J]. J Dermatol, 2016, 43(2): 210-214. DOI:10.1111/1346-8138.13028 |
| [25] |
Martin-Liberal J, Furness AJ, Joshi K, et al. Anti-programmed cell death-1 therapy and insulin-dependent diabetes: a case report[J]. Cancer Immunol Immunother, 2015, 64(6): 765-767. DOI:10.1007/s00262-015-1689-1 |
| [26] |
Stamatouli AM, Zoe Quandt Z, Perdigoto AL, et al. Collateral damage: insulin-dependent diabetes induced with checkpoint inhibitors[J]. Diabetes, 2018, 67(8): 1471-1480. DOI:10.2337/dbi18-0002 |
| [27] |
谷志远, 李薇, 杨涛, 等. 程序性死亡蛋白1抗体治疗后暴发性1型糖尿病一例[J]. 中华糖尿病杂志, 2020, 12(5): 328-332. [Gu ZY, Li W, Yang T, et al. A case report of fulminant type 1 diabetes after treatment with programmed cell death protein-1 antibody[J]. Zhonghua Tang Niao Bing Za Zhi, 2020, 12(5): 328-332. DOI:10.3760/cma.j.cn115791-20191022-00382] |
| [28] |
Kotwal A, Haddox C, Block M, et al. Immune checkpoint inhibitors: An emerging cause of insulin-dependent diabetes[J]. BMJ Open Diabetes Res Care, 2019, 7(1): e000591. DOI:10.1136/bmjdrc-2018-000591 |
| [29] |
Zhang R, Cai XL, Liu L, et al. Type 1 diabetes induced by immune checkpoint inhibitors[J]. Chinese Med J(Engl), 2020, 133(21): 2595-2598. |
| [30] |
Marchand L, Thivolet A, Dalle S, et al. Diabetes mellitus induced by PD-1 and PD-L1 inhibitors: description of pancreatic endocrine and exocrine phenotype[J]. Acta Diabetol, 2019, 56(4): 441-448. DOI:10.1007/s00592-018-1234-8 |
| [31] |
杜宣, 施毕旻. PD-1/PD-L1抑制途径与自身免疫性糖尿病[J]. 国际内分泌代谢杂志, 2011, 31(1): 49-51. [Du X, Shi BM. PD-1/PD-L1 inhibitory pathway and autoimmune diabetes[J]. Guo Ji Nei Fen Mi Dai Xie Za Zhi, 2011, 31(1): 49-51.] |
| [32] |
Zhao Z, Wang X, Bao XQ, et al. Autoimmune polyendocrine syndrome induced by immune checkpoint inhibitors: a systematic review[J]. Cancer Immunol Immunother, 2021, 70(6): 1527-1540. DOI:10.1007/s00262-020-02699-1 |
| [33] |
Ishikawa M, Oashi K. Case of hypophysitis caused by nivolumab[J]. J Dermatol, 2017, 44(1): 109-110. DOI:10.1111/1346-8138.13437 |
| [34] |
Zeng MF, Chen L, Ye HY, et al. Primary hypothyroidism and isolated ACTH deficiency induced by nivolumab therapy: Case report and review[J]. Medicine (Baltimore), 2017, 96(44): e8426. DOI:10.1097/MD.0000000000008426 |
| [35] |
王林杰, 袁涛, 段炼, 等. 一例PD-1抑制剂相关垂体炎的诊治[J]. 中华内分泌代谢杂志, 2019, 35(7): 554-558. [Wang LJ, Yuan T, Duan L, et al. Diagnosis and treatment of one case of hypophysitis caused by PD-1 inhibitor[J]. Zhonghua Nei Fen Mi Dai Xie Za Zhi, 2019, 35(7): 554-558. DOI:10.3760/cma.j.issn.1000-6699.2019.07.003] |
| [36] |
Briet C, Albarel F, Kuhn E, et al. Expert opinion on pituitary complications in immunotherapy[J]. Ann Endocrinol (Paris), 2018, 79(5): 562-568. DOI:10.1016/j.ando.2018.07.008 |
| [37] |
Corsello SM, Salvatori R, Barnabei A, et al. Ipilimumab-induced endocrinopathies: when to start corticosteroids (or not)[J]. Cancer Chemother Pharmacol, 2013, 72(2): 489-490. DOI:10.1007/s00280-013-2213-y |
| [38] |
Min L, Hodi FS, Giobbie-Hurder A, et al. Systemic high-dose corticosteroid treatment does not improve the outcome of ipilimumab-related hypophysitis: a retrospective cohort study[J]. Clin Cancer Res, 2015, 21(4): 749-755. DOI:10.1158/1078-0432.CCR-14-2353 |
| [39] |
中国抗癌协会肿瘤内分泌专业委员会, 重庆市生物医药技术学会肿瘤内分泌专业委员会, 重庆市中西医结合学会肿瘤内分泌专业委员会. 免疫检查点抑制剂主要内分泌不良反应急症处理中国专家共识[J]. 重庆医科大学学报, 2021. [Onco-endocrinology Committee of Chinese Anti-Cancer Association, Onco-endocrinology Committee of Chongqing Association of Biomedical Techology, Onco-endocrinology Committee of Chongqing Association of Integraive Medicine. Chinese expert consensus on immune checkpoint inhibitors induced emergency management of endocrine adverse reactions[J]. Chongqing Yi Ke Da Xue Xue Bao, 2021.] |
| [40] |
Chan W, Ho P, Leung K, et al. Immune-related endocrine dysfunction in Chinese: a single tertiary centre experience[J]. Ann Oncol, 2020, 31(4): S1060. |
| [41] |
de Filette J, Andreescu CE, Cools F, et al. A systematic review and meta-analysis of endocrine-related adverse events associated with immune checkpoint inhibitors[J]. Horm Metab Res, 2019, 51(3): 145-156. DOI:10.1055/a-0843-3366 |
 2021, Vol. 48
2021, Vol. 48