文章信息
- 非编码RNAs对甲状腺乳头状癌的分子调控机制研究进展
- Research Progress of Molecular Regulatory Mechanism of Non-coding RNAs in Papillary Thyroid Carcinoma
- 肿瘤防治研究, 2021, 48(11): 1030-1034
- Cancer Research on Prevention and Treatment, 2021, 48(11): 1030-1034
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2021.21.0232
- 收稿日期: 2021-03-03
- 修回日期: 2021-08-02
2. 730000 兰州,甘肃省人民医院超声医学科;
3. 730000 兰州,甘肃省人民医院内分泌科;
4. 730000 兰州,甘肃中医药大学敦煌医学与转化教育部重点实验室
2. Department of Ultrasound, Gansu Provincial Hospital, Lanzhou 730000, China;
3. Department of Endocrinology, Gansu Provincial Hospital, Lanzhou 730000, China;
4. The Key Laboratory of Dunhuang Medicine and Transformation of Ministry of Education, Gansu University of Chinese Medicine, Lanzhou 730000, China
甲状腺癌(thyroid cancer, TC)是最常见的内分泌恶性肿瘤,近年来全球病例数呈快速增长趋势,其主要病理分型为甲状腺乳头状癌(papillary thyroid cancer, PTC),占TC的70%~80%[1-3]。虽然通过甲状腺切除术、微波消融、放射性碘和激素替代治疗可以有效治疗PTC,但对于复发的PTC患者和无症状患者来说,大部分患者就诊时可能已经发生了肿瘤转移,使其丧失了手术和激素治疗的最佳时期。因此,PTC患者的有效诊断、精确治疗以及较好的远期疗效一直是医学关注的焦点,阐明PTC发生发展的分子机制,寻找更为有效的诊断和治疗靶点是亟待解决的问题。
过去几十年里,遗传学的进步为人们在理解疾病的发病机制、疾病诊断和治疗方面发挥了重要作用[4]。基因突变以改变相关产物功能的方式为其参与肿瘤的发生发展提供了明确证据。基因和蛋白的表达在任一环节的失衡都会导致机体发生病变,研究者发现在癌症相关基因中存在影响甲状腺癌发生发展的遗传基因[5]。一些分子活动和生物学过程已被确定为在PTC肿瘤发生发展过程中起着关键作用,包括遗传或表观遗传改变、非编码RNAs、细胞凋亡、自噬和上皮-间质转化(epithellial-mesenchymal transition, EMT)等[6-7]。基因突变也可导致甲状腺癌的发生发展,丝/苏氨酸特异性激酶(BRAF)突变发生在PTC早期,BRAF突变通过异常激活MAPK信号通路参与了甲状腺肿瘤的发生[8]。体外实验研究发现,长链非编码RNA(long non-coding RNAs,lncRNAs)H19在TC组织中表达上调,抑制细胞活力,促进细胞凋亡,通过PI3K/AKT信号通路发挥促癌作用[9]。目前,虽然对可能影响PTC发展的基因或信号通路做了大量研究,但对PTC的病因学、分子发病机制和许多特征仍不清楚。探索其潜在的分子机制和分子标志物对于改善PTC患者的预后、实现有效的个体化治疗具有重要意义。
1 非编码RNAs在甲状腺乳头状癌中的调控机制研究者在PTC组织中发现了许多分子变异。人类基因组转录表达的产物仅有小部分翻译成蛋白质参与生命活动,而大量产物为非编码RNAs(non-coding RNAs, ncRNAs)。ncRNAs是基因表达的主调控因子,其介导的基因表达涉及多种机制,如转录调控、翻译调控、蛋白修饰、RNA-蛋白或蛋白-蛋白复合物的形成等[10],由此推测,ncRNAs可能在正常细胞发育发展成疾病细胞的各种生物功能和病理过程中发挥关键作用[11-12]。本文将对调控型ncRNAs中的长链非编码RNAs和microRNAs在PTC中的调控机制进行总结[13-14]。
1.1 长链非编码RNAs在甲状腺乳头状癌中的调控机制近年来研究发现,lncRNAs可以在多个水平参与基因表达,调控多种生物学功能,包括染色体沉默、转录和细胞生长调控等。lncRNAs在多种生理和病理过程中发挥着关键作用[15-16],并被证实在癌症生物学中发挥着重要的调控作用,参与肿瘤生长、细胞周期和细胞凋亡的调控[17]。然而,lncRNAs在PTC中的作用仍不清楚,对PTC诊断和预后的预测价值仍处于探索阶段。许多学者近年对lncRNAs在PTC中的作用进行了大量研究,并已发现lncRNA SNHG12是一个普遍存在于人类癌症中的关键分子[18]。Ding等[19]对lncRNA SNHG12在PTC中的表达及其作用进行了研究,结果发现SNHG12在PTC组织和细胞中表达上调,干扰SNHG12后细胞增殖能力受到抑制,且细胞周期在G1/G0期发生阻滞。进一步对调控机制研究发现,SNHG12干扰后,通过下调Wnt/β-catenin信号通路中β-catenin蛋白及下游基因表达的MMP-2、cyclinD1表达来促进PTC细胞的增殖和转移。lncRNA浆细胞瘤变易位1(lncRNA plasmacytoma variant translocation 1,lncRNA-PVT1)是近年来新发现的一种lncRNA,由于lncRNA-PVT1特异性高,在许多肿瘤细胞中表达升高,在正常细胞中表达下降,且在血清、血浆和唾液中易于检测,目前已经成为一种新型的癌症诊断生物标志物。对lncRNA-PVT1在PTC组织与癌旁组织中的表达研究发现,高表达的lncRNA-PVT1与PTC的侵袭性具有相关性[20]。其他相关研究也发现,lncRNA-PVT1能通过上调miRNAs发挥调控作用,还能调控基因转录和蛋白表达[21-22]。
1.2 microRNAs在甲状腺乳头状癌中的调控机制基因组中的大多数蛋白质编码基因是由microRNAs(miRNAs)控制的,越来越多的证据表明,lncRNA通过与miRNAs或mRNA相互作用,参与肿瘤生长、细胞周期和细胞凋亡的调控[17]。miRNAs是一短链非编码RNA,主要结合到mRNA的3-UTR上,作为基因表达的转录后调节因子来参与控制蛋白质编码或非编码基因表达,其主要生物学行为是抑制翻译或裂解mRNA[23-24]。研究表明,miRNAs通过不同的信号通路靶蛋白参与恶性肿瘤中癌细胞的增殖、凋亡、转移和分化[25-26],提示miRNAs在癌症发生和发展中也发挥重要的调控作用。研究发现,癌细胞上具有特有的miRNAs表达谱,miRNAs可在癌变过程中下调多个抑癌基因或癌基因,发挥出癌基因亦或抑癌基因的作用[27]。Mutlu等[28]对乳腺癌的研究发现,miR-564是一种潜在的肿瘤抑制因子,miR-564作为PI3K和MAPK信号网络的双重抑制剂,调控乳腺癌细胞的增殖、EMT、迁移和侵袭。近年来,越来越多的研究开始关注失调的miRNAs在甲状腺癌中的诊断和预后价值。对miR-564调控PTC恶性发展的研究结果表明,miR-564在PTC组织和细胞系中表达明显降低,并且这种降低影响着淋巴结转移和肿瘤淋巴结转移分期[29]。miR-564的上调在体外显著抑制了PTC细胞的增殖、迁移和侵袭,诱导了PTC细胞的凋亡,在体内抑制了肿瘤生长。Chou等[30]的研究结果显示,miR-146b异常表达与PTC的侵袭性和预后具有相关性,敲除miR-146b可抑制TGF-β1诱导的PTC细胞的EMT,miR-146b可以成为PTC的一种新的生物标志物和治疗靶点,这为阐明确切机制和临床应用提供新思路。PTC中最具特异性的ncRNAs可能是引起PTC发生发展重要的调控作用机制,应进一步对ncRNAs在PTC中全面的调控网络深入研究,以期能对PTC进行精准诊断、治疗和实现最佳远期疗效。
1.3 基于非编码RNA对甲状腺乳头状癌的治疗研究精准治疗研究在肿瘤防治中备受青睐,肿瘤的临床治疗除手术及放化疗外,已发展到介入治疗、基因治疗和免疫治疗等新阶段。同时也有研究证明,麻醉药品在防止肿瘤转移,促进肿瘤细胞凋亡,改善肿瘤患者预后方面发挥关键作用[31-33]。Li等[34-35]在麻醉药治疗PTC的机制研究中发现,七氟烷通过下调miR-155抑制PTC的进展,丙泊酚通过上调miR-122抑制PTC细胞的转移、侵袭和EMT。这对PTC的治疗提供新方法,而麻醉药物对PTC治疗产生的疗效机制是否有信号通路参与,有待进一步研究。近年来,中医药对肿瘤的辅助治疗同样也取得了较好的临床疗效[36],研究证实,相关ncRNAs及介导的信号通路参与了肿瘤的发生发展,在中医药防治肿瘤中发挥了关键作用[37-38]。Fang等[39]用参麦注射液治疗PTC患者,发现参麦注射液可通过miR-103/GPER1轴抑制CD4+T细胞向Treg细胞分化,来改善131I放疗PTC患者术后免疫功能。由此推测,应结合PTC的分子机制研究,筛选药物治疗PTC的有效靶点,以期形成一套系统的药物治疗方案,进一步改善PTC患者治疗。
2 非编码RNAs介导的相关信号通路对甲状腺乳头状癌的调控作用信号通路中的一些重要刺激信号通过调控下游物质的活性来执行细胞应答,包括对DNA转录调节、基因表达的调节和细胞内酶活性的调节等。信号通路参与癌症的发生、进展和转移已被广泛证明。相关研究发现,表观遗传修饰可通过激活信号通路中的抑制因子或激活因子导致基因突变来影响肿瘤的进化。张芬等[40]的研究表明Kirsten大鼠肉瘤病毒癌基因同源物(KRAS)基因在PTC中高表达,通过沉默KRAS基因使MAPK1/MAPK3信号通路下调达到抑制PCT的EMT。
近年来的研究开始关注于表观遗传学介导的信号通路对癌症发病过程的影响。研究发现在PCT组织和细胞系中miR-195-5p呈低表达,PVT1可通过吸附miR-195-5p促进PTC增殖、侵袭和迁移。对miR-195-5p/TERT信号通路调控端粒酶反转录酶(telomerase reverse transcriptase, TERT)在PTC中的表达研究发现,过表达miR-195-5p可靶向TERT,进而抑制PTC细胞K1的增殖、侵袭和迁移,过表达TERT则转变了沉默PVT1对PTC细胞K1的增殖、侵袭和迁移的抑制作用[41]。表明PVT1可通过调控miR-195-5p/TERT信号通路来促进PTC细胞增殖、侵袭和迁移。这表明ncRNAs对PTC的调控作用可能是通过机体的信号通路来实现的。
2.1 非编码RNAs介导的PI3K/Akt信号通路对甲状腺乳头状癌的调控作用磷脂酰肌醇-3激酶/蛋白激酶B(PI3K/Akt)信号通路是一种通过调节细胞增殖、生长、代谢、运动和癌症的重要信号通路之一[42-43]。研究发现,该通路的组成基因在人类癌症中普遍被激活[42]。Akt是PI3K/Akt信号通路的关键因子,miR-497已被证实在人类癌症中差异表达,可作为诊断和预后的标志物。研究发现,Akt3与miR-497在PTC中的表达呈负相关。由于Akt3被确定为miR-497的直接靶点,miR-497直接靶向Akt3抑制了PTC细胞的增殖、迁移和侵袭。提示,Akt3可作为PTC中miR-497的一个新的直接靶点,miR-497/Akt3信号通路可能参与了PTC的发生和发展。这一新的miR-497/Akt3信号通路可能为治疗PTC患者提供新的靶点[44-45]。对lncRNA LINC00982在PTC患者调控作用的研究发现,LINC00982在人PTC组织中明显低于癌旁组织。过表达LINC00982可抑制细胞的增殖和迁移,促进细胞凋亡。其可能的机制是在PTC中,过表达LINC00982通过调节PI3K/Akt信号通路抑制细胞增殖,诱导细胞凋亡。因此,lncRNA LINC00982有望成为PTC的一种新的诊断生物标志物和治疗TC患者的有前景的靶点[46]。
2.2 非编码RNAs介导的Wnt信号通路对甲状腺癌的调控作用Wnt信号通路作为机体另一重要信号通路,其异常调控是肿瘤生物学中又一研究热点。Wnt信号通路被认为是肿瘤进展过程中的重要调控途径[47]。众多研究表明,microRNA失调和Wnt/β-catenin信号通路共同推动了肿瘤的发生、转移和耐药性[48]。MicroRNA-3619-3p(miR-3619-3p)是一种致癌基因,在对miR-3619-3p在PTC细胞迁移和侵袭中的作用及其机制的研究发现,miR-3619-3p在PTC细胞系中的表达上调;同时在PTC组织中也呈高表达,且与甲状腺外浸润、病灶的多中心性、颈淋巴结转移呈正相关。进一步证明miR-3619-3p通过激活Wnt/β-catenin通路来维持β-catenin mRNA的稳定性,从而认为致癌基因MiR-3619-3p增强PTC细胞系的迁移和侵袭能力可能机制[49]。对甲状腺癌易感性候选基因3(PTCSC3)、miR-574-5p和Wnt/β-catenin在PTC中潜在的致病机制研究发现,lncRNA PTCSC3/miR-574-5p通过癌细胞侵袭抑制因子(SCAI)调控Wnt/β-catenin活性,并介导PTC的细胞增殖和迁移,体内实验也证实过表达的PTCSC3能够抑制肿瘤生长[50]。或许可以通过阻断在PTC发生发展中研究较明确的ncRNAs介导的信号通路网络来实现,对PTC的进一步治疗和预后至关重要。
3 结语与展望甲状腺乳头状癌作为在人群中发病率不断增加的内分泌肿瘤,越来越多地受到人们的关注。尽管对PTC有遗传标志物、生物标志物和预后标志物的研究,但对这种恶性疾病的发病机制依然未能阐明,且精准治疗和远期预后不甚理想。作为一种新兴分子,非编码RNAs的失调影响着PTC发生发展,lncRNA和miRNA通过特异表达可促进PTC细胞发生各种细胞活动导致肿瘤细胞扩散、生长或抑制细胞死亡。并且还发现多种信号通路也参与了PTC的发生发展,PTC中异常细胞活动可能是通过细胞信号通路来完成的,见图 1。对PTC中ncRNA调控信号通路的不断深入研究,有望在不久的将来会有更多与各种信号通路相关的ncRNA被发现。提示PTC的发病可能是由ncRNA参与下的复杂网络调控的结果,探索ncRNAs在细胞信号通路中的作用机制,为PTC发病机制及治疗提供了重要的研究思路。
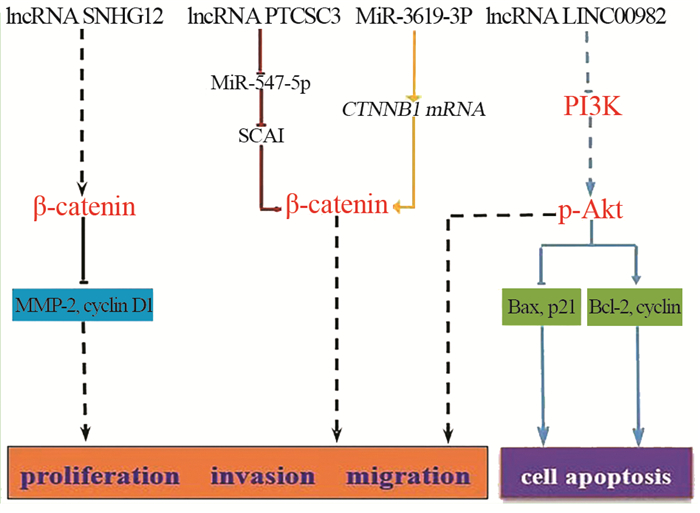
|
| 图 1 非编码RNAs介导的相关信号通路调控甲状腺乳头状癌发生发展的分子机制图 Figure 1 Molecular mechanism diagram of non-coding RNAs-mediated related signaling pathways regulating of the occurrence and development papillary thyroid cancer |
作者贡献:
牛彦强:研究思路设计与论文撰写
周祖邦、田利民:指导论文撰写与修改
安方玉、方媛、张立文、张明华:文献查阅与整理,论文修改
| [1] |
Seib CD, Sosa JA. Evolving Understanding of the Epidemiology of Thyroid Cancer[J]. Endocrinol Metab Clin North Am, 2019, 48(1): 23-35. DOI:10.1016/j.ecl.2018.10.002 |
| [2] |
Kim J, Gosnell JE, Roman SA. Geographic influences in the global rise of thyroid cancer[J]. Nat Rev Endocrinol, 2020, 16(1): 17-29. DOI:10.1038/s41574-019-0263-x |
| [3] |
Pereira M, Williams VL, Hallanger-Johnson J, et al. Thyroid Cancer Incidence Trends in the United States: Association with Changes in Professional Guideline Recommendations[J]. Thyroid, 2020, 30(8): 1132-1140. DOI:10.1089/thy.2019.0415 |
| [4] |
Alobuia W, Annes J, Kebebew E. Genetic testing in endocrine surgery: Opportunities for precision surgery[J]. Surgery, 2020, 168(2): 328-334. DOI:10.1016/j.surg.2020.03.009 |
| [5] |
Yu J, Mai W, Cui Y, et al. Key genes and pathways predicted in papillary thyroid carcinoma based on bioinformatics analysis[J]. J Endocrinol Invest, 2016, 39(11): 1285-1293. DOI:10.1007/s40618-016-0491-z |
| [6] |
Hu Y, Wang H, Chen E, et al. Candidate microRNAs as biomarkers of thyroid carcinoma: a systematic review, meta-analysis, and experimental validation[J]. Cancer Med, 2016, 5(9): 2602-2614. DOI:10.1002/cam4.811 |
| [7] |
Wang L, Huang Y, Liu C, et al. Deltex3 inhibits Epithelial Mesenchymal Transition in Papillary Thyroid Carcinoma via promoting ubiquitination of XRCC5 to regulate the AKT signal pathway[J]. J Cancer, 2021, 12(3): 860-873. DOI:10.7150/jca.48141 |
| [8] |
Boufraqech M, Patel D, Nilubol N, et al. Lysyl Oxidase Is a Key Player in BRAF/MAPK Pathway-Driven Thyroid Cancer Aggressiveness[J]. Thyroid, 2019, 29(1): 79-92. DOI:10.1089/thy.2018.0424 |
| [9] |
Li X, Li Q, Jin X, et al. Long non-coding RNA H19 knockdown inhibits the cell viability and promotes apoptosis of thyroid cancer cells through regulating the PI3K/AKT pathway[J]. Exp Ther Med, 2019, 18(3): 1863-1869. |
| [10] |
Peng WX, Koirala P, Mo YY. LncRNA-mediated regulation of cell signaling in cancer[J]. Oncogene, 2017, 36(41): 5661-5667. DOI:10.1038/onc.2017.184 |
| [11] |
Fatica A, Bozzoni I. Long non-coding RNAs: new players in cell differentiation and development[J]. Nat Rev Genet, 2014, 15(1): 7-21. |
| [12] |
Wilusz JE. Long noncoding RNAs: Re-writing dogmas of RNA processing and stability[J]. Biochim Biophys Acta, 2016, 1859(1): 128-138. DOI:10.1016/j.bbagrm.2015.06.003 |
| [13] |
Peschansky VJ, Wahlestedt C. Non-coding RNAs as direct and indirect modulators of epigenetic regulation[J]. Epigenetics, 2014, 9(1): 3-12. DOI:10.4161/epi.27473 |
| [14] |
Hirose T, Mishima Y, Tomari Y. Elements and machinery of non-coding RNAs: toward their taxonomy[J]. EMBO Rep, 2014, 15(5): 489-507. DOI:10.1002/embr.201338390 |
| [15] |
Huarte M. The emerging role of lncRNAs in cancer[J]. Nat Med, 2015, 21(11): 1253-1261. DOI:10.1038/nm.3981 |
| [16] |
Yao RW, Wang Y, Chen LL. Cellular functions of long noncoding RNAs[J]. Nat Cell Biol, 2019, 21(5): 542-551. DOI:10.1038/s41556-019-0311-8 |
| [17] |
Le K, Guo H, Zhang Q, et al. Gene and lncRNA co-expression network analysis reveals novel ceRNA network for triple-negative breast cancer[J]. Sci Rep, 2019, 9(1): 15122. DOI:10.1038/s41598-019-51626-7 |
| [18] |
Li ZR, Yang Q, Zhou T, et al. Prognostic Value of Long Noncoding RNA SNHG12 in Various Carcinomas: A Meta-Analysis[J]. Biomed Res Int, 2020, 2020: 8847401. |
| [19] |
Ding S, Qu W, Jiao Y, et al. LncRNA SNHG12 promotes the proliferation and metastasis of papillary thyroid carcinoma cells through regulating wnt/β-catenin signaling pathway[J]. Cancer Biomark, 2018, 22(2): 217-226. DOI:10.3233/CBM-170777 |
| [20] |
Feng K, Liu Y, Xu LJ, et al. Long noncoding RNA PVT1 enhances the viability and invasion of papillary thyroid carcinoma cells by functioning as ceRNA of microRNA-30a through mediating expression of insulin like growth factor 1 receptor[J]. Biomed Pharmacother, 2018, 104: 686-698. DOI:10.1016/j.biopha.2018.05.078 |
| [21] |
Li MY, Tang XH, Fu Y, et al. Regulatory Mechanisms and Clinical Applications of the Long Non-coding RNA PVT1 in Cancer Treatment[J]. Front Oncol, 2019, 9: 787. DOI:10.3389/fonc.2019.00787 |
| [22] |
Jin K, Wang S, Zhang Y, et al. Long non-coding RNA PVT1 interacts with MYC and its downstream molecules to synergistically promote tumorigenesis[J]. Cell Mol Life Sci, 2019, 76(21): 4275-4289. DOI:10.1007/s00018-019-03222-1 |
| [23] |
Zhang Y, Wang Z, Gemeinhart RA. Progress in microRNA delivery[J]. J Control Release, 2013, 172(3): 962-974. DOI:10.1016/j.jconrel.2013.09.015 |
| [24] |
Idichi T, Seki N, Kurahara H, et al. Molecular pathogenesis of pancreatic ductal adenocarcinoma: Impact of passenger strand of pre-miR-148a on gene regulation[J]. Cancer Sci, 2018, 109(6): 2013-2026. DOI:10.1111/cas.13610 |
| [25] |
Santos MC, Tegge AN, Correa BR, et al. miR-124, -128, and -137 Orchestrate Neural Differentiation by Acting on Overlapping Gene Sets Containing a Highly Connected Transcription Factor Network[J]. Stem Cells, 2016, 34(1): 220-232. DOI:10.1002/stem.2204 |
| [26] |
Salajegheh A, Vosgha H, Md Rahman A, et al. Modulatory role of miR-205 in angiogenesis and progression of thyroid cancer[J]. J Mol Endocrinol, 2015, 55(3): 183-196. DOI:10.1530/JME-15-0182 |
| [27] |
Rupaimoole R, Slack FJ. MicroRNA therapeutics: towards a new era for the management of cancer and other diseases[J]. Nat Rev Drug Discov, 2017, 16(3): 203-222. DOI:10.1038/nrd.2016.246 |
| [28] |
Mutlu M, Saatci Ö, Ansari SA, et al. miR-564 acts as a dual inhibitor of PI3K and MAPK signaling networks and inhibits proliferation and invasion in breast cancer[J]. Sci Rep, 2016, 6: 32541. DOI:10.1038/srep32541 |
| [29] |
Song Z, Yang H, Wu X, et al. microRNA-564 inhibits the aggressive phenotypes of papillary thyroid cancer by directly targeting astrocyte-elevated gene-1[J]. Onco Targets Ther, 2019, 12: 4869-4881. DOI:10.2147/OTT.S201282 |
| [30] |
Chou CK, Liu RT, Kang HY. MicroRNA-146b: A Novel Biomarker and Therapeutic Target for Human Papillary Thyroid Cancer[J]. Int J Mol Sci, 2017, 18(3): 636. DOI:10.3390/ijms18030636 |
| [31] |
Yi W, Li D, Guo Y, et al. Sevoflurane inhibits the migration and invasion of glioma cells by upregulating microRNA-637[J]. Int J Mol Med, 2016, 38(6): 1857-1863. DOI:10.3892/ijmm.2016.2797 |
| [32] |
Chen F, Li M, Zhu X. Propofol suppresses proliferation and migration of papillary thyroid cancer cells by down-regulation of lncRNA ANRIL[J]. Exp Mol Pathol, 2019, 107: 68-76. DOI:10.1016/j.yexmp.2019.01.011 |
| [33] |
Yu B, Gao W, Zhou H, et al. Propofol induces apoptosis of breast cancer cells by downregulation of miR-24 signal pathway[J]. Cancer Biomark, 2018, 21(3): 513-519. DOI:10.3233/CBM-170234 |
| [34] |
Li Y, Zeng QG, Qiu JL, et al. Sevoflurane inhibits the progression of PTC by downregulating miR-155[J]. Eur Rev Med Pharmacol Sci, 2019, 23(15): 6579-6587. |
| [35] |
Li Y, Zeng QG, Qiu JL, et al. Propofol suppresses migration, invasion, and epithelial-mesenchymal transition in papillary thyroid carcinoma cells by regulating miR-122 expression[J]. Eur Rev Med Pharmacol Sci, 2020, 24(9): 5101-5110. |
| [36] |
Liu X, Li M, Wang X, et al. Effects of adjuvant traditional Chinese medicine therapy on long-term survival in patients with hepatocellular carcinoma[J]. Phytomedicine, 2019, 62: 152930. DOI:10.1016/j.phymed.2019.152930 |
| [37] |
Yang Z, Zhang Q, Yu L, et al. The signaling pathways and targets of traditional Chinese medicine and natural medicine in triple-negative breast cancer[J]. J Ethnopharmacol, 2021, 264: 113249. DOI:10.1016/j.jep.2020.113249 |
| [38] |
Hsiao WL, Liu L. The role of traditional Chinese herbal medicines in cancer therapy--from TCM theory to mechanistic insights[J]. Planta Med, 2010, 76(11): 1118-1131. DOI:10.1055/s-0030-1250186 |
| [39] |
Fang T, Li J, Wu X. Shenmai injection improves the postoperative immune function of papillary thyroid carcinoma patients by inhibiting differentiation into Treg cells via miR-103/GPER1 axis[J]. Drug Dev Res, 2018, 79(7): 324-331. DOI:10.1002/ddr.21459 |
| [40] |
张芬, 余建琴, 张怀念. KRAS基因沉默介导MAPK1/MAPK3信号通路对乳头状甲状腺癌上皮间质转化的分子机制研究[J]. 中国肿瘤外科杂志, 2020, 12(5): 473-479. [Zhang F, Yu JQ, Zhang XQ. Molecular mechanisms of KRAS gene silencing-mediated MAPK1/MAPK3 signaling pathway on epithelial-mesenchymal transition in papillary thyroid carcinoma[J]. Zhongguo Zhong Liu Wai Ke Za Zhi, 2020, 12(5): 473-479. DOI:10.3969/j.issn.1674-4136.2020.05.021] |
| [41] |
邵扬谦. 长链非编码RNAPVT1通过miR-195-5p/TERT信号途径对乳头状甲状腺癌细胞增殖侵袭和迁移的影响[D]. 郑州大学, 2019. [Shao YQ. Effect of long non-coding RNA PVT1 on proliferation, invasion and migration of papillary thyroid carcinoma cells via miR-195-5p/TERT signaling pathway[D]. Zhengzhou University, 2019.]
|
| [42] |
Alzahrani AS. PI3K/Akt/mTOR inhibitors in cancer: At the bench and bedside[J]. Semin Cancer Biol, 2019, 59: 125-132. DOI:10.1016/j.semcancer.2019.07.009 |
| [43] |
Martini M, De Santis MC, Braccini L, et al. PI3K/AKT signaling pathway and cancer: an updated review[J]. Ann Med, 2014, 46(6): 372-383. DOI:10.3109/07853890.2014.912836 |
| [44] |
Han L, Liu B, Jiang L, et al. MicroRNA-497 downregulation contributes to cell proliferation, migration, and invasion of estrogen receptor alpha negative breast cancer by targeting estrogen-related receptor alpha[J]. Tumour Biol, 2016, 37(10): 13205-13214. DOI:10.1007/s13277-016-5200-1 |
| [45] |
Zhuang J, Ye Y, Wang G, et al. MicroRNA-497 inhibits cellular proliferation, migration and invasion of papillary thyroid cancer by directly targeting AKT3[J]. Mol Med Rep, 2017, 16(5): 5815-5822. DOI:10.3892/mmr.2017.7345 |
| [46] |
Xu D, Yu J, Zhuang S, et al. Overexpression of long non-coding RNA LINC00982 suppresses cell proliferation and tumor growth of papillary thyroid carcinoma through PI3K-ATK signaling pathway[J]. Biosci Rep, 2019, 39(7): BSR20191210. DOI:10.1042/BSR20191210 |
| [47] |
Taciak B, Pruszynska I, Kiraga L, et al. Wnt signaling pathway in development and cancer[J]. J Physiol Pharmacol, 2018, 69(2). |
| [48] |
Peng Y, Zhang X, Feng X, et al. The crosstalk between microRNAs and the Wnt/β-catenin signaling pathway in cancer[J]. Oncotarget, 2017, 8(8): 14089-14106. DOI:10.18632/oncotarget.12923 |
| [49] |
Yu S, Cao S, Hong S, et al. miR-3619-3p promotes papillary thyroid carcinoma progression via Wnt/β-catenin pathway[J]. Ann Transl Med, 2019, 7(22): 643. DOI:10.21037/atm.2019.10.71 |
| [50] |
Wang X, Lu X, Geng Z, et al. LncRNA PTCSC3/miR-574-5p Governs Cell Proliferation and Migration of Papillary Thyroid Carcinoma via Wnt/β-Catenin Signaling[J]. J Cell Biochem, 2017, 118(12): 4745-4752. DOI:10.1002/jcb.26142 |
 2021, Vol. 48
2021, Vol. 48


