文章信息
- 虫草素抑制JAK2/STAT3通路减轻肺癌大鼠放射性免疫功能损伤
- Cordycepin Attenuates Immune Function Injury in A Rat Model of Lung Cancer After Radiotherapy by Inhibiting JAK2/STAT3 Pathway
- 肿瘤防治研究, 2021, 48(11): 994-998
- Cancer Research on Prevention and Treatment, 2021, 48(11): 994-998
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2021.21.0094
- 收稿日期: 2021-01-25
- 修回日期: 2021-07-26
放射治疗(简称放疗)能够有效杀伤肿瘤细胞,但是同时也会造成免疫系统功能损伤[1]。虫草素(Cordycepin)是冬虫夏草的主要活性成分,可以通过阻断嘌呤、DNA和RNA生物合成及蛋白质翻译过程抑制肿瘤细胞的增殖[2]。目前虫草素在胰腺癌、胆管癌、内皮细胞癌等癌症中的抑瘤作用均有报道[3-5]。除此之外,虫草素还具有免疫调节、抗炎、抗病毒等多种生物学效应,在临床上用于治疗系统性红斑狼疮等自身免疫性疾病[6],但是虫草素对机体免疫功能损伤的抑制作用鲜有报道。本实验拟通过观察虫草素对放疗致Lewis肺癌荷瘤大鼠免疫功能损伤的抑制作用,并探讨其可能机制,为临床改善放疗所致免疫功能损伤提供理论依据。
1 材料与方法 1.1 材料 1.1.1 实验动物和细胞系Lewis肺癌细胞系购自中国科学院上海生命科学研究所。健康清洁级雄性SD大鼠60只(北京北科华夏生物医药科技有限公司,SYXK(京)2017-0044),8周龄,体质量180~200 g,购入后适应性饲养3天。
1.1.2 主要试剂和仪器虫草素(纯度≥98%)购自上海国宝企业发展中心;白细胞介素(interleukin, IL)-6、肿瘤坏死因子-α(tumor necrosis factor-α, TNF-α)ELISA试剂盒购自美国CST公司;兔抗大鼠蛋白酪氨酸激酶2(Janus kinase 2, JAK2)、磷酸化蛋白酪氨酸激酶2(phospho-Janus kinase, p-JAK2)、信号转导子与激活子3(signal transducer and activator of transcription, STAT3)、磷酸化信号转导子与激活子3(phospho-signal transducers and activator of transcription, p-STAT3)、β-actin抗体均购自美国Abcam公司;FITC-CD4、PE-CD8购自美国eBioscience公司;带HRP标记的山羊抗兔二抗购自美国Sigma公司;JAK2/STAT3信号通路激活剂Olanzapine购自美国Selleck公司;流式细胞仪(型号:Cell Lab Quanta SC)购自美国Beckman coulter公司。
1.2 方法 1.2.1 肺癌荷瘤大鼠模型制备Lewis肺癌细胞用含10%胎牛血清的DMEM在37℃、5%CO2培养箱中常规培养传代,取对数生长期细胞,调至浓度为1×107个/毫升,以0.2 ml(2×106个)接种于50只大鼠右季肋部皮下,接种后4 d可见明显肿瘤包块,接种率100%。
1.2.2 分组和给药50只接种成功的大鼠随机分为模型组、放疗组、虫草素组、激动剂组、激动剂+虫草素组,每组各10只。另取10只右季肋部皮下注射0.2 ml 0.9%氯化钠溶液的大鼠作为正常组。接种后第4 d,放疗组、虫草素组、激动剂组和激动剂+虫草素组大鼠一次性给予20 Gy放射线照射;7 d后,虫草素组大鼠腹腔注射虫草素50 mg/kg,1次/天,连续9 d;激动剂组大鼠腹腔注射Olanzapine 10 mg/kg,1次/天,连续9 d;激动剂+虫草素组大鼠腹腔注射Olanzapine 10 mg/kg,1 h后腹腔注射虫草素50 mg/kg,1次/天,连续9 d;正常组、模型组、放疗组大鼠仅腹腔注射等量0.9%氯化钠溶液,在此期间仅有模型组一只大鼠死亡。
1.2.3 抑瘤实验末次给药后24 h,处死大鼠,无菌分离各组大鼠右季肋部皮下肿瘤,游标卡尺测量肿瘤长径(a)和短径(b),按公式(V=a×b2/2)计算肿瘤体积。电子天平称重,计算抑瘤率(inhibition rate, IR),IR(%)=(模型组瘤质量-治疗组瘤质量)/模型组瘤质量×100%。
1.2.4 血清学指标检测尾部静脉采血,室温静置30 min后,3 000 r/min离心10 min(离心半径为10 cm)后收集血清,检测IL-6和TNF-α浓度,实验步骤严格按照ELISA试剂盒说明书操作。经温育、加酶、显色、终止后,于450 nm波长处测定吸光度(A)值。
1.2.5 脾脏、胸腺指数检测采血完毕,称重处死,去除脾脏和胸腺并称量,计算脾脏、胸腺指数。脾脏、胸腺指数=脾脏、胸腺重量(mg)/大鼠体质量(g)。
1.2.6 脾脏中T淋巴细胞亚群数量测定取部分脾脏,置于预冷PBS中,剪碎,经200目尼龙网转到另一装有PBS的EP管中,1 500 r/min离心10 min,收集脾脏细胞沉淀,加入红细胞裂解液2 ml,混匀,避光静置10 min,4℃ 12 000 r/min离心10 min,弃上清液,预冷PBS清洗2次,制备脾细胞悬液,调整细胞终浓度为1×107个/毫升,取200 μl细胞悬液,分别加入FITC-CD4和PE-CD8各1.2 μl,避光室温孵育30 min,用PBS洗涤细胞2次,1 500 r/min离心5 min,加入500 μl PBS,轻轻吹打使细胞悬起,流式细胞仪进行细胞检测。
1.2.7 蛋白测定取液氮中保存脾脏,剪碎匀浆,加入RIPA裂解液,离心后取上清液,采用BCA法测定蛋白浓度,制定蛋白样品。进行电泳,浓缩胶的梳孔中加入蛋白样品20 μl。设定恒压120 v,待溴酚蓝到达分离胶的底部时停止电泳。将蛋白转移到PVDF膜上,湿转结束后,TBST洗涤3次,每次5 min,封闭2 h,PVDF膜置于1:1 000的JAK2、p-JAK2、STAT3和p-STAT3的一抗中4℃孵育过夜,TBST洗涤后在1:5 000的二抗中37℃孵育2 h,ECL显色,使用Image J软件进行条带灰度扫描。以目的蛋白JAK2、p-JAK2、STAT3、p-STAT3与内参β-actin灰度值比值表示蛋白相对表达量。
1.3 统计学方法采用SPSS 22.0统计软件进行数据处理,符合正态分布的计量资料以均数±标准差(x±s)表示,多组间比较采用单因素方差分析,进一步两两比较采用LSD-t检验。P < 0.05为差异有统计学意义。
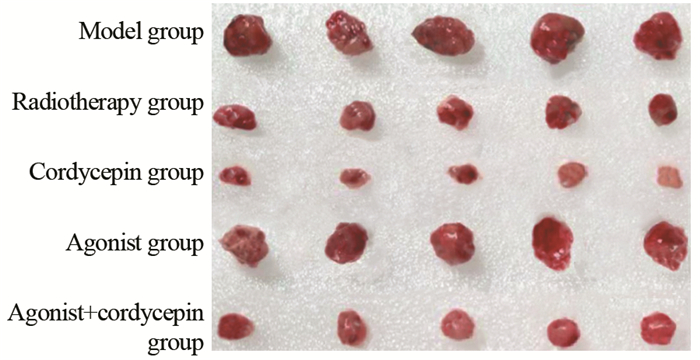
2 结果 2.1 虫草素对放疗后肺癌大鼠肿瘤的影响与模型组比较,放疗组、虫草素组、激动剂组和激动剂+虫草素组的大鼠瘤重、肿瘤体积均减少(均P < 0.05),其中虫草素组瘤重、肿瘤体积较放疗组低(P < 0.05),激动剂+虫草素组较激动剂组低(P < 0.05),但较虫草组升高;与放疗组比较,除激动剂组的抑瘤率下降外,虫草素组、激动剂+虫草素组均有升高(均P < 0.05),其中虫草素组抑瘤率较放疗组高(P < 0.05),在激动剂+虫草素组高于激动剂组(P < 0.05),低于虫草素组,见表 1、图 1。
|
|
| 图 1 各组荷瘤大鼠肿瘤体积 Figure 1 Tumor volume in each group of tumor-bearing rats |
与正常组比较,模型组、放疗组、虫草素组和激动剂+虫草素组大鼠血清IL-6和TNF-α均升高(均P < 0.05);虫草素组大鼠血清IL-6和TNF-α水平较放疗组低(P < 0.05),激动剂+虫草素组较激动剂组低,但较虫草素组比升高(P < 0.05),见表 2。
|
与正常组比较,模型组、放疗组、虫草素组、激动剂组和激动剂+虫草素组脾指数和胸腺指数均下降(均P < 0.05),其中虫草素组脾指数和胸腺指数较放疗组升高(P < 0.05),激动剂+虫草素组较激动剂组升高,但较虫草组降低(P < 0.05),见表 3。
|
与正常组比较,模型组、放疗组、虫草素组、激动剂组和激动剂+虫草素组CD4+细胞和CD4+/CD8+比值降低,CD8+细胞升高(均P < 0.05),其中虫草素组CD4+细胞和CD4+/CD8+比值较放疗组升高(P < 0.05),激动剂+虫草素组较激动剂组升高(P < 0.05),但较虫草组低;虫草素组CD8+细胞较放疗组降低(P < 0.05),激动剂+虫草素组较激动剂组降低,但较虫草组升高(P < 0.05),见表 4。
|
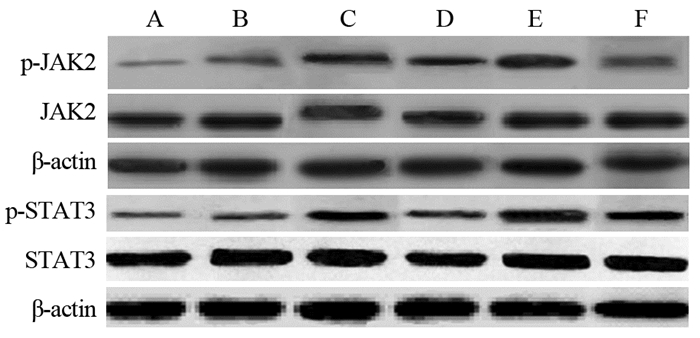
与正常组比较,模型组、放疗组、虫草素组、激动剂组和激动剂+虫草素组p-JAK2和p-STAT3表达均升高(均P < 0.05),其中虫草素组p-JAK2和p-STAT3表达较放疗组降低(P < 0.05),激动剂+虫草素组较激动剂组降低,但较虫草组升高(P < 0.05);各组间JAK2和STAT3比较,差异无统计学意义(均P > 0.05),见表 5、图 2。
|
|
| A: normal group; B: model group; C: radiotherapy group; D: cordycepin group; E: agonist group; F: agonist+cordycepin group 图 2 脾脏组织中JAK2、p-JAK2、STAT3和p-STAT3蛋白表达水平 Figure 2 Protein levels of JAK2, p-JAK2, STAT3 and p-STAT3 in spleen of rats |
目前,肺癌严重威胁着人类生命健康,其发病率和死亡率在全球范围内高居不下[7]。放疗虽在多种肿瘤的临床治疗中得到应用,但放疗同时也存在破坏性不良反应,例如免疫系统功能损伤、神经干细胞损伤、心脏毒性等[8-9]。免疫功能失调是造成癌症患者放疗后不良反应及预后效果差的主要原因,放疗联合免疫治疗,对于提高患者免疫功能具有重要意义[10]。已有研究证实,虫草素具有调节免疫功能、抑制炎性反应等功效[11-12]。本研究旨在探讨虫草素在减轻肺癌大鼠放疗免疫功能损伤中的作用及其可能机制。
既往研究表明,虫草素具有调节CD4+T淋巴细胞增殖和杀伤能力、抑制炎性反应、增强机体免疫力的作用[13-14],此外,虫草素在抑制肿瘤细胞增殖、迁移和浸润等过程中具有重要作用。本研究采用Lewis肺癌细胞接种于大鼠右季肋部皮下建立肺癌大鼠模型,模型建立稳定。结果显示:放疗可有效减小肿瘤体积,虫草素可加强放疗的治疗效果。放疗后,免疫系统功能遭受严重损伤,包括CD4+细胞、CD4+/CD8+比值、脾指数、胸腺指数降低,CD8+细胞、血清IL-6和TNF-α升高。由此可知,虫草素发挥免疫系统保护作用,加强肿瘤的抑制作用。
JAK2/STAT3信号通路被认为是调节细胞生长和凋亡的关键环节,同时参与免疫调节和炎性反应[15-16]。活化的JAK2使STAT3磷酸化,磷酸化后STAT3转移入细胞核与特异性启动子结合,诱导靶基因mRNAs表达[17]。研究证实,JAK2/STAT3信号通路被激活促进肿瘤细胞增殖和迁移,而且激活后参与多种疾病的炎性反应[18-19]。虫草素是否通过JAK2/STAT3信号通路发挥对放疗造成的免疫功能损伤的抑制作用仍需进一步研究。本实验采用虫草素治疗经放疗后的肺癌大鼠,检测JAK2/STAT3信号通路蛋白表达。结果显示:虫草素可降低p-JAK2和p-STAT3蛋白表达水平。此实验结果提示虫草素通过抑制JAK2/STAT3信号通路的激活发挥免疫调节作用。
综上所述,虫草素可有效减轻肺癌大鼠放射治疗免疫功能损伤,其可能是通过抑制JAK2/STAT3信号通路蛋白表达及下游炎性反应因子释放发挥调控作用。本研究为临床虫草素相关药物的研发和应用于免疫功能损伤提供了新的理论依据。
作者贡献:
刘建波:实验设计及论文撰写
李白羽:实验实施和资料收集
柯善保:论文撰写
张伟:论文修订和审校
| [1] |
宋春洋, 祝淑钗, 沈文斌, 等. 临床Ⅲ期食管癌患者放疗前后免疫功能及外周血炎症指标对预后的影响分析[J]. 中华放射医学与防护杂志, 2020, 40(3): 189-195. [Song CY, Zhu SC, Shen WB, et al. Analysis of the effects of immunity index and blood inflammatory markers pre- and post-radiotherapy on prognosis of clinical stage Ⅲ esophageal cancer patients[J]. Zhonghua Fang She Yi Xue Yu Fang Hu Za Zhi, 2020, 40(3): 189-195. DOI:10.3760/cma.j.issn.0254-5098.2020.03.006] |
| [2] |
王多, 鲍荣, 王芳, 等. 虫草素抗肿瘤作用分子机制研究进展[J]. 中国药理学与毒理学杂志, 2015, 29(4): 643-650. [Wang D, Bao R, Wang F, et al. progress in molecular mechanisms of anticancer action of corycepin[J]. Zhongguo Yao Li Xue Yu Du Li Xue Za Zhi, 2015, 29(4): 643-650. DOI:10.3867/j.issn.1000-3002.2015.04.018] |
| [3] |
Zhang Y, Zhang XX, Yuan RY, et al. Cordycepin induces apoptosis in human pancreatic cancer cells via the mitochondrial-mediated intrinsic pathway and suppresses tumor growth in vivo[J]. Onco Targets Ther, 2018, 11: 4479-4490. DOI:10.2147/OTT.S164670 |
| [4] |
Wang C, Mao ZP, Wang L, et al. Cordycepin inhibits cell growth and induces apoptosis in human cholangiocarcinoma[J]. Neoplasma, 2017, 64(6): 834-839. DOI:10.4149/neo_2017_604 |
| [5] |
Lin YT, Liang SM, Wu YJ, et al. Cordycepin suppresses endothelial cell proliferation, migration, angiogenesis, and tumor growth by regulating focal adhesion kinase and p53[J]. Cancers(Basel), 2019, 11(2): 168. |
| [6] |
韩丹, 崔琳琳, 王莹, 等. 虫草素药理作用研究进展[J]. 食品工业科技, 2019, 40(9): 335-338, 345. [Han D, Cui LL, Wang Y, et al. Research Progress On Pharmacological Effects Of Cordycepin[J]. Shi Pin Gong Ye Ke Ji, 2019, 40(9): 335-338, 345.] |
| [7] |
Mao Y, Yang D, He J, et al. Epidemiology of lung cancer[J]. Surg Oncol Clin N Am, 2016, 25(3): 439-445. DOI:10.1016/j.soc.2016.02.001 |
| [8] |
Michaelidesová A, Konířová J, Bartůněk P, et al. Effects of radiation therapy on neural stem cells[J]. Genes(Basel), 2019, 10(9): 640. |
| [9] |
Kirova Y, Tallet A, Aznar MC, et al. Radio-induced cardiotoxicity: from physiopathology and risk factors to adaptation of radiotherapy treatment planning and recommended cardiac follow-up[J]. Cancer Radiother, 2020, 24(6-7): 576-585. DOI:10.1016/j.canrad.2020.07.001 |
| [10] |
Weichselbaum RR, Liang H, Deng L, et al. Radiotherapy and immunotherapy: a beneficial liaison?[J]. Nat Rev Clin Oncol, 2017, 14(6): 365-379. DOI:10.1038/nrclinonc.2016.211 |
| [11] |
Woolley VC, Teakle GR, Prince G, et al. Cordycepin, a metabolite of Cordyceps militaris, reduces immune-related gene expression in insects[J]. J Invertebr Pathol, 2020, 177: 107480. DOI:10.1016/j.jip.2020.107480 |
| [12] |
Lei J, Wei Y, Song P, et al. Cordycepin inhibits LPS-induced acute lung injury by inhibiting inflammation and oxidative stress[J]. Eur J Pharmacol, 2018, 818: 110-114. DOI:10.1016/j.ejphar.2017.10.029 |
| [13] |
Tan L, Song X, Ren Y, et al. Anti-inflammatory effects of cordycepin: A review[J]. Phytother Res, 2020. Online ahead of print.
|
| [14] |
安青, 何立巍, 吴红雁, 等. 虫草素通过调节CD4+T淋巴细胞PD-1受体促进肿瘤免疫及机制研究[J]. 南京中医药大学学报, 2018, 34(5): 495-498. [An Q, He LW, Wu HY, et al. Mechanism of cordycepin promotes tumor immunity by regulating PD-1 receptor of CD4+T lymphocytes[J]. Nanjing Zhong Yi Yao Da Xue Xue Bao, 2018, 34(5): 495-498.] |
| [15] |
Zundler S, Neurath MF. Integrating immunologic signaling networks: the JAK/STAT pathway in colitis and colitis-associated cancer[J]. Vaccines(Basel), 2016, 4(1): 5. |
| [16] |
Yu T, Li Z, Xu L, et al. Anti-inflammation effect of Qingchang suppository in ulcerative colitis through JAK2/STAT3 signaling pathway in vitro and in vivo[J]. J Ethnopharmacol, 2021, 266: 113442. DOI:10.1016/j.jep.2020.113442 |
| [17] |
Qing Y, Stark GR. Alternative activation of STAT1 and STAT3 in response to interferon-gamma[J]. J Biol Chem, 2004, 279(40): 41679-41685. DOI:10.1074/jbc.M406413200 |
| [18] |
Lei RE, Shi C, Zhang PL, et al. IL-9 promotes proliferation and metastasis of hepatocellular cancer cells by activating JAK2/STAT3 pathway[J]. Int J Clin Exp Pathol, 2017, 10(7): 7940-7946. |
| [19] |
Chen J, Zhang W, Xu Q, et al. Ang-(1-7) protects HUVECs from high glucose-induced injury and inflammation via inhibition of the JAK2/STAT3 pathway[J]. Int J Mol Med, 2018, 41(5): 2865-2878. |
 2021, Vol. 48
2021, Vol. 48
