文章信息
- 模板辅助192Ir源大分割立体近距离放射消融术治疗周围型肺癌的剂量学研究
- Dosimetric Analysis of Template-assisted 192Ir-source Hypofractionated Stereotactic Ablative Brachytherapy for Peripheral Lung Cancer
- 肿瘤防治研究, 2021, 48(5): 474-478
- Cancer Research on Prevention and Treatment, 2021, 48(5): 474-478
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2021.20.1051
- 收稿日期: 2020-09-08
- 修回日期: 2021-01-09
肺癌在全世界的发病率和死亡率都位列肿瘤首位[1-2]。早期周围型肺癌首选手术切除,拒绝手术及手术指征缺失者,体部立体定向放射治疗(stereotactic body radiation therapy, SBRT)也被视为标准治疗方法[3-4]。SBRT运用于周围型肺癌非劣效于手术[5],但为保证肿瘤靶区(gross tumor volume, GTV)量会使正常组织器官受到一定剂量的照射而引起不同程度的放射性损伤[6]。SBRT治疗肺癌时会受到器官运动的影响,受呼吸运动的影响尤为显著[7]。
模板辅助192Ir源大分割立体近距离放射消融术(stereotactic ablative brachytherapy, SABT)能准确地将192Ir源插植入GTV内,使肿瘤周围剂量分布呈距离平方反比跌落,确保肿瘤靶区高剂量同时危及器官剂量更低,更好地保护危及器官;同时放射源在靶区内可有效解决GTV运动的问题[8-9]。
本文研究周围型肺癌模板辅助192Ir源大分割SABT治疗中靶区与危及器官剂量,并与虚拟SBRT计划进行剂量学对比。
1 资料与方法 1.1 临床资料选择经组织病理学证实的28例早期周围型肺癌患者为本试验研究对象(中国临床试验注册编号Chictr1800014541),患者均拒绝手术或因自身基础疾病缺失手术指征,行增强CT扫描证实GTV是远离大血管且直径小于5 cm的孤立性病变。患者一般情况及插植情况见表 1。
完善术前常规检查,根据肿瘤具体部位确定患者体位(仰卧或俯卧位)使肿瘤离体表最近,用真空垫固定。再调整辅助支架至最佳位置使其引导共面模板覆盖在肿瘤体表位置,且患者体表标记定位线对位共面模板中心,记录辅助支架位置参数。随后实施层厚为0.25 cm的胸部CT增强扫描(lightspeed,美国GE),CT扫描图像传到Oncentra 4.3治疗计划软件与PET图像进行融合。由主管医师勾画GTV和危及器官(organs at risk, OARs)。处方剂量为GTV每分割(fraction, fx)30 Gy,等效生物学剂量(biologically equivalent dose, BED)为120 Gy。确保90%GTV体积达到处方剂量并限定OARs的剂量:肺D1000cm3 < 7.4 Gy,肺D1500cm3 < 7 Gy;心脏Dmax < 22 Gy,心脏D15cm3 < 16 Gy;食管D0.035cm3 < 16 Gy,食管D5cm3 < 11.9 Gy;气管D0.035cm3 < 20.2 Gy,气管D4cm3 < 10.5 Gy;脊髓Dmax < 10 Gy;皮肤Dmax < 26 Gy。剂量限制条件参考肿瘤放射治疗协会(radiation therapy oncology group, RTOG)0631、0813和0915报告[10-13]。
物理师利用Oncentra 4.3治疗计划软件制作SABT模拟计划,构建模拟插植程序:模拟插植针经共面模板建立针道平面坐标系,插植注意避开肋骨、大血管和心包膜等。反复调整模拟插植针位置、深度、数量优化放射剂量曲线,确保处方剂量曲线围绕在GTV周围而OARs的剂量尽可能低。最终确定模拟插植针在共面模板中位置及放射剂量。
1.3 实施SABT计划实施SABT计划时,患者体位及模板位置与SABT模拟计划一致。按记录参数调整辅助支架引导共面模板,使患者体表标记线、模板中心与激光线重合。经CT平扫确认符合术前计划后,根据模拟计划在激光定位与体表标记点重合处常规消毒铺巾、局部浸润麻醉。将共面模板安装在辅助支架上,当插植针的走行方向与模拟计划相吻合时固定共面模板,并按模拟计划植入插植针。插植过程中适时进行CT扫描以调整穿刺角度及深度,根据SABT模拟计划插植并固定1~5根插植针,总耗时约60 min左右。
根据SABT模拟计划再次进行CT扫描、融合图像、勾画GTV和OARs,使用Oncentra 4.3治疗计划软件反复优化剂量曲线。SABT计划经上级医师批准审核后实施,放疗过程中患者保持平静呼吸。放疗完成取下插植针后创口消毒加压包扎,即刻进行CT扫描以确定有无气胸、血胸及其他并发症的存在。术后卧床休息,给予止血、预防感染等治疗并密切观察至少24 h。
1.4 SABT和SBRT计划的回顾性分析以95%靶区体积达到处方剂量对SABT计划进行回顾性分析,处方剂量分别为30 Gy/1 fx,46.86 Gy/3 fx,56.4 Gy/5 fx(总生物等效剂量为120 Gy)。虚拟SBRT计划均采用Pinnacle 9.10治疗计划系统完成。CT图像从SABT模拟计划中获得,主管医师勾画GTV与OARs。计划靶区由GTV外扩0.5 cm产生,处方剂量同SABT。
SABT与SBRT计划OARs剂量限制遵循以下原则:1次分割OARs剂量与SABT模拟计划相同。对于3次分割,肺D1000cm3 < 11.4 Gy,肺D1500cm3 < 10.5 Gy,心脏Dmax < 30 Gy,心脏D15cm3 < 24 Gy;食管D0.035cm3 < 24 Gy,D5cm3 < 21 Gy;气管D0.035cm3 < 30 Gy,气管D4cm3 < 15 Gy;脊髓Dmax < 18 Gy;皮肤Dmax < 30 Gy。对于5次分割,肺D1000cm3 < 13.5 Gy,肺D1500cm3 < 12.5 Gy;心脏Dmax < 38 Gy,心脏D15cm3 < 32 Gy;食管D0.035cm3 < 29 Gy,食管D5cm3 < 27.5 Gy;气管D0.035cm3 < 38 Gy;气管D4cm3 < 18 Gy;脊髓Dmax < 24 Gy;皮肤Dmax < 36 Gy。上述剂量限制条件参考RTOG 0631、0813和0915报告[10-13]。
回顾性研究SABT和SBRT计划,治疗计划质量评估参数包括:V5/V20/V30/V90/V95/V100/V150:即接受5%、20%、30%、90%、95%、100%、150%处方剂量的体积百分比;D0.035cm3/D1cm3/D4cm3/D5cm3/ D10cm3/D15cm3/ D1000cm3/ D1500cm3: 即0.035 cm3、1 cm3、4 cm3、5 cm3、10 cm3、15 cm3、1000 cm3、1500 cm3所接受的剂量;D90%/D95%: 即90%、95%靶区体积所接受剂量;Dmean: 平均剂量;Dmax: 最大剂量。适形指数(conformity index, CI): CI=TVRI/TV×TVRI/VRI.其中TVRI是处方等剂量线的体积,TV是靶区体积,VRI是处方剂量的体积。梯度指数(gradient index, GI): GI=R50%/R100%。R50%是50%等剂量线的体积与PTV的比率,R100%是100%等剂量线的体积与PTV的比率。
1.5 统计学方法用SPSS17.0软件对SABT和SBRT计划靶区与危及器官剂量参数进行配对t检验比较,P < 0.05为差异有统计学意义。
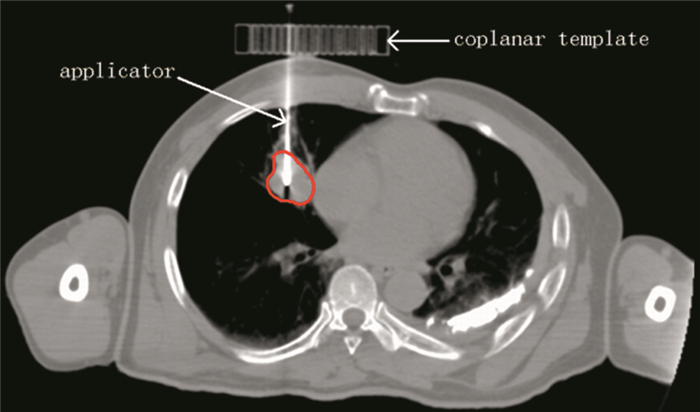
2 结果 2.1 模板辅助192Ir源大分割SABT结果28例患者均顺利完成插植放疗,实施模板辅助定位插植操作平均耗时60 min,过程中患者有轻微疼痛、出血、咳嗽不适,但都可以忍受;未出现呼吸困难、咯血、心悸不适。模板辅助192Ir源大分割SABT CT断层扫描图,见图 1。
|
| 图 1 模板辅助192Ir源大分割SABT CT断层扫描图 Figure 1 CT tomography of template-assisted 192Ir-source hypofractionated stereotactic ablative brachytherapy |
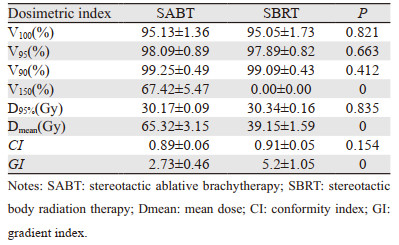
所有患者GTV的平均体积为(34.0±19.49)cm3。对于SABT与SBRT计划(1fx)靶区剂量参数V100, V95、V90、D95%以及CI差异均无统计学意义(均P > 0.05),但SABT计划靶区Dmean、V150明显高于SBRT计划,差异有统计学意义(均P < 0.01);二者CI无明显差异,对GI进行了比较发现SBRT的GI高于SABT(P < 0.01),表明SBRT靶区外剂量高于SABT,见表 2。
|
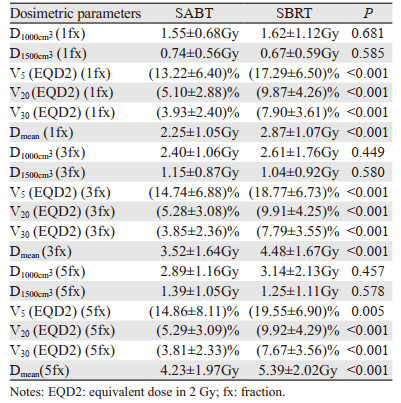
SABT和SBRT计划的肺D1000cm3、D1500cm3在1 fx、3 fx、5 fx均逐渐增加,肺D1000cm3在1 fx、3 fx、5 fx SABT均小于SBRT剂量,而肺D1500cm3反之,但二者差异无统计学意义(均P > 0.05)。SABT计划V5、V20、V30(EQD2, α/β=3)和Dmean均明显低于SBRT计划,且二者之间差异有统计学意义(均P < 0.01),肺剂量学参数见表 3。
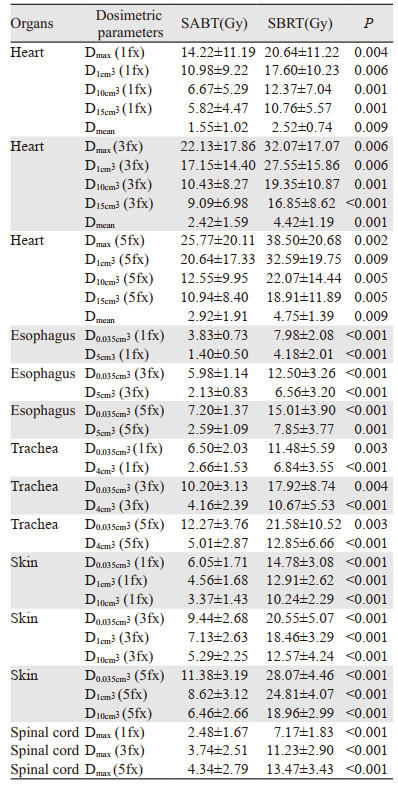
SABT计划OARs(心脏、食管、气管、皮肤和脊髓)各剂量学参数均明显低于SBRT计划,二者差异具有统计学意义(均P < 0.01)。OARs剂量学参数见表 4。为了能更直观比较SABT与SBRT靶区及各危及器官的剂量差别,选取一例患者绘制剂量体积直方图(DVH)。患者两种放疗方案的GTV保持相同趋势,而在SABT的OARs(心脏、食管、肺、皮肤和脊髓)剂量体积曲线更为陡直,表明接受到了更小放射剂量,见图 2。
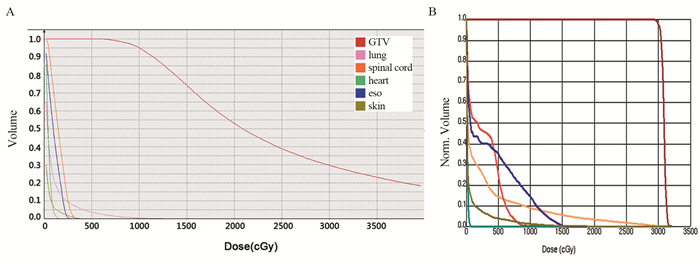
|
| 图 2 SABT(A)与SBRT(B)的剂量体积直方图比较 Figure 2 Comparison of dose-volume histogram (DVH) between SABT(A) and SBRT(B) plans |
肺癌发病率逐年上升,5年生存率仍 < 15%。放疗在肺癌治疗中占十分重要的地位[14]。外放疗可抑制肿瘤生长,但肺癌与食管、气管、心脏毗邻使放疗剂量受限,局部控制效果欠佳。近距离放射消融术具有局部剂量高、周围正常组织剂量低的特点,在治疗肺癌、胰腺癌、组织肉瘤等恶性肿瘤方面均取得较好疗效[14-16]。后装插植放疗利用插植针将放射源植入肿瘤内部,可以避免大血管搏动、呼吸运动、身体不自主移动等造成的靶区移动。插植放疗作为一种特殊的治疗手段,具有剂量学突破、解决运动误差、不良反应小的优势[14]。
SBRT虽已成为早期非手术性肺癌的标准治疗方法,但高精度放射治疗设备要求及靶区运动限制了其应用。靶区运动是影响肺癌放疗剂量准确性的重要因素之一,其中呼吸运动影响较大[17]。靶区运动可能会导致脱靶,使GTV放射剂量减少。解决呼吸运动造成靶区移动的措施有呼吸门控技术以及图像引导技术,但呼吸门控技术需要患者控制呼吸、图像引导技术其设备昂贵、技术复杂等使其二者运用受到限制[18]。与SBRT相比,SABT的放射源固定于肿瘤内部,在整个放疗过程中,没有肿瘤相对于照射野的运动,减少了正常肺组织照射剂量;同时SABT不需要外扩PTV,参照RTOG关于立体定向放疗对靶区勾画的要求,SABT的GTV等同于临床靶区CTV,能进一步减少肿瘤毗邻正常组织或器官的照射[19]。
回顾性分析SABT和SBRT计划,通过对肿瘤靶区及其危及器官的剂量进行比较,本研究发现SABT计划GTV Dmean、V150明显高于SBRT计划,SABT计划OARs各剂量学参数均低于SBRT计划,说明SABT能增加GTV剂量同时降低OARs剂量。通过其CI、GI参数比较,发现SABT与SBRT计划适形指数不存在差异,而SABT的GI低于SBRT,说明靶区外剂量明显小于SBRT,同前面危及器官剂量比较的结果一致。
虽然在此研究中SABT靶区及危及器官剂量较SBRT占有优势,但其属于微创侵入操作,需要技术熟练的操作人员来执行。且在患者的选择上有诸多限制,若病灶位于下肺,因呼吸运动影响徒手插植穿刺难度较大,易与计划产生偏差,无法保证剂量要求[20]。同时,因实际操作中穿刺与呼吸运动等产生的偏差会导致复位误差。病灶部位也会限制其应用,若位于肺中央,则因操作创伤及穿刺并发症等无法进行;位于周围的小病灶因肋骨遮挡等问题也会影响穿刺操作。穿刺可能出现感染、气胸、血气胸等并发症也限制了其在肺癌放疗的临床运用。总的来说,靶区运动、复位误差、肋骨遮挡以及穿刺可能出现的并发症等问题限制了SABT在临床的大规模推广应用。
目前通过模板辅助插植可保证穿刺的精准度,靶区及危及器官剂量分布能较好满足计划要求[21],实现剂量可控。虽然肺部肿瘤存在呼吸运动,特别是下肺肿瘤,根据实际情况我们在操作中进行了多针穿刺,复位过程可以基本做到模板体表位置与定位时基本一致。为了减少复位带来的误差,直接定位插植术中计划执行可能是一个很好的研究方向。
综上所述,在周围型肺癌治疗中模板辅助192Ir源大分割SABT能确保靶区高剂量同时降低危及器官剂量。进一步研究应集中在简化插植过程,建立标准SABT操作流程,在后续研究中增加研究样本量并进行随访评估其疗效及安全性。
作者贡献:
高琴、庞皓文:试验构思与设计、数据获取、分析与解读、撰写及修改论文
石翔翔、任培蓉:数据获取、分析与解读
林盛:指导论文撰写和修改
| [1] |
Bray F, Ferlay J, Soerjomataram I, et al. Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2018, 68(6): 394-424. DOI:10.3322/caac.21492 |
| [2] |
Chen W, Zheng R, Baade PD, et al. Cancer statistics in China, 2015[J]. CA Cancer J Clin, 2016, 66(2): 115-132. DOI:10.3322/caac.21338 |
| [3] |
Owen D, Sio TT. Stereotactic body radiotherapy (SBRT) for central and ultracentral node-negative lung tumors[J]. J Thorac Dis, 2020, 12(11): 7024-7031. DOI:10.21037/jtd-2019-cptn-01 |
| [4] |
Abdalmassih M, Bucher O, Rathod S, et al. Clinical Outcomes After Stereotactic Body Radiation Therapy for Early Stage Non-Small Cell Lung Cancer: A Single Institutional Study[J]. Cureus, 2020, 12(12): e11886. |
| [5] |
Mayne NR, Lin BK, Darling AJ, et al. Stereotactic Body Radiotherapy Versus Delayed Surgery for Early-stage Non-small-cell Lung Cancer[J]. Ann Surg, 2020, 272(6): 925-929. DOI:10.1097/SLA.0000000000004363 |
| [6] |
Ricco A, Barlow S, Feng J, et al. Repeat Thoracic Stereotactic Body Radiation Therapy (SBRT) for Nonsmall Cell Lung Cancer: Long-Term Outcomes, Toxicity, and Dosimetric Considerations[J]. Adv Radiat Oncol, 2020, 5(5): 984-993. DOI:10.1016/j.adro.2020.06.006 |
| [7] |
Ikushima H, Balter P, Komaki R, et al. Daily alignment results of in-room computed topography-guided stereotypic body radiation therapy for lung cancer[J]. Int J Radiat Oncol Biol Phys, 2011, 79(2): 473-480. DOI:10.1016/j.ijrobp.2009.11.009 |
| [8] |
Pang H, Wu K, Shi X, et al. Hypofractionated (192)Ir source stereotactic ablative brachytherapy with coplanar template assistance in the primary treatment of peripheral lung cancer[J]. J Contemp Brachytherapy, 2019, 11(4): 370-378. DOI:10.5114/jcb.2019.87218 |
| [9] |
Shi XX, Pang HW, Ren PR, et al. Template-assisted (192)Ir-based stereotactic ablative brachytherapy as a neoadjuvant treatment for operable peripheral non-small cell lung cancer: a phaseⅠclinical trial[J]. J Contemp Brachytherapy, 2019, 11(2): 162-168. DOI:10.5114/jcb.2019.84613 |
| [10] |
Kimura T, Nagata Y, Eba J, et al. A randomized Phase Ⅲ trial of comparing two dose-fractionations stereotactic body radiotherapy (SBRT) for medically inoperable Stage IA non-small cell lung cancer or small lung lesions clinically diagnosed as primary lung cancer: Japan Clinical Oncology Group Study JCOG1408 (J-SBRT trial)[J]. Jpn J Clin Oncol, 2017, 47(3): 277-281. |
| [11] |
Bezjak A, Paulus R, Gaspar LE, et al. Efficacy and Toxicity Analysis of NRG Oncology/RTOG 0813 Trial of Stereotactic Body Radiation Therapy (SBRT) for Centrally Located Non-Small Cell Lung Cancer (NSCLC)[J]. Inter J Radiat Oncol Biol Phys, 2016, 96(Suppl 2): S8. |
| [12] |
Ryu S, Pugh SL, Gerszten PC, et al. RTOG 0631 phase 2/3 study of image guided stereotactic radiosurgery for localized (1-3) spine metastases: Phase 2 results[J]. Pract Radiat Oncol, 2014, 4(2): 76-81. DOI:10.1016/j.prro.2013.05.001 |
| [13] |
Videtic GM, Paulus R, Singh AK, et al. Long-term Follow-up onNRG Oncology RTOG 0915 (NCCTG N0927): A Randomized Phase 2 Study Comparing 2 Stereotactic Body Radiation Therapy Schedules for Medically Inoperable Patients With Stage I Peripheral Non-Small Cell Lung Cancer[J]. Int J Radiat Oncol Biol Phys, 2019, 103(5): 1077-1084. DOI:10.1016/j.ijrobp.2018.11.051 |
| [14] |
徐金济, 蔡倩倩, 成俊, 等. 非小细胞肺癌192Ir后装组织间插植内放疗与外放疗效果的前瞻性随机对照研究[J]. 南通大学学报, 2019, 39(1): 75-77. [Xu JJ, Cai QQ, Cheng J, et al. Prospective randomized controlled study on the effects of interstitial brachytherapy and external radiotherapy for non-small cell lung cancer 192Ir[J]. Nantong Da Xue Xue Bao, 2019, 39(1): 75-77.] |
| [15] |
李学敏, 彭冉, 姜玉良, 等. 3D打印模板辅助CT引导放射性125I粒子植入治疗软组织肉瘤的剂量学研究[J]. 中华放射医学与防护杂志, 2018, 38(5): 350-354. [Li XM, Peng R, Jiang YL, et al. Dosimetry study of CT-guided radioactive 125i seed implantation in the treatment of soft tissue sarcoma[J]. Zhonghua Fang She Yi Xue Yu Fang Hu Za Zhi, 2018, 38(5): 350-354. DOI:10.3760/cma.j.issn.0254-5098.2018.05.005] |
| [16] |
陆健, 黄蔚, 贡桔, 等. 模板辅助CT引导放射性粒子植入治疗胰腺癌的临床应用价值[J]. 中华放射学杂志, 2017, 51(12): 966-970. [Lu J, Huang W, Gong J, et al. Clinical value of template-assisted CT-guided radioactive seed implantation in the treatment of pancreatic cancer[J]. Zhonghua Fang She Xue Za Zhi, 2017, 51(12): 966-970. DOI:10.3760/cma.j.issn.1005-1201.2017.12.015] |
| [17] |
Knybel L, Cvek J, Molenda L, et al. Analysis of Lung Tumor Motion in a Large Sample: Patterns and Factors Influencing Precise Delineation of Internal Target Volume[J]. Int J Radiat Oncol Biol Phys, 2016, 96(4): 751-758. DOI:10.1016/j.ijrobp.2016.08.008 |
| [18] |
Wurm RE, Gum F, Erbel S, et al. Image guided respiratory gated hypofractionated Stereotactic Body Radiation Therapy (H-SBRT) for liver and lung tumors: Initial experience[J]. Acta Oncol, 2006, 45(7): 881-889. DOI:10.1080/02841860600919233 |
| [19] |
吴敬波. 局部晚期周围型非小细胞肺癌后装插植放疗[J]. 肿瘤预防与治疗, 2017, 30(3): 153-157. [Wu JB. Post-implantation radiotherapy for locally advanced peripheral non-small cell lung cancer[J]. Zhong Liu Yu Fang Yu Zhi Liao, 2017, 30(3): 153-157. DOI:10.3969/j.issn.1674-0904.2017.03.001] |
| [20] |
郑云峰, 贡桔, 夏宁, 等. CT引导下3D共面模板辅助125I放射性粒子植入近距离治疗纵隔淋巴结转移[J]. 中国医学计算机成像杂志, 2019, 25(1): 79-84. [Zheng YF, Gong J, Xia N, et al. Ct-guided 3D coplanar template assisted 125I radioactive seed implantation in the treatment of mediastinal lymph node metastasis[J]. Zhongugo Yi Xue Ji Suan Ji Cheng Xiang Za Zhi, 2019, 25(1): 79-84. DOI:10.3969/j.issn.1006-5741.2019.01.018] |
| [21] |
石翔翔, 唐涛, 庞皓文, 等. 局部晚期NSCLC模板辅助技术192Ir源后装立体消融治疗安全性初步观察[J]. 中华放射肿瘤学杂志, 2019, 28(9): 665-668. [Shi XX, Tang T, Pang HW, et al. Preliminary observation on the safety of post-loading stereo ablation with 192Ir source of locally advanced NSCLC template-assisted technology[J]. Zhonghua Fang She Zhong Liu Xue Za Zhi, 2019, 28(9): 665-668. DOI:10.3760/cma.j.issn.1004-4221.2019.09.006] |
 2021, Vol. 48
2021, Vol. 48