文章信息
- NLR、LMR和PLR与骨肉瘤预后的关系
- Relation Between NLR, LMR, PLR and Prognosis of Osteosarcoma
- 肿瘤防治研究, 2021, 48(4): 381-386
- Cancer Research on Prevention and Treatment, 2021, 48(4): 381-386
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2021.20.0895
- 收稿日期: 2020-07-27
- 修回日期: 2020-12-22
2. 830011 乌鲁木齐,新疆医科大学;
3. 830011 乌鲁木齐,新疆医科大学第七附属医院肿瘤科;
4. 830011 乌鲁木齐,新疆医科大学第一附属医院骨肿瘤外科
2. Xinjiang Medical University, Urumqi 830011, China;
3. Department of Oncology, The Seventh Affiliated Hospital of Xinjiang Medical University, Urumqi 830011, China;
4. Department of Bone Tumor Surgery, The First Affiliated Hospital of Xinjiang Medical University, Urumqi 830011, China
骨肉瘤(osteosarcoma)是严重威胁人类健康和生命的一种原发性、恶性、成骨性肿瘤,在我国发生率约为3/100万,好发于15~25岁的青少年,好发部位在股骨远端、胫骨近端等血运丰富的干骺端,肺部转移是死亡的主要原因[1]。尽管近几十年来骨肉瘤的诊断和治疗取得了很大进展,患者五年生存率提高至80%[2],但原发性骨肉瘤患者行手术切除后局部复发或转移等并发症导致治疗效果仍令人不满意,患者的致残率、死亡率仍然较高,长期预后不理想。越来越多证据表明,不同类型恶性肿瘤的预后和临床治疗结果不仅取决于临床治疗方式和病理特征,还取决于宿主相关炎性反应和免疫功能状态[3-5]。肿瘤微环境相关炎性反应具有显著促癌作用,包括血管生成和转移、破坏适应性免疫反应及促进肿瘤细胞的增殖和存活[6-7];良好的免疫状态具有抑制肿瘤作用,免疫细胞通常存在于癌症微环境中杀灭肿瘤细胞[8]。很多研究人员对肿瘤微环境和血液循环中局部或全身炎性反应以及免疫功能状态的候选生物标志物进行了研究,希望对癌症行为的预防有更深入的了解。然而,研究这些生物标志物成本昂贵,工作繁冗,可能临床上无法广泛检测。因此,开发廉价、可靠和容易获得的预后标志物是非常有价值的研究目标[9]。在这方面,一些炎性反应生物标记和血液指标与多种疾病临床结果之间的密切关系引起了学者们的兴趣,包括中性粒细胞/淋巴细胞比值(NLR)、淋巴细胞/单核细胞比值(LMR)、血小板/淋巴细胞比值(PLR),它们一直用于评估各种恶性肿瘤预后。本回顾性研究中,根据资料和相关医学文献,分析既往骨肉瘤患者的外周血中NLR、PLR和LMR与预后因素是否相关,以求寻找可靠的预后预测指标,临床上指导术前、术后积极治疗和密切随访。
1 资料与方法 1.1 病例资料收集2012年6月—2017年6月在新疆医科大学第一附属医院骨肿瘤外科接受治疗的骨肉瘤患者70例。其中男32例、女38例;年龄7~64岁;汉族18例、维吾尔族36例、哈萨克族8例、其他民族8例;股骨43例、胫骨15例、肱骨9例、其他部位3例。入组标准:组织学确诊的骨肉瘤患者。排除标准:确诊前两周输血或献血;确诊前两周使用过促血小板、白细胞生成药;确诊时存在感染;有除骨肉瘤外其他严重基础疾病及激素服药史。
收集该70例骨肉瘤患者首次确诊时的血常规结果、性别、年龄、主诉、肺转移情况及3年、5年生存率等资料进行分析。
1.2 随访以病历或电话等方式进行随访,记录随访结束时患者的生存状态。以骨肉瘤相关死亡及>60月为事件终点,全部生存时间为12月~60月,中位生存时间为45月。
1.3 统计学方法采用SPSS21.0软件进行数据统计分析,以α=0.05作为组间比较的检验水准。对于描述性统计量,分类资料用例数和百分数(%)表示。受试者工作特征(receiver operating characteristic, ROC)曲线确定指标的截断值(Cut-off)。卡方检验比较各组间的差异。Kaplan-Meier法得出各组的5年生存率和3年生存率,用Log rank法检验组间的生存率差异。Cox比率风险回归模型对可能影响预后的因素进行风险评估。
2 结果 2.1 NLR、LMR、PLR的ROC曲线分析结果ROC曲线分析结果显示,NLR预测最佳诊断Cut-off值为3.025,诊断的敏感度与特异性分别是80.9%、66.7%,LMR预测最佳诊断Cut-off值为4.82,诊断的敏感度与特异性分别是74.5%、76.2%,PLR预测最佳诊断Cut-off值为111.5,诊断的敏感度与特异度分别是48.9%、95.2%,均诊断价值较高,见表 1。
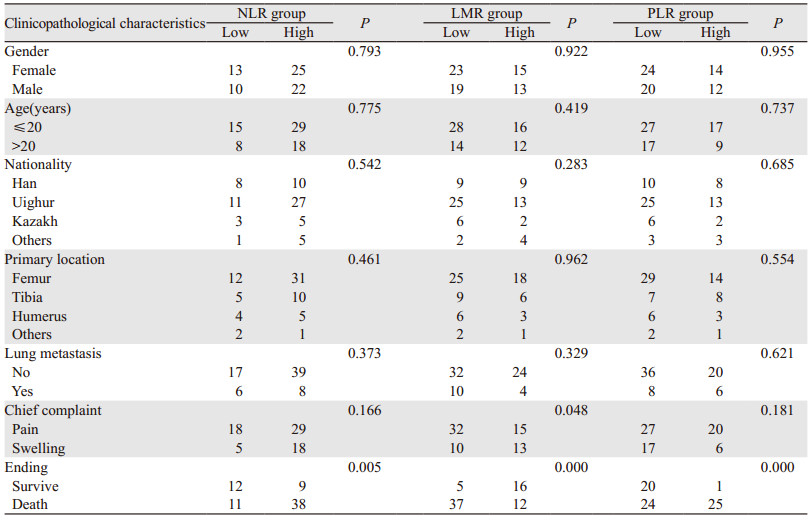
高低NLR、LMR、PLR组间的死亡率差异均有统计学意义(P < 0.05),NLR、PLR高组的死亡率均显著高于低组,LMR高组的死亡率均显著低于低组;且低LMR组的主诉为疼痛的概率显著高于高LMR组。组间性别、年龄、民族、部位、是否肺转移等临床特征比较,差异均无统计学意义(P > 0.05),见表 2。
|
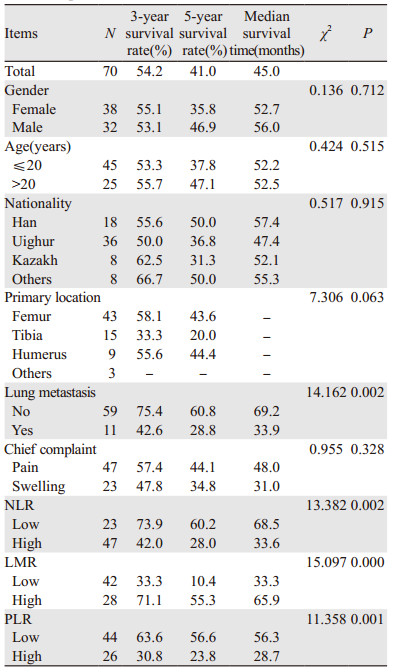
经Kaplan-Meier单因素生存分析,70例骨肉瘤患者总的3年生存率为54.2%,5年生存率为41.0%,中位生存时间为45.0月,高NLR组患者的3年、5年生存率为42.0%、28.0%,低NLR组的3年、5年生存率为73.9%、60.2%(P=0.002),高LMR组患者的3年、5年生存率为71.1%、55.3%(P < 0.001),低LMR组的3年、5年生存率为33.3%、10.4%,高PLR组患者的3年、5年生存率为30.8%、23.8%,低PLR组的3年、5年生存率为63.6%、56.6%(P=0.001)。高低NLR、LMR、PLR组间的生存率差异均有统计学意义(P < 0.05),且NLR、PLR越低,生存率越高;LMR越高,生存率越高;是否肺转移与生存率有统计学意义(P < 0.05)。其余不同特征人群的生存率比较差异均无统计学意义(P > 0.05),见表 3。
|
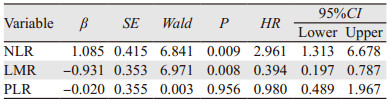
Cox回归分析结果显示,NLR、LMR两个指标与患者死亡存在显著相关性(P < 0.05)。NLR每增加一个单位,死亡率增加2.961倍(OR=2.961);LMR每增加一个单位,死亡率下降0.606倍(OR=0.394);而PLR指标不是影响患者死亡的独立影响因素(P > 0.05),见表 4。
|
炎性反应和癌症之间的联系早在一个多世纪前就已为人所知,但在不同类型的癌症中,炎性反应标志物与预后之间的关系近期才被发现[10-15]。据报道NLR、LMR和PLR与全身不同类型癌症患者的生存期显著相关,在肝癌、口腔癌、结直肠癌、子宫内膜癌、乳腺癌、淋巴瘤、胃癌中均报道高NLR与预后不良相关[15-22],在乳腺癌、淋巴瘤、胃癌、肺癌、舌癌、转移性结直肠癌、子宫颈癌中,低LMR与生存期缩短有显著相关性[20-27],还有子宫内膜癌、乳腺癌均报道PLR与预后不良相关[18, 20, 28]。然而,国内外对于骨肉瘤炎性反应生物标志物的预后作用研究较少。本研究尝试以外周血NLR、LMR、PLR值作为评估骨肿瘤患者的预后指标,并建立预测模型以提高预测准确性,由于外周血细胞计数检测在所有癌症患者中常规进行,因此它是一种简单、可重复、廉价的炎性反应参数,也是一种可作为评估预后的生物标志物。相关文献显示:(1)外周血淋巴细胞可以迁移至肿瘤微环境中,形成肿瘤浸润淋巴细胞,诱导肿瘤细胞凋亡,从而抑制肿瘤的生长及转移[29];(2)外周血中性粒细胞通过产生细胞因子和趋化因子与肿瘤细胞相互作用,进而影响肿瘤细胞的增殖、血管生成和转移[30];(3)单核细胞分泌多种促炎细胞因子,如白介素(IL)-1、IL-6、IL-10和肿瘤坏死factor-α,一直与患者短生存和预后差相关[31]。此外,来自循环单核细胞的肿瘤相关巨噬细胞抑制适应性免疫,促进血管生成、侵袭、迁移和肿瘤生长[32];(4)在肿瘤微环境相关研究中揭示血小板可促进血管生成、肿瘤的增殖、侵袭等恶性生物学行为[33]。
3.1 NLRNLR反映宿主的炎性反应和肿瘤的进展程度。由于中性粒细胞增多或淋巴细胞降低,对肿瘤细胞的繁殖提供良好的微环境,高NLR与较差的预后相关。有研究[34-35]发现NLR是影响骨肉瘤患者预后的独立因素,本研究也证实了这一指标作为预测骨肉瘤患者预后的可靠性。单因素分析提示高NLR为影响骨肉瘤患者的死亡因素,低NLR组的生存期明显高于高NLR组,多因素分析提示NLR为影响骨肉瘤患者总生存的独立预后因素,与骨肉瘤预后呈负相关性,提示NLR可作为骨肉瘤患者的预后价值。
3.2 LMRLMR反映宿主的免疫状态和肿瘤的进展程度。由于淋巴细胞较少和单核细胞升高反映了抗肿瘤免疫不足,且肿瘤的负荷增加,低LMR与较差的预后相关。本研究单因素分析提示LMR为影响骨肉瘤患者死亡的因素,多因素分析提示LMR为影响总生存的独立预后因素,与骨肉瘤的预后呈正相关性。提示LMR可作为骨肉瘤患者的预后价值。有研究[35-36]发现低LMR与骨肉瘤预后不良有关,对软组织肉瘤的预后分析也发现,该指标可作为影响软组织肉瘤预后的独立危险因素[37],均与本研究结果一致。
3.3 PLR杨万波等[35]研究发现高PLR预示骨肉瘤较差的临床预后。虽然本研究单因素分析提示高PLR为影响骨肉瘤死亡因素,但多因素分析提示PLR与3年、5年生存率无统计学差异,不是骨肉瘤生存的独立预后因素。
本研究存在一定局限性:首先,这项研究是单一回顾性研究,小群体70例;其次,未对该人群的肿瘤微环境进行正式的调查。肿瘤微环境是一个复杂的演化系统,具有多种非恶性细胞和多种恶性克隆。未来的研究应将外周血淋巴细胞、中性粒细胞、单核细胞计数及血小板绝对计数与微环境数据联系起来;最后,骨肉瘤患者术后的治疗存在一定的异质性,导致了不同的临床预后。因此,需要进一步的前瞻性研究来阐明骨肉瘤患者LMR、NLR、PLR与预后的关系。
综上所述,术前NLR、LMR与骨肉瘤患者的临床预后有关。NLR > 3.025、LMR < 4.82者生存期较短,可能需要更积极的化疗和密切的随访来改善临床治疗结果,而PLR对骨肉瘤预后的影响不大。未来有必要对LMR、NLR、PLR设计严密的前瞻性研究,以进一步证实本研究结论。
作者贡献:
叶尔哈那提·胡杜斯:收集、整理资料、文献检索及论文撰写
阿尔恒别克·吐汗拜:数据统计分析、修改核对文章
艾克拜尔·尤努斯:研究设计、指导及审阅文章
| [1] |
Isakoff MS, Bielack SS, Meltzer P, et al. Osteosarcoma: Current Treatment and a Collaborative Pathway to Success[J]. J Clin Oncol, 2015, 33(27): 3029-3035. DOI:10.1200/JCO.2014.59.4895 |
| [2] |
黄志鹏, 宋科官. 骨肉瘤的诊断及治疗进展[J]. 国际骨科学杂志, 2018, 39(3): 150-153. [Huang ZP, Song KG. Progress in the diagnosis and treatment of osteosarcoma[J]. Guo Ji Gu Ke Xue Za Zhi, 2018, 39(3): 150-153. DOI:10.3969/j.issn.1673-7083.2018.03.007] |
| [3] |
Park JH, Watt DG, Roxburgh CS, et al. Colorectal Cancer, Systemic Inflammation, and Outcome: Staging the Tumor and Staging the Host[J]. Ann Surg, 2016, 263(2): 326-336. DOI:10.1097/SLA.0000000000001122 |
| [4] |
Liu X, Chen S, Liu J, et al. Impact of systemic inflammation on gastric cancer outcomes[J]. PLoS One, 2017, 12(3): e174085. |
| [5] |
Feng F, Sun L, Zheng G, et al. Low lymphocyte-to-white blood cell ratio and high monocyte-to-white blood cell ratio predict poor prognosis in gastric cancer[J]. Oncotarget, 2017, 8(3): 5281-5291. DOI:10.18632/oncotarget.14136 |
| [6] |
Lichtman MA. A Bacterial Cause of Cancer: An Historical Essay[J]. Oncologist, 2017, 22(5): 542-548. DOI:10.1634/theoncologist.2017-0007 |
| [7] |
Mantovani A, Allavena P, Sica A, et al. Cancer-related inammation[J]. Nature, 2008, 454(7203): 436-444. DOI:10.1038/nature07205 |
| [8] |
Hanahan D, Weinberg RA. Hallmarks of cancer: the next generation[J]. Cell, 2011, 144(5): 646-674. DOI:10.1016/j.cell.2011.02.013 |
| [9] |
Bowen RC, Little NAB, Harmer JR, et al. Neutrophil-to-lymphocyte ratio as prognostic indicator in gastrointestinal cancers: a systematic review and meta-analysis[J]. Oncotarget, 2017, 8(19): 32171-32189. DOI:10.18632/oncotarget.16291 |
| [10] |
Maeda K, Shibutani M, Otani H, et al. Prognostic value of preoperative inflammation-based prognostic scores in patients with stage Ⅳ colorectal cancer who undergo palliative resection of asymptomatic primary tumors[J]. Anticancer Res, 2013, 33(12): 5567-5573. |
| [11] |
Watt DG, Proctor MJ, Park JH, et al. The Neutrophil-Platelet Score (NPS) Predicts Survival in Primary Operable Colorectal Cancer and a Variety of Common Cancers[J]. PLoS One, 2015, 10(11): e142159. |
| [12] |
Aggarwal BB, Vijayalekshmi RV, Sung B. Targeting inflammatory pathways for prevention and therapy of cancer: short-term friend, long-term foe[J]. Clin Cancer Res, 2009, 15(2): 425-430. DOI:10.1158/1078-0432.CCR-08-0149 |
| [13] |
Huang SH, Waldron JN, Milosevic M, et al. Prognostic value of pretreatment circulating neutrophils, monocytes, and lymphocytes in oropharyngeal cancer stratified by human papillomavirus status[J]. Cancer, 2015, 121(4): 545-555. DOI:10.1002/cncr.29100 |
| [14] |
Song A, Eo W, Lee S. Comparison of selected inflammation-based prognostic markers in relapsed or refractory metastatic colorectal cancer patients[J]. World J Gastroenterol, 2015, 21(43): 12410-12420. DOI:10.3748/wjg.v21.i43.12410 |
| [15] |
Kinoshita A, Onoda H, Imai N, et al. Comparison of the prognostic value of inflammation-based prognostic scores in patients with hepatocellular carcinoma[J]. Br J Cancer, 2012, 107(6): 988-993. DOI:10.1038/bjc.2012.354 |
| [16] |
Bobdey S, Ganesh B, Mishra P, et al. Role of Monocyte Count and Neutrophil-to-Lymphocyte Ratio in Survival of Oral Cancer Patients[J]. Int Arch Otorhinolaryngol, 2017, 21(1): 21-27. |
| [17] |
Shibutani M, Maeda K, Nagahara H, et al. A high preoperative neutrophil-to-lymphocyte ratio is associated with poor survival in patients with colorectal cancer[J]. Anticancer Res, 2013, 33(8): 3291-3294. |
| [18] |
Temur I, Gulec UK, Paydas S, et al. Prognostic value of pre-operative neutrophil/lymphocyte ratio, monocyte count, mean platelet volume, and platelet/lymphocyte ratio in endometrial cancer[J]. Eur J Obstet Gynecol Reprod Biol, 2018, 226: 25-29. DOI:10.1016/j.ejogrb.2018.05.028 |
| [19] |
Losada B, Guerra JA, Malón D, et al. Pretreatment neutrophil/lymphocyte, platelet/lymphocyte, lymphocyte/monocyte, and neutrophil/monocyte ratios and outcome in elderly breast cancer patients[J]. Clin Transl Oncol, 2019, 21(7): 855-863. DOI:10.1007/s12094-018-1999-9 |
| [20] |
徐良, 张百红. 淋巴细胞相关炎性反应指标与乳腺癌预后的相关性[J]. 肿瘤防治研究, 2020, 47(12): 936-941. [Xu L, Zhang BH. Prognostic value of lymphocyte-ascociated inflammatory markers in breast cancer[J]. Zhong Liu Fang Zhi Yan Jiu, 2020, 47(12): 936-941. DOI:10.3971/j.issn.1000-8578.2020.20.1179] |
| [21] |
Lee SF, Luque-Fernandez MA. Prognostic value of lymphocyte-to-monocyte ratio and neutrophil-to-lymphocyte ratio in follicular lymphoma: a retrospective cohort study[J]. BMJ Open, 2017, 7(11): e17904. |
| [22] |
Lieto E, Galizia G, Auricchio A, et al. Preoperative Neutrophil to Lymphocyte Ratio and Lymphocyte to Monocyte Ratio are Prognostic Factors in Gastric Cancers Undergoing Surgery[J]. J Gastrointest Surg, 2017, 21(11): 1764-1774. DOI:10.1007/s11605-017-3515-x |
| [23] |
Lee SF, Ng TY, Spika D. Prognostic value of lymphocyte-monocyte ratio at diagnosis in Hodgkin lymphoma: a meta-analysis[J]. BMC Cancer, 2019, 19(1): 338. DOI:10.1186/s12885-019-5552-1 |
| [24] |
刘建清, 林秀华, 沈志勇. 淋巴细胞与单核细胞比值对晚期肺癌预后预测的价值[J]. 现代肿瘤医学, 2018, 26(11): 1706-1710. [Liu JQ, Lin XH, Shen ZY. Clinical research for lymphocyte and monocyte ratio on prognosis of advanced-stage lung cancer[J]. Xian Dai Zhong Liu Yi Xue, 2018, 26(11): 1706-1710. DOI:10.3969/j.issn.1672-4992.2018.11.015] |
| [25] |
Furukawa K, Kawasaki G, Naruse T, et al. Prognostic Significance of Pretreatment Lymphocyte-to-Monocyte Ratio in Patients with Tongue Cancer[J]. Anticancer Res, 2019, 39(1): 405-412. DOI:10.21873/anticanres.13126 |
| [26] |
Shibutani M, Maeda K, Nagahara H, et al. Prognostic significance of the lymphocyte-to-monocyte ratio in patients with metastatic colorectal cancer[J]. World J Gastroenterol, 2015, 21(34): 9966-9973. DOI:10.3748/wjg.v21.i34.9966 |
| [27] |
徐璐, 唐晶晶, 王侠. 局部晚期子宫颈癌患者外周血淋巴细胞与单核细胞比值的预后价值[J]. 肿瘤研究与临床, 2019, 31(8): 520-524. [Xu L, Tang JJ, Wang X. Prognostic value of lymphocyte-to-monocyte ratio in peripheral blood of patients with locally advanced cervical cancer[J]. Zhong Liu Yan Jiu Yu Lin Chuang, 2019, 31(8): 520-524. DOI:10.3760/cma.j.issn.1006-9801.2019.08.004] |
| [28] |
Cho U, Park HS, Im SY, et al. Prognostic value of systemic inflammatory markers and development of a nomogram in breast cancer[J]. PLoS One, 2018, 13(7): e0200936. DOI:10.1371/journal.pone.0200936 |
| [29] |
Rosenberg SA. Progress in human tumour immunology and immunotherapy[J]. Nature, 2001, 411(6835): 380-384. DOI:10.1038/35077246 |
| [30] |
Evani SJ, Prabhu RG, Gnanaruban V, et al. Monocytes mediate metastatic breast tumor cell adhesion to endothelium under flow[J]. FASEB J, 2013, 27(8): 3017-3029. DOI:10.1096/fj.12-224824 |
| [31] |
Pollard JW. Tumour-educated macrophages promote tumour progression and metastasis[J]. Nat Rev Cancer, 2004, 4(1): 71-78. DOI:10.1038/nrc1256 |
| [32] |
Condeelis J, Pollard JW. Macrophages: obligate partners for tumor cell migration, invasion, and metastasis[J]. Cell, 2006, 124(2): 263-266. DOI:10.1016/j.cell.2006.01.007 |
| [33] |
Sol N, Wurdinger T. Platelet RNA signatures for the detection of cancer[J]. Cancer Metastasis Rev, 2017, 36(2): 263-272. DOI:10.1007/s10555-017-9674-0 |
| [34] |
Liu B, Huang Y, Sun Y, et al. Prognostic value of inflammation-based scores in patients with osteosarcoma[J]. Sci Rep, 2016, 6: 39862. DOI:10.1038/srep39862 |
| [35] |
杨万波, 施俊, 何晶, 等. 术前中性粒细胞淋巴细胞、血小板淋巴细胞和淋巴细胞单核细胞比值对骨肉瘤患者预后的影响[J]. 中华实验外科杂志, 2019, 36(11): 1963-1965. [Yang WB, Shi J, He J, et al. Prognostic value of pre-treatment neutrophil-to-lymphocyte ratio, platelet-to-ymphocyte ratio and lymphocyte-to-monocyte ratio in patients with osteosarcoma[J]. Zhonghua Shi Yan Wai Ke Za Zhi, 2019, 36(11): 1963-1965. DOI:10.3760/cma.j.issn.1001-9030.2019.11.012] |
| [36] |
Liu T, Fang XC, Ding Z, et al. Pre-operative lymphocyte-to-monocyte ratio as a predictor of overall survival in patients suffering from osteosarcoma[J]. FEBS Open Bio, 2015, 5: 682-687. DOI:10.1016/j.fob.2015.08.002 |
| [37] |
Mirili C, Paydaş S, Guney IB, et al. Assessment of potential predictive value of peripheral blood inflanunatory ndexes in 26 cases with soft tissue sarcoma treated by pazopanib: a retrospective study[J]. Cancer Manag Res, 2019, 11: 3445-3453. DOI:10.2147/CMAR.S191199 |
 2021, Vol. 48
2021, Vol. 48