文章信息
- 比卡鲁胺对乳腺癌细胞株MDA-MB-453的作用机制及与依维莫司联用的效果评估
- Mechanism of Bicalutamide to Breast Cancer Cell Lines MDA-MB-453 and Inhibitory Effects of Its Combination with Everolimus
- 肿瘤防治研究, 2021, 48(3): 239-243
- Cancer Research on Prevention and Treatment, 2021, 48(3): 239-243
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2021.20.0819
- 收稿日期: 2020-07-16
- 修回日期: 2020-12-12
2. 530021 南宁,广西医科大学第一附属医院胃肠腺体外科
2. Gastrointestinal and Gland Surgery, The First Affiliated Hospital of Guangxi Medical University, Nanning 530021, China
激素受体阳性的乳腺癌约占全部乳腺癌的75%,内分泌治疗的出现极大改善了这部分乳腺癌患者的预后,但是现有的内分泌治疗药物仅针对ER(+)、PR(+)的患者,部分ER(-)、PR(-)患者不能从中获益。大量实验证明,雄激素受体(androgen receptor, AR)在乳腺癌组织中存在高表达[1],LAR型乳腺癌被认为有较好的预后、较低的化疗反应率及pCR率[2],我们前期实验也证明,AR的表达与ER、PR的表达相关,且与乳腺癌的组织学分级和患者月经状态有关[3]。因此我们认为以AR为靶点的内分泌治疗有可能改善部分乳腺癌患者的生存。有研究表明AR的表达与PI3K/AKT/mTOR通路的突变存在一定联系,PI3K在AR阳性乳腺癌中的突变率是阴性者的10倍[4],AR过表达的MDA-MB-453乳腺癌细胞株中,在给予AR受体抑制剂比卡鲁胺后,AKT的表达受到明显抑制[3]。依维莫司是哺乳动物雷帕霉素(mammalian target of rapamycin, mTOR)抑制剂,可抑制细胞的生长、增殖及血管形成[5]。本研究旨在进一步探索AR在乳腺癌中的作用机制及以依维莫司为代表的PI3K通路抑制剂与比卡鲁胺联用对乳腺癌细胞株增殖作用的影响。
1 材料与方法 1.1 细胞培养人乳腺癌细胞株MDA-MB-231、MCF-7由广西医科大学病理科提供,MDA-MB-453购自中国科学院上海细胞库,MDA-MB-231、MDA-MB-453细胞用含10% 胎牛血清的RPMI1640培养基培养,MCF-7细胞用含10% 胎牛血清的DMEM培养基培养,并置于37 ℃、5%CO2培养箱中培养。
1.2 试剂比卡鲁胺(CDX)购自美国Sigma公司,四甲基偶氮唑蓝(MTT)购于美国Sigma公司,依维莫司购自美国Selleck公司,兔抗人mTOR、p-mTOR、p-S6购自美国Cell Signaling Technology公司,Transwell小室购自美国Costar公司,Matrigel胶购自美国BD公司。
1.3 Western blot检测用药前后mTOR、p-mTOR及p-S6的表达水平取对数生长期细胞,调整MDA-MB-231及MCF-7细胞浓度为每毫升0.5×103个,MDA-MB-453细胞浓度为每毫升4×103个,分成实验组:每孔加入30 μmol/ L比卡鲁胺稀释液200 μl,空白组:只加2 00 μ l培养基,作用细胞6天后,收集提取各组蛋白,BCA法测定蛋白浓度,按照标准Western blot步骤,依次进行电泳,转膜,5% 牛奶封闭,一抗(mTOR 1 : 1 000, p-mTOR 1 : 1 000,p-S6:1 : 1 000)4 ℃过夜,TBS-T洗膜3次,二抗(1 : 10 000)室温孵育90 min,TBS-T洗膜,曝光,GAPDH作内参,运用Image J软件进行分析。
1.4 Transwell检测联合用药对细胞迁移侵袭影响将各组细胞置于无血清培养基中饥饿培养24 h后,以每毫升2×106个浓度接种于8 mm孔径的Transwell小室上室(上室铺经无血清培养基稀释后的Matrigel胶,Matrigel : 无血清培养基=1 : 9),小室内细胞置于200 μl无血清RPMI1640培养基中,下室为200 μl含20% 胎牛血清的RPMI1640培养基,将培养板在37 ℃、5%CO2、湿度适宜的培养箱中培养48 h,对下室细胞进行结晶紫染色,并拍照计数。
1.5 MTT方法检测药物抑制率取对数生长期细胞,调整MDA-MB-453细胞终浓度为每毫升6×103个,按每孔100 μl接种于96孔板中,放入恒温培养箱中培养24 h,待细胞贴壁后吸尽孔内培养基,分三组:依维莫司单药组:每孔分别加入200 μl不同浓度依维莫司(30、25、20、10、5 μmol/L);比卡鲁胺单药组:每孔加入200 μl 30 μmol/L的比卡鲁胺;联合用药组:依维莫司(30、25、20、10、5 μmol/L)+ 比卡鲁胺30 μmol/L;空白组:只加入200 μl培养基,每组设3个副孔。药物作用72 h后,每孔加入20 μ l 5 mg/ml的MTT溶液。置于恒温细胞培养箱内继续培养4 h。最后用酶标仪测量各孔在490 nm处的吸光度值,并记录结果,分别算出单药及联用时的IC50,绘制药物抑制率曲线。
1.6 金正均法计算两药联用指数采用金正均Q值计算法[6]评估两药联用效果,公式:Q =Ea+b / (Ea+Eb-Ea× Eb),公式中Ea+b为联合用药处理组的抑制率,Ea、Eb分别为a药和b药单独处理时的抑制率。若Q值为0.85~1.15表示两药合用单纯相加,若Q >1.15表示两药联用有协同作用,若Q <0.85表示两药合用有拮抗作用。
1.7 统计学方法采用SPSS17.0统计学软件分析,计量资料用均数±标准差(x±s)表示,多个样本均数比较用方差分析,实验组与对照组比较采用SNK法;两个独立样本均数比较采用t检验。P <0.05表示差异具有统计学意义。
2 结果 2.1 比卡鲁胺对乳腺癌细胞株及mTOR磷酸化的影响根据前期MTT实验结果,30 μmol/L的比卡鲁胺处理乳腺癌细胞株MDA-MB-231、MCF-7、MDA-MB-453,6天后实验组中mTOR的表达较对照组均有下降(实验组:0.90±0.08、0.81±0.03、0.74±0.04,空白组:0.94±0.02、0.9±0.13、1.05±0.07),其中在MDA-MB-231及MCF-7细胞中差异无统计学意义(t =0.79、0.95, P =0.51、0.51),在MDA-MB-453细胞中差异具有统计学意义(t =0.04, P =0.04),实验组与空白组中p-mTOR表达量不同(实验组:0.65± 0.05、1.12±0.06、1.28±0.10,空白组:0.74±0.09、1.28±0.17、1.68±0.06),其中在MDA-MB-453中差异具有统计学意义(t =0.038, P =0.049),在其余两株细胞中无明显差异(t =0.79、0.95, P =0.51、0.50)。三株细胞系中p-S6的表达在实验组与空白组比较差有统计学意义(实验组:0.68±0.03、0.57±0.03、0.26±0.07,空白组:0.60±0.04、0.70±0.05、0.57±0.04),其中在M DA-MB-453中的表达差异具有统计学意义(t =5.57, Ρ =0.03),而在其余两株细胞中均未见明显差异(t =2.35、3.28, P =0.143、0.082)。Western blot结果显示,MDA-MB-453细胞中mTOR、p-mTOR、p-S6的表达均较空白组明显降低,而MDA-MB-231和MCF-7实验组中mTOR、p-mTOR、p-S6的表达较空白组均未见明显下降,见图 1。
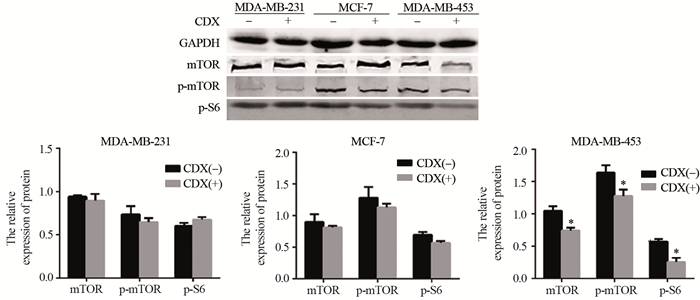
|
| *: P<0.05, CDX(+) group vs. CDX(-) group 图 1 比卡鲁胺作用前后MDA-MB-231、MCF-7和MDA-MB-453细胞中mTOR、p-mTOR和p-S6表达 Figure 1 Expression of mTOR, p-mTOR and p-S6 in breast cancer cell lines MDA-MB-231, MCF-7 and MDA-MB-453 before and after bicalutamide treatment |
比卡鲁胺作用乳腺癌细胞株6天后,细胞迁移实验中,实验组MDA-MB-453细胞中穿膜细胞数(11.33±3.72)个,空白组(27.75±5.31)个,差异具有统计学意义(t = - 4.88, Ρ =0.001);实验组MCF-7穿膜细胞数(35.00±3.37)个,空白组(23.25±5.25)个,差异无统计学意义(t =2.31, P =0.06);实验组MDA-MB-231细胞中穿膜细胞数(28.62± 6.24)个,空白组(25.00±5.05)个,差异无统计学意义(t =0.87, P =0.42)。在侵袭实验中,实验组MDA-MB-453细胞中穿膜细胞数(16.83±7.11)个,空白组(27.75±4.65)个,差异具有统计学意义(t = - 2.68, P =0.03);实验组MCF-7细胞中穿膜细胞数(32.60±5.90)个,空白组(34.40±8.26)个,差异无统计学意义(t = - 0.37, P =0.72);实验组MDA-MB-231细胞中穿膜细胞数(32.00±4.24)个,空白组(30.67± 9.07)个,差异无统计学意义(t =0.86, P =0.86),见图 2。
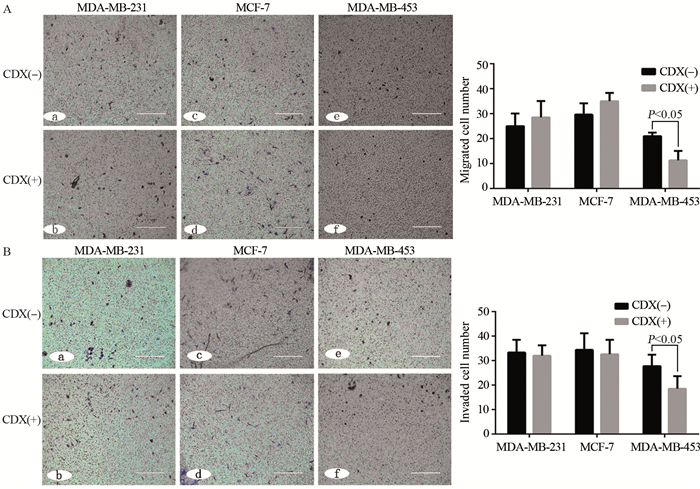
|
| 图 2 三株乳腺癌细胞株迁移(A)和侵袭(B)实验结果 Figure 2 Migration (A) and invasion (B) tests of three breast cancer cell lines |
MTT实验结果显示,依维莫司单药作用MDA-MB-453细胞时IC50为(16.84±0.06)µmol/L,联用比卡鲁胺后,药物的IC50为(9.35±0.09)µmol/L。细胞抑制率曲线显示,联合用药后各组不同浓度下的抑制率均较单药组明显升高,比卡鲁胺单药组细胞的抑制率为(5.36±0.04)%。金正均法计算Q值发现依维莫司联用比卡鲁胺组的抑制率明显升高,且在各个浓度下Q值均>1.15,表明比卡鲁胺与依维莫司联合用药具有协同作用,见表 1。
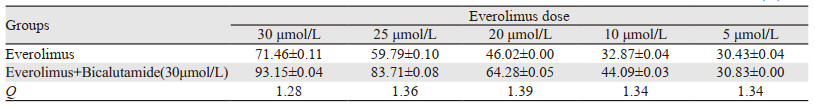
|
LAR亚型的三阴性乳腺癌(triple negative breast cancer, TNBC)存在PI3KCA及PTEN突变,对mTOR抑制剂较敏感[7],mTOR被细胞外生长信号激活后,通过磷酸化激活下游激酶,形成两个独立的复合物mTORC1和mTORC2,核糖体蛋白激酶(S6K)是mTOR下游调节因子,mTORC1-S6K复合物的形成可以控制DNA的损伤应答反应[8]。其表达量越高,对mTOR抑制剂的敏感度越强,提示S6K可作为预测mTOR抑制剂敏感度的指标[9]。
本课题组前期实验证实,MDA-MB-453为AR强阳性细胞株,MCA-7和MDA-MB-231为AR弱阳性细胞株,比卡鲁胺的抑制作用呈现时间及剂量依赖性,延长比卡鲁胺用药时间及增加药物浓度,可提高对MDA-MB-453细胞增殖抑制作用,而对MCF-7及MDA-MB-231细胞的增殖均未见明显影响[3]。PIK3CA所编码的蛋白是PI3K的一部分,能参与PI3K的活化,有研究证实,在AR阳性乳腺癌细胞中,PIK3CA的突变率为40%,远高于AR阴性的4%[10]。比卡鲁胺作用6天后,MDA-MB-453细胞迁移侵袭能力降低,mTOR、p-mTOR、p-S6的含量明显降低,表明比卡鲁胺能抑制mTOR/S6的磷酸化活性,从而抑制细胞增殖及迁移侵袭能力,但是对MCF-7、MDA-MB-231细胞株并未产生明显影响。
目前PI3K/AKT/mTOR通路抑制剂种类繁多,较明确的是mTOR抑制剂依维莫司,依维莫司作用于mTOR位点,是mTORC1的选择性抑制剂,与细胞内蛋白FKBP12结合形成的复合体mTORC1抑制mTOR的活性。mTOR的抑制可导致转录调节因子S6和真核生物延伸因子4E- 结合蛋白(4E-BP)活性的降低,从而干扰细胞周期、血管新生、糖酵解等相关蛋白的翻译和合成[11]。MCF-7中AKT的高表达,可使细胞产生内分泌治疗的抵抗,抑制AKT及mTOR可恢复其对他莫昔芬或来曲唑的敏感度并且促进细胞凋亡[12-13]。一项Ⅱ期临床实验表明,在ER阳性患者中,依维莫司能增加肿瘤细胞对来曲唑的敏感度[14]。在前列腺癌细胞中,同时抑制AR及PI3K较单用AR抑制剂或PI3K抑制剂能显著抑制肿瘤生长,促进细胞凋亡[15],在三阴性乳腺癌中,p-mTOR的表达与AR的表达相关,提示我们对于AR受体阳性的乳腺癌,抑制AR及mTOR受体可抑制肿瘤细胞增殖[16-17],因此猜想,依维莫司联合AR抑制剂可能增强对AR强阳性乳腺癌细胞的抑制效果。
为了进一步研究mTOR抑制剂依维莫司与比卡鲁胺联用对乳腺癌细胞株的效应作用,根据前期实验,本研究选择30 μmol/L的比卡鲁胺与不同浓度的依维莫司联用。联合用药后,在各个浓度下,药物的抑制率均较用药前增加,通过计算Q值发现,两药联用有协同作用。因此我们认为依维莫司能增加MDA-MB-453对比卡鲁胺的敏感度。
综上所述,比卡鲁胺对AR强阳性乳腺癌细胞MDA-MB-453的增殖抑制作用是通过抑制mTOR及其下游转录因子S6K的磷酸化实现的,并可抑制乳腺癌细胞的侵袭及迁移能力。AR可以作为乳腺癌的治疗靶点,本研究认为比卡鲁胺与依维莫司联用可增加乳腺癌细胞对抗雄激素治疗的敏感度,其抑制效果与AR的磷酸化程度及AR的表达量有关,AR的含量有可能成为预测抗AR治疗敏感度的标志,其临界值值得进一步研究。
作者贡献
张玉琴:实验实施,撰写论文
陆云飞:指导实验,数据整理
张海添:指导课题,设计实验
| [1] |
Collins LC, Cole KS, Marotti JD, et al. Androgen receptor expression in breast cancer in relation to molecular phenotype: results from the Nurses' Health Study[J]. Mod Pathol, 2011, 24(7): 924-931. DOI:10.1038/modpathol.2011.54 |
| [2] |
Gerratana L, Basile D, Buono G, et al. Androgen receptor in triple negative breast cancer: A potential target for the targetless subtype[J]. Cancer Treat Rev, 2018, 68: 102-110. DOI:10.1016/j.ctrv.2018.06.005 |
| [3] |
张玉琴, 张小彬, 李杰华, 等. 乳腺癌中AR的表达及其对不同乳腺癌细胞株的影响[J]. 临床与实验病理学杂志, 2018, 34(5): 486-491. [Zhang YQ, Zhang XB, Li JH, et al. Expression of AR in breast cancer and its effect on different breast cancer cell lines[J]. Lin Chuang Yu Shi Yan Bing Li Xue Za Zhi, 2018, 34(5): 486-491.] |
| [4] |
Powe DG, Voss MJ, Zänker KS, et al. Beta-Blocker Drug Therapy Reduces Secondary Cancer Formation in Breast Cancer and Improves Cancer Specific Survival[J]. Oncotarget, 2010, 1(7): 628-638. DOI:10.18632/oncotarget.197 |
| [5] |
Rugo HS, Keck S. Reversing hormone resistance: have we found the golden key?[J]. J Clin Oncol, 2012, 30(22): 2707-2709. DOI:10.1200/JCO.2012.42.1271 |
| [6] |
金正均, 张效文. 概率和曲线与"Q(50)"——估计合并用药效果的一种新方法[J]. 上海第二医学院学报, 1981(1): 15-18, 86. [Jin ZJ, Zhang XW. Equal probability sum curve and "Q(50)"-a new method to estimate the effect of combined medication[J]. Shanghai Di Er Yi Xue Yuan Xue Bao, 1981(1): 15-18, 86.] |
| [7] |
Costa RLB, Han HS, Gradishar WJ. Targeting the PI3K/AKT/mTOR pathway in triple-negative breast cancer: a review[J]. Breast Cancer Res Treat, 2018, 169(3): 397-406. DOI:10.1007/s10549-018-4697-y |
| [8] |
Xie X, Hu H, Tong X, et al. The mTOR-S6K pathway links growth signalling to DNA damage response by targeting RNF168[J]. Nat Cell Biol, 2018, 20(3): 320-331. DOI:10.1038/s41556-017-0033-8 |
| [9] |
Iwenofu OH, Lackman RD, Staddon AP, et al. Phospho-S6 ribosomal protein: a potential new predictive sarcoma marker for targeted mTOR therapy[J]. Mod Pathol, 2008, 21(3): 231-237. DOI:10.1038/modpathol.3800995 |
| [10] |
Lehmann BD, Bauer JA, Schafer JM, et al. PIK3CA mutations in androgen receptor-positive triple negative breast cancer confer sensitivity to the combination of PI3K and androgen receptor inhibitors[J]. Breast Cancer Res, 2014, 16(4): 406. DOI:10.1186/s13058-014-0406-x |
| [11] |
Lamberti G, Brighi N, Maggio I, et al. The Role of mTOR in Neuroendocrine Tumors: Future Cornerstone of a Winning Strategy?[J]. Int J Mol Sci, 2018, 19(3): 747. DOI:10.3390/ijms19030747 |
| [12] |
deGraffenried LA, Friedrichs WE, Russell DH, et al. Inhibition of mTOR Activity Restores Tamoxifen Response in Breast Cancer Cells with Aberrant Akt Activity[J]. Clin Cancer Res, 2004, 10(23): 8059-8067. DOI:10.1158/1078-0432.CCR-04-0035 |
| [13] |
Beeram M, Tan QTN, Tekmal RR, et al. Akt-induced endocrine therapy resistance is reversed by inhibition of mTOR signaling[J]. Ann Oncol, 2007, 18(8): 1323-1328. DOI:10.1093/annonc/mdm170 |
| [14] |
Baselga J, Semiglazov V, van Dam P, et al. Phase Ⅱ Randomized Study of Neoadjuvant Everolimus Plus Letrozole Compared With Placebo Plus Letrozole in Patients With Estrogen Receptor–Positive Breast Cancer[J]. J Clin Oncol, 2009, 27(16): 2630-2637. DOI:10.1200/JCO.2008.18.8391 |
| [15] |
Schwartz S, Wongvipat J, Trigwell CB, et al. Feedback suppression of PI3Kα signaling in PTEN-mutated tumors is relieved by selective inhibition of PI3Kβ[J]. Cancer Cell, 2015, 27(1): 109-122. DOI:10.1016/j.ccell.2014.11.008 |
| [16] |
Pistelli M, Ballatore Z, Santinelli A, et al. Phosphorylated mTOR is associated to androgen receptor expression in early triple-negative breast cancer[J]. Oncol Rep, 2016, 36(2): 755-762. DOI:10.3892/or.2016.4903 |
| [17] |
Gordon MA, D'Amato NC, Gu H, et al. Synergy between Androgen Receptor Antagonism and Inhibition of mTOR and HER2 in Breast Cancer[J]. Mol Cancer Ther, 2017, 16(7): 1389-1400. DOI:10.1158/1535-7163.MCT-17-0111 |
 2021, Vol. 48
2021, Vol. 48


