文章信息
- 抗血管生成靶向药物相关性肾脏损伤的研究进展
- Progress of Antiangiogenic Drug-induced Renal Injury
- 肿瘤防治研究, 2021, 48(4): 424-428
- Cancer Research on Prevention and Treatment, 2021, 48(4): 424-428
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2021.20.0807
- 收稿日期: 2020-07-13
- 修回日期: 2020-10-29
随着抗血管生成靶向药物的广泛使用,该类药物作为晚期实体肿瘤治疗手段的一部分已经成为一些情况下的标准治疗手段,在治疗晚期结直肠癌[1]、肾细胞癌[2]、非小细胞肺癌[3]等肿瘤中取得了良好的效果,能够显著提高抗肿瘤疗效,提高患者生存率,但在使用过程中仍存在严重不良反应,如心脏毒性、高血压、肾损伤等。因此了解这些常见不良反应及其潜在机制有利于更准确和更及时地诊断、制定合理的治疗方案来减少患者的死亡率,改善患者的生存质量。目前有关抗血管生成靶向药物导致的肾脏损伤的研究较少,因此本文着重讨论抗血管生成靶向药物导致肾脏损伤的潜在机制及其作为抗血管生成药物的临床有效生物标志物的潜在作用。
1 抗血管生成靶向药物的概述血管生成是指已有的血管形成新的血管的过程,它参与了机体的病理和生理过程。对于肿瘤组织而言,肿瘤血管生成是肿瘤生长、进展和转移的关键因素[4]。因此,抑制肿瘤血管生成便成为治疗实体肿瘤的一种办法,抗血管生成靶向药物成为当前的研究热点。参与血管生成的因素有很多,其中血管内皮生长因子(vascular endothelial growth factor, VEGF)发挥着最重要的作用。血管内皮生长因子(VEGF)家族包括8个成员:VEGF A到VEGF F及胎盘生长因子(PLGF)和EG-VEGF[5],而VEGF A最为重要。因此VEGF抑制剂大致可分为以下三类:抗VEGF抗体(如贝伐单抗(Bevacizumab))、VEGF受体竞争剂(如阿柏西普(Aflibercept))和VEGF受体酪氨酸激酶抑制剂(如索拉菲尼(Sorafenib)、苏尼替尼(Sunitinib)等)。
2 抗血管生成靶向药物相关性肾脏损伤的发病情况抗血管生成靶向药物导致的肾脏损伤常表现为蛋白尿、肾小球血栓性微血管病、急性肾衰等,以蛋白尿最为多见。在常规的临床实践中,蛋白尿的检测方法包括比色试纸、24 h尿液采集和尿蛋白/肌酐比值。根据美国卫生及公共服务部发布的常见不良反应术语评定标准(CTCAE)v4.0,蛋白尿的评判标准如下:1级:尿蛋白 < 1.0 g/24 h; 2级:尿蛋白1.0~3.5 g/24 h; 3级:尿蛋白≥3.5 g/24 h。
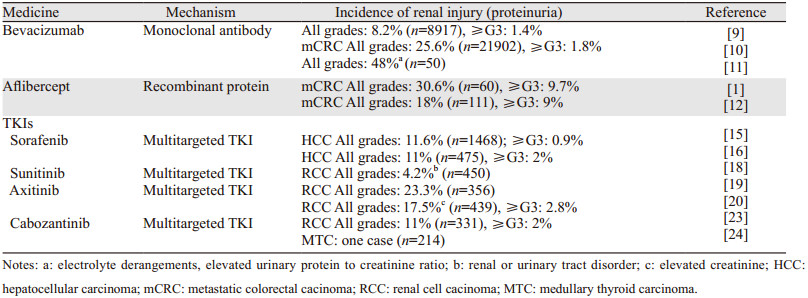
2.1贝伐珠单抗是一种重组人源单克隆抗体,能与所有已知的血管内皮生长因子A(VEGF-A)亚型结合,通过阻断内皮细胞表面VEGF-A与VEGF受体(主要是VEGFR-1和VEGFR-2)结合,发挥抗血管生成作用[6],因为VEGF-A与VEGFR-1和VEGFR-2结合,会促进内皮细胞增殖,激活生存途径,形成新生血管。因此贝伐珠单抗在治疗晚期癌症方面发挥重要作用[7-8]。在一项关于贝伐珠单抗治疗患者的汇总分析显示(n=14 548)中,贝伐珠单抗组和对照组的任意级蛋白尿发生率分别为8.2%(733/8 917)和4.6%(257/5 631),而3/4级蛋白尿发生率分别为1.4%和0.2%(P < 0.0001)[9]。一项关于治疗晚期转移性结直肠癌Meta分析(贝伐珠单抗组21 902例,对照组20 608例),显示在一线氟尿嘧啶单次化疗中加入贝伐珠单抗能显著延长老年转移性结直肠癌(mCRC)患者的无进展生存率和总生存率,但肾脏不良反应发生率远高于对照组(25.6% vs. 8.2%)[10]。贝伐珠单抗导致的肾脏损伤不仅包括蛋白尿,还包括肌酐升高、电解质紊乱。关于依维莫司和贝伐珠单抗治疗妇科肿瘤的临床试验(n=50)报道出现任意等级电解质紊乱、尿蛋白与肌酐比值升高不良反应的患者为24例(48%)[11]。
2.2阿柏西普通过竞争性阻断VEGF与受体结合发挥作用,是一种比贝伐珠单抗更有效的VEGF抑制剂。在一项关于阿柏西普治疗转移性结直肠癌的临床研究中(n=62),出现所有等级尿肌酐升高的比例为96.8%,3/4级肌酐升高发生率为1.6%。然而出现所有等级蛋白尿的比例为82.3%,高级别蛋白尿发生率为21%[1]。在另一项治疗转移性结直肠癌的临床研究中(实验组阿柏西普+FOLFIRI n=111,对照组安慰剂+FOLFIRI n=33),实验组中出现任意等级蛋白尿的患者为20例(18%),3/4级蛋白尿患者为10例(9%),而对照组未出现蛋白尿[12]。
2.3索拉菲尼酪氨酸激酶抑制剂(TKIs)通过阻断VEGF结合下游信号,达到抑制肿瘤血管生成的目的。索拉菲尼是第一个也是唯一一个被批准为治疗晚期肝癌的酪氨酸激酶抑制剂[13],同时索拉菲尼也可靶向Raf/Mek/Erk通路,具有双重抗癌机制[14]。一项关于索拉菲尼治疗晚期肝癌的Meta分析显示出现全等级蛋白尿的概率为11.6%,3、4级蛋白尿为0.9%[15]。而在另一项关于索拉菲尼与列文替尼治疗晚期肝癌比较的研究中显示列文替尼组(n=476)所有等级蛋白尿117例(25%),高等级蛋白尿27例(6%),而索拉菲尼组(n=475)所有等级蛋白尿54例(11%),高等级蛋白尿8例(2%)[16]。
2.4苏尼替尼是治疗转移性肾细胞癌(mRCC)的一线用药[17]。肾脏切除是mRCC的标准治疗方法,在一项治疗转移性肾透明细胞癌的临床实验中(n=450),作者通过比较苏尼替尼组与苏尼替尼+肾切组发现,两组的总生存率(OS)(HR=0.89, 95%CI: 0.71~1.1)、中位总生存期差异无统计学意义。但两组严重不良反应(3/4级)发生率差异有统计学意义(42.7% vs. 32.8%, P=0.04)。苏尼替尼组发生肾或尿路疾病9例(4.2%),而苏尼替尼+肾切组为1例(0.5%)(P=0.05)[18]。
2.5阿西替尼(Axitinib)是一种多位点VEGF酪氨酸激酶受体抑制剂,于2018年批准为晚期转移性肾癌二线治疗药物。在一项关于肾癌(RCC)临床试验中,实验组(n=356)发生全等级蛋白尿的患者83例(23.3%),对照组(n=359)发生率为7%[19]。近年来,阿西替尼常与PD-L1单克隆抗体联用治疗晚期转移性肾癌[20-21]。PD-L1单克隆抗体是一种抗程序性死亡抗体,是一种抗癌的新药[22]。一项治疗晚期肾癌的临床试验比较Pembrolizumab(PD-L1单克隆抗体)与阿西替尼联用组(n=432)与苏尼替尼组(n=429),发现两组存活12月的患者比例分别为89.9%和73.3%(HR=0.53, 95%CI: 0.38~0.74, P < 0.0001),而Pembrolizumab与阿西替尼联用组中有75例(17.5%)发生所有等级蛋白尿,3/4级蛋白尿患者12例(2.8%),苏尼替尼组(n=425)中有47例(11.1%)患者发生所有等级蛋白尿,6例(1.4%)患者发生3/4级蛋白尿[20]。这表明阿西替尼与PD-L1单抗联用可能更易发生肾脏损伤。2.6卡博替尼(Cabozanitinib)被用于治疗晚期肝癌、肾癌等。在一项治疗晚期肾癌的临床试验中(n=653),研究者将卡博替尼与依维莫司(晚期肾癌的二线治疗方案)比较发现卡博替尼组(n=331)和依维莫司组(n=322)发生所有等级蛋白尿的比例分别为11%和16%,3/4级蛋白尿发生率均为2%[23]。而在卡博替尼治疗甲状腺髓样癌的临床试验中(n=214)仅有1例发生蛋白尿[24],见表 1。
肾小球的滤过屏障由毛细血管内皮细胞、基膜和肾小囊脏层足细胞的足突构成,足细胞是肾小球中产生VEGF的主要来源[25]。相邻足细胞的足突交错,形成一个30~40 nm的过滤缝,这个缝隙被一层跨膜蛋白—肾病蛋白(nephrin)所覆盖,称为裂孔隔膜,nephrin的酪氨酸磷酸化在滤过屏障物质的电荷和大小选择性方面起着关键性作用[26]。研究显示,使用TKIs会导致裂孔隔膜、足细胞的破坏,进而导致蛋白尿等肾脏损害[27]。肾小球内皮细胞表达VEGF的酪氨酸激酶受体(VEGFR-1和VEGFR-2),其中VEGFR-2最为重要[28]。Maruyama等[29]报道了1例31岁男性横纹肌肉瘤患者经Pazopanib治疗后出现肾病综合征,肾活检显示内皮损伤伴足细胞改变,而停药后,患者的蛋白尿逐渐减少,表明VEGF抑制剂引起肾脏损伤的机制与足细胞改变密切相关。
3.2 内皮型一氧化碳合酶(eNOS)生成减少VEGF-A/VEGFR-2的关键下游信号通路包括MAPK/ERK1/2、eNOS和雷帕霉素的靶点(mTOR)等。VEGF信号通路可以促进eNOS产生一氧化氮(NO),NO是一种血管扩张剂,迅速在内皮内弥散,并且能发生长期的增殖反应,促进血管生成[30-31]。使用VEGF抑制剂,导致eNOS和NO减少,引起血管舒张障碍,激活了肾素-血管紧张素系统,导致高血压,进而引起蛋白尿[32]。同时有研究认为NO减少会导致血管内皮功能障碍,破坏了肾小球的滤过屏障,引起蛋白尿[33]。
3.3 肾小球血栓性微血管病肾小球血栓性微血管病(TMA)显著的特征是血管内皮细胞肿胀,部分血管腔内可见血栓形成,与子痫前期/子痫的病理相似[34],VEGF抑制剂常导致TMA[35-36]。Eremina等[28]报道了6例因使用VEGF抑制剂贝伐珠单抗导致肾小球血栓性微血管病的病例。为了证实肾脏内VEGF局部减少可以导致肾小球血栓性微血管病,研究者靶向敲除大鼠肾脏足细胞VEGF基因,强力霉素诱导4周后,62只VEGF突变大鼠出现蛋白尿、肌酐升高。电镜观察显示出典型的肾小球血栓性微血管病变。Pfister等[37]对接受VEGF抑制剂后患TMA的患者进行肾脏活检,并与其他原因(如非典型溶血性蛋白尿综合征、高血压)导致的TMA比较,发现前者的典型形态特征为节段性肾小球毛细血管微动脉瘤和节段性透明蛋白病。
4 肾脏损伤与药物治疗效果的联系在VEGF抑制剂治疗晚期癌症过程中,常常会发生蛋白尿、肌酐升高、TMA等肾脏损伤。有研究试图将这些肾脏损伤与药物治疗效果、预后联系起来,但结果矛盾。Carvalho等[38]评估了140例接受贝伐珠单抗治疗的胶质瘤患者的生存和临床数据以及蛋白尿等不良反应发生率,通过统计学方法得出,发生蛋白尿患者的PFS为10月(95%CI: 4.9~15.0),而无蛋白尿患者的PFS为4月(P=0.002),表明贝伐珠单抗治疗期间发生的蛋白尿与延长无进展生存期有关,多因素分析显示蛋白尿是PFS和OS的独立预后因素,可能是治疗有效的标志。而Khoja等[39]的研究结果则相反,研究者统计了50例接受VEGF抑制剂治疗的患者,0~1级蛋白尿的mOS为23.9月,≥2级蛋白尿患者的mOS为4.2月(P=0.028),提示蛋白尿发生可能预示着更差的预后。因此,蛋白尿与药物治疗效果、预后的关系尚不明确,需要更多研究证实。
5 治疗与监测鉴于VEGF抑制剂在使用过程中常常发生肾脏损伤,降低患者的生存质量和存活率,因此正确的评估、监测肾脏功能、合理的治疗显得尤为重要。由于这类药物导致肾脏损伤的具体机制尚未明确,目前暂无特定的指南指导监测或治疗方法。临床上常通过检测蛋白尿的程度来预测肾脏损伤。目前的标准管理是:若尿蛋白水平大于2+,则立即进行24 h尿蛋白检测,若尿蛋白水平≥2 g/24 h,则停药。若尿蛋白水平有所下降,则可恢复用药,若达到肾病综合征水平(尿蛋白≥3.5 g/24 h),则禁用[40]。Evans等[41]研究列文替尼治疗晚期肝癌用UPCR(urine protein: creatinine ratio)代替24 h尿蛋白来监测肾功能,分析发现UPCR与24 h尿蛋白有统计学意义,UPCR截断值为2.4时,描述2级和3级蛋白尿的敏感度为96.9%,特异性为82.5%。使用这种方法可以减轻患者收集24 h尿液的负担,同时更加完善管理体系。根据研究显示ACEI/ARB可以降低蛋白尿程度,改善肾脏功能,因此常常用于治疗VEGF抑制剂引起的肾脏损伤[40, 42]。同时一些研究从VEGF抑制剂引起蛋白尿等肾脏损伤的机制出发,探索治疗蛋白尿等的药物。Lankhorst等[42]研究发现高剂量的卡托普利、西地那非(五磷酸二酯酶抑制剂)、马替坦(双内皮素受体拮抗剂)可显著减少蛋白尿程度,减轻肾脏组织异常,这可能是一种新的治疗措施。同时,高血压也是导致蛋白尿的一个重要因素,监测血压也是治疗肾脏损伤的重要方面,合并肾脏损伤的患者血压最好控制在130/80 mmHg以下[43]。
6 总结与展望肾脏损伤是抗血管生成靶向药物最常见的不良反应之一,严重威胁患者的生存质量和生存率。对靶向抗血管生成药物充分了解,严密监测蛋白尿等反映肾脏功能的指标,早期采取减少或停用靶向抗血管生成药物及其他治疗措施,有助于挽救患者生命,最大程度改善患者生存质量,这需要肾脏学专家、肿瘤学专家、心血管专家、护理团队等共同协作,协调具体治疗方案。
作者贡献:
冯青燕: 查阅文献及撰写论文
徐金升: 确定选题
白亚玲: 审阅及指导论文
| [1] |
Denda T, Sakai D, Hamaguchi T, et al. Phase Ⅱ trial of aflibercept with FOLFIRI as a second-line treatment for Japanese patients with metastatic colorectal cancer[J]. Cancer Sci, 2019, 110(3): 1032-1043. DOI:10.1111/cas.13943 |
| [2] |
Choueiri TK, Hessel C, Halabi S, et al. Cabozantinib versus sunitinib as initial therapy for metastatic renal cell carcinoma of intermediate or poor risk (Alliance A031203 CABOSUN randomised trial): Progression-free survival by independent review and overall survival update[J]. Eur J Cancer, 2018, 94: 115-125. DOI:10.1016/j.ejca.2018.02.012 |
| [3] |
Thatcher N, Goldschmidt JH, Thomas M, et al. Efficacy and Safety of the Biosimilar ABP 215 Compared with Bevacizumab in Patients with Advanced Nonsquamous Non-small Cell Lung Cancer (MAPLE): A Randomized, Double-blind, Phase Ⅲ Study[J]. Clin Cancer Res, 2019, 25(7): 2088-2095. DOI:10.1158/1078-0432.CCR-18-2702 |
| [4] |
Teleanu RI, Chircov C, Grumezescu AM, et al. Tumor Angiogenesis and Anti-Angiogenic Strategies for Cancer Treatment[J]. J Clin Med, 2019, 9(1): 84. DOI:10.3390/jcm9010084 |
| [5] |
Melincovici CS, Boşca AB, Şuşman S, et al. Vascular endothelial growth factor (VEGF)-key factor in normal and pathological angiogenesis[J]. Rom J Morphol Embryol, 2018, 59(2): 455-467. |
| [6] |
Garcia J, Hurwitz HI, Sandler AB, et al. Bevacizumab (AvastinⓇ) in cancer treatment: A review of 15 years of clinical experience and future outlook[J]. Cancer Treat Rev, 2020, 86: 102017. DOI:10.1016/j.ctrv.2020.102017 |
| [7] |
Seto T, Azuma K, Yamanaka T, et al. Randomized Phase Ⅲ Study of Continuation Maintenance Bevacizumab With or Without Pemetrexed in Advanced Nonsquamous Non-Small-Cell Lung Cancer: COMPASS (WJOG5610L)[J]. J Clin Oncol, 2020, 38(8): 793-803. DOI:10.1200/JCO.19.01494 |
| [8] |
Pfisterer J, Shannon CM, Baumann K, et al. Bevacizumab and platinum-based combinations for recurrent ovarian cancer: a randomised, open-label, phase 3 trial[J]. Lancet Oncol, 2020, 21(5): 699-709. DOI:10.1016/S1470-2045(20)30142-X |
| [9] |
Lafayette RA, McCall B, Li N, et al. Incidence and relevance of proteinuria in bevacizumab-treated patients: pooled analysis from randomized controlled trials[J]. Am J Nephrol, 2014, 40(1): 75-83. DOI:10.1159/000365156 |
| [10] |
Pinto C, Antonuzzo L, Porcu L, et al. Efficacy and Safety of Bevacizumab Combined With Fluoropyrimidine Monotherapy for Unfit or Older Patients With Metastatic Colorectal Cancer: A Systematic Review and Meta-Analysis[J]. Clin Colorectal Cancer, 2017, 16(2): e61-e72. DOI:10.1016/j.clcc.2016.08.006 |
| [11] |
Taylor SE, Chu T, Elvin JA, et al. Phase Ⅱ study of everolimus and bevacizumab in recurrent ovarian, peritoneal, and fallopian tube cancer[J]. Gynecol Oncol, 2020, 156(1): 32-37. DOI:10.1016/j.ygyno.2019.10.029 |
| [12] |
Li J, Xu R, Qin S, et al. Aflibercept plus FOLFIRI in Asian patients with pretreated metastatic colorectal cancer: a randomized Phase Ⅲ study[J]. Future Oncol, 2018, 14(20): 2031-2044. DOI:10.2217/fon-2017-0669 |
| [13] |
Llovet JM, Ricci S, Mazzaferro V, et al. Sorafenib in advanced hepatocellular carcinoma[J]. N Engl J Med, 2008, 359(4): 378-390. DOI:10.1056/NEJMoa0708857 |
| [14] |
Marisi G, Cucchetti A, Ulivi P, et al. Ten years of sorafenib in hepatocellular carcinoma: Are there any predictive and/or prognostic markers?[J]. World J Gastroenterol, 2018, 24(36): 4152-4163. DOI:10.3748/wjg.v24.i36.4152 |
| [15] |
Abdel-Rahman O, Lamarca A. Development of sorafenib-related side effects in patients diagnosed with advanced hepatocellular carcinoma treated with sorafenib: a systematic-review and meta-analysis of the impact on survival[J]. Expert Rev Gastroenterol Hepatol, 2017, 11(1): 75-83. DOI:10.1080/17474124.2017.1264874 |
| [16] |
Kudo M, Finn RS, Qin S, et al. Lenvatinib versus sorafenib in first-line treatment of patients with unresectable hepatocellular carcinoma: a randomised phase 3 non-inferiority trial[J]. Lancet, 2018, 391(10126): 1163-1173. DOI:10.1016/S0140-6736(18)30207-1 |
| [17] |
Nassif E, Thibault C, Vano Y, et al. Sunitinib in kidney cancer: 10 years of experience and development[J]. Expert Rev Anticancer Ther, 2017, 17(2): 129-142. DOI:10.1080/14737140.2017.1272415 |
| [18] |
Méjean A, Ravaud A, Thezenas S, et al. Sunitinib Alone or after Nephrectomy in Metastatic Renal-Cell Carcinoma[J]. N Engl J Med, 2018 Aug 2; 379(5): 417-427.
|
| [19] |
Gross-Goupil M, Kwon TG, Eto M, et al. Axitinib versus placebo as an adjuvant treatment of renal cell carcinoma: results from the phase Ⅲ, randomized ATLAS trial[J]. Ann Oncol, 2018, 29(12): 2371-2378. DOI:10.1093/annonc/mdy454 |
| [20] |
Rini BI, Plimack ER, Stus V, et al. Pembrolizumab plus Axitinib versus Sunitinib for Advanced Renal-Cell Carcinoma[J]. N Engl J Med, 2019, 380(12): 1116-1127. DOI:10.1056/NEJMoa1816714 |
| [21] |
Motzer RJ, Penkov K, Haanen J, et al. Avelumab plus Axitinib versus Sunitinib for Advanced Renal-Cell Carcinoma[J]. N Engl J Med, 2019, 380(12): 1103-1115. DOI:10.1056/NEJMoa1816047 |
| [22] |
Leslie I, Boos LA, Larkin J, et al. Avelumab and axitinib in the treatment of renal cell carcinoma: safety and efficacy[J]. Expert Rev Anticancer Ther, 2020, 20(5): 343-354. DOI:10.1080/14737140.2020.1756780 |
| [23] |
Choueiri TK, Escudier B, Powles T, et al. Cabozantinib versus everolimus in advanced renal cell carcinoma (METEOR): final results from a randomised, open-label, phase 3 trial[J]. Lancet Oncol, 2016, 17(7): 917-927. DOI:10.1016/S1470-2045(16)30107-3 |
| [24] |
Schlumberger M, Elisei R, Müller S, et al. Overall survival analysis of EXAM, a phase Ⅲ trial of cabozantinib in patients with radiographically progressive medullary thyroid carcinoma[J]. Ann Oncol, 2017, 28(11): 2813-2819. DOI:10.1093/annonc/mdx479 |
| [25] |
Müller-Deile J, Worthmann K, Saleem M, et al. The balance of autocrine VEGF-A and VEGF-C determines podocyte survival[J]. Am J Physiol Renal Physiol, 2009, 297(6): F1656-F1667. DOI:10.1152/ajprenal.00275.2009 |
| [26] |
New LA, Martin CE, Scott RP, et al. Nephrin Tyrosine Phosphorylation Is Required to Stabilize and Restore Podocyte Foot Process Architecture[J]. J Am Soc Nephrol, 2016, 27(8): 2422-2435. DOI:10.1681/ASN.2015091048 |
| [27] |
Wang H, Yue Z, Wu J, et al. The Accumulation of VEGFA in the Glomerular Basement Membrane and Its Relationship with Podocyte Injury and Proteinuria in Alport Syndrome[J]. PLoS One, 2015, 10(8): e0135648. DOI:10.1371/journal.pone.0135648 |
| [28] |
Eremina V, Jefferson JA, Kowalewska J, et al. VEGF inhibition and renal thrombotic microangiopathy[J]. N Engl J Med, 2008, 358(11): 1129-1136. DOI:10.1056/NEJMoa0707330 |
| [29] |
Maruyama K, Nakagawa N, Suzuki A, et al. Pazopanib-induced Endothelial Injury with Podocyte Changes[J]. Intern Med, 2018, 57(7): 987-991. DOI:10.2169/internalmedicine.9576-17 |
| [30] |
Wu Q, Finley SD. Mathematical Model Predicts Effective Strategies to Inhibit VEGF-eNOS Signaling[J]. J Clin Med, 2020, 9(5): 1255. DOI:10.3390/jcm9051255 |
| [31] |
Eroglu E, Saravi SSS, Sorrentino A, et al. Discordance between eNOS phosphorylation and activation revealed by multispectral imaging and chemogenetic methods[J]. Proc Natl Acad Sci U S A, 2019, 116(40): 20210-20217. DOI:10.1073/pnas.1910942116 |
| [32] |
Oe Y, Fushima T, Sato E, et al. Protease-activated receptor 2 protects against VEGF inhibitor-induced glomerular endothelial and podocyte injury[J]. Sci Rep, 2019, 9(1): 2986. DOI:10.1038/s41598-019-39914-8 |
| [33] |
Siragusa M, Fleming I. The eNOS signalosome and its link to endothelial dysfunction[J]. Pflugers Arch, 2016, 468(7): 1125-1137. DOI:10.1007/s00424-016-1839-0 |
| [34] |
Eremina V, Quaggin SE. Biology of anti-angiogenic therapy-induced thrombotic microangiopathy[J]. Semin Nephrol, 2010, 30(6): 582-590. DOI:10.1016/j.semnephrol.2010.09.006 |
| [35] |
Izzedine H, Perazella MA. Thrombotic microangiopathy, cancer, and cancer drugs[J]. Am J Kidney Dis, 2015, 66(5): 857-868. DOI:10.1053/j.ajkd.2015.02.340 |
| [36] |
Izzedine H, Escudier B, Lhomme C, et al. Kidney diseases associated with anti-vascular endothelial growth factor (VEGF): an 8-year observational study at a single center[J]. Medicine (Baltimore), 2014, 93(24): 333-339. DOI:10.1097/MD.0000000000000207 |
| [37] |
Pfister F, Amann K, Daniel C, et al. Characteristic morphological changes in anti-VEGF therapy-induced glomerular microangiopathy[J]. Histopathology, 2018, 73(6): 990-1001. DOI:10.1111/his.13716 |
| [38] |
Carvalho B, Lopes RG, Linhares P, et al. Hypertension and proteinuria as clinical biomarkers of response to bevacizumab in glioblastoma patients[J]. J Neurooncol, 2020, 147(1): 109-116. DOI:10.1007/s11060-020-03404-z |
| [39] |
Khoja L, Kumaran G, Zee YK, et al. Evaluation of hypertension and proteinuria as markers of efficacy in antiangiogenic therapy for metastatic colorectal cancer[J]. J Clin Gastroenterol, 2014, 48(5): 430-434. DOI:10.1097/MCG.0b013e3182a8804c |
| [40] |
Estrada CC, Maldonado A, Mallipattu SK. Therapeutic Inhibition of VEGF Signaling and Associated Nephrotoxicities[J]. J Am Soc Nephrol, 2019, 30(2): 187-200. DOI:10.1681/ASN.2018080853 |
| [41] |
Evans TRJ, Kudo M, Finn RS, et al. Urine protein: creatinine ratio vs. 24-hour urine protein for proteinuria management: analysis from the phase 3 REFLECT study of lenvatinib vs sorafenib in hepatocellular carcinoma[J]. Br J Cancer, 2019, 121(3): 218-221. DOI:10.1038/s41416-019-0506-6 |
| [42] |
Lankhorst S, Kappers MHW, van Esch JHM, et al. Treatment of hypertension and renal injury induced by the angiogenesis inhibitor sunitinib: preclinical study[J]. Hypertension, 2014, 64(6): 1282-1289. DOI:10.1161/HYPERTENSIONAHA.114.04187 |
| [43] |
Pandey AK, Singhi EK, Arroyo JP, et al. Mechanisms of VEGF (Vascular Endothelial Growth Factor) Inhibitor-Associated Hypertension and Vascular Disease[J]. Hypertension, 2018, 71(2): e1-e8. |
 2021, Vol. 48
2021, Vol. 48