文章信息
- 肺部罕见肿瘤疾病谱变化及预后
- Disease Spectrum and Prognosis of Rare Lung Malignancies
- 肿瘤防治研究, 2020, 47(6): 432-436
- Cancer Research on Prevention and Treatment, 2020, 47(6): 432-436
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2020.19.1169
- 收稿日期: 2019-11-19
- 修回日期: 2020-03-22
肺癌全球死亡率在所有恶性肿瘤中居首位,其总体发病率呈下降趋势,肿瘤谱也发生了变化,腺癌已超过鳞癌成为发病率第一位的肺癌[1],但肺部罕见恶性肿瘤却缺乏研究及关注。RARECARE(The Surveillance of Rare Cancers in Europe)项目定义每年发病率小于6/100 000的肿瘤为罕见肿瘤, 并制定了罕见肿瘤清单。肺部罕见恶性肿瘤侵袭性强、恶性程度高、预后差,治疗进展缓慢[2]。现有文献对肺部罕见恶性肿瘤的研究多局限于单中心、小样本量的回顾性分析,且可能存在转诊偏倚。本研究提取了SEER(Surveillance Epidemiology and End Results)数据库2004—2015年间,经病理确诊为肺部原发性罕见恶性肿瘤患者的临床数据,探讨肺部罕见恶性肿瘤病理类型构成、发病趋势及不同病理类型的预后,以期为该类肿瘤的治疗提供参考。
1 资料与方法 1.1 数据来源根据RARECARE项目制定的罕见肿瘤清单,从SEER数据库中选取确诊为肺部罕见恶性肿瘤患者的资料进行回顾性分析。病理类型分类参照2015年世界卫生组织(World Health Organization, WHO)肺部肿瘤分类。由于SEER数据库在2004年以前美国癌症联合会(American Joint Committee on Cancer, AJCC)的TNM分期数据缺失较多,故本研究选取患者的诊断时间限于2004—2015年。根据AJCC制定的第6版肺癌TNM分期系统进行分期。所有患者均符合以下标准:(1)经组织病理学或细胞学检查证实为肺部罕见恶性肿瘤;(2)仅有一个原发性肿瘤;(3)能获取随访时间。为尽可能获取到最大样本量以及计算各病理类型构成比,所有原发部位(左肺、右肺、原发部位未知)、分期(Ⅰ~ⅢA、ⅢB~Ⅳ、分期未知)、淋巴结转移(有转移、无转移、未知)的患者都纳入研究。
1.2 分析指标对2004—2015年肺部罕见恶性肿瘤的构成及发病趋势进行描述性分析;评估的终点为总生存期,定义为自确诊之日至末次随访日期或死亡日期,以月为单位。
1.3 统计学方法采用SPSS24.0软件进行统计分析。Kaplan-Meier法计算1、3、5年生存率、中位生存时间及绘制生存曲线。
2 结果 2.1 基本临床特征共纳入13 428例患者,占同期所有经病理确诊的肺原发性恶性肿瘤的3.5%。其中男性占57.1%,女性42.9%,男:女为1.33:1,唾液腺型恶性肿瘤发病率与性别无关,其余各类型肺部罕见恶性肿瘤男性发病率高于女性。优势发病人群为中老年人,92%的患者诊断年龄≥50岁。除唾液腺型恶性肿瘤、淋巴上皮瘤样癌外,其余类型恶性肿瘤在诊断时半数以上已处于ⅢB~Ⅳ期,其中处于ⅢB~Ⅳ期的大细胞癌高达65.3%。53.2%的患者诊断时已有淋巴结转移,大细胞癌淋巴结转移率最高(58.0%),见表 1。
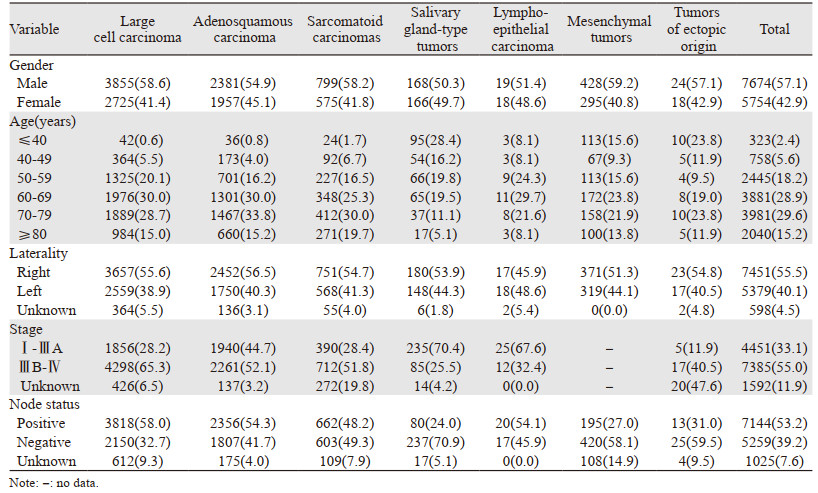
|
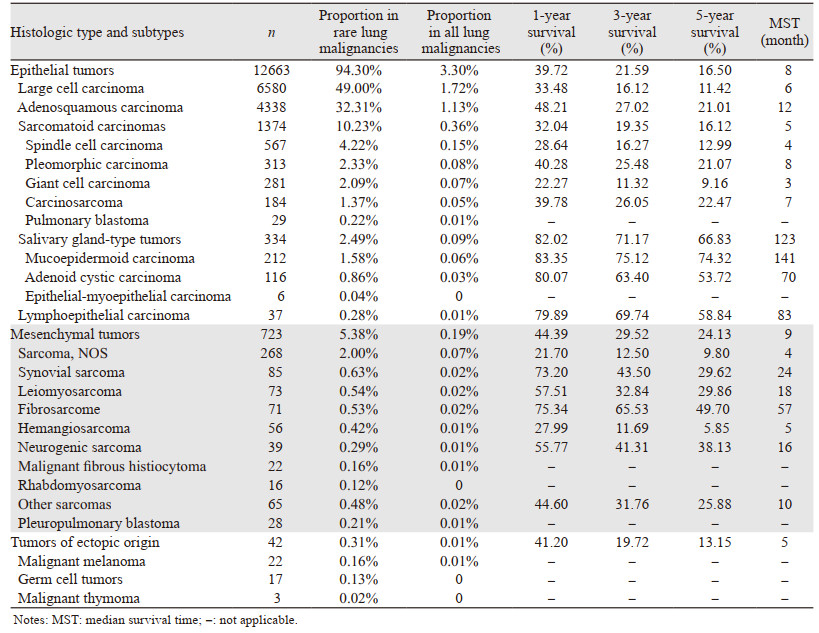
所有组织来源中,上皮性肿瘤、间质性肿瘤及异位性肿瘤分别占所有肺部罕见恶性肿瘤的94.30%、5.38%、0.31%,分别占同期所有肺部恶性肿瘤的3.30%、0.19%、0.01%。大细胞癌、腺鳞癌、肉瘤样癌、唾液腺型恶性肿瘤、淋巴上皮瘤样癌、间质性肿瘤、异位来源性肿瘤的构成比分别为49.00%、32.31%、10.23%、2.49%、0.28%、5.38%、5.38%,在同期所有肺部恶性肿瘤中的构成比分别为1.72%、1.13%、0.36%、0.09%、0.01%、0.19%、0.01%,各病理亚型肿瘤的构成比见表 2。2004—2015年大细胞癌的新发病例比例逐年下降,由2004年的3.56%下降至2015年的0.48%;腺鳞癌比例缓慢上升,由2004年的0.84%上升至2015年的1.25%,并在2011年及之后超过大细胞癌,成为肺部罕见恶性肿瘤中发病顺位第一的肿瘤,其余各病理亚型恶性肿瘤构成比趋于稳定,见图 1。
|

|
| 图 1 2004—2015年肺部罕见恶性肿瘤各病理亚型的发病趋势 Figure 1 Incidence trends of rare lung malignancies with different pathological type from 2004 to 2015 |
所有患者的1、3、5年生存率分别为39.98%、21.97%、16.86%,中位生存时间8月。大细胞癌、腺鳞癌、肉瘤样癌、唾液腺型肿瘤、淋巴上皮瘤样癌、间质性肿瘤、异位来源性肿瘤的5年生存率分别为11.42%、21.01%、16.12%、66.83%、58.84%、24.13%、13.15%。中位生存时间分别为6、12、5、123、83、9、5月,各病理亚型的生存情况见表 2,生存曲线见图 2。

|
| 图 2 各病理类型肺部罕见恶性肿瘤的生存曲线 Figure 2 Survival curves of rare lung malignancy patients with different pathological subtypes |
肺癌是目前死亡率最高的癌症,也是导致男性伤残调整寿命年最高的恶性肿瘤[3-4]。目前缺乏系统性的对肺部罕见恶性肿瘤癌谱变化及生存期情况的研究。
结果显示,初诊的肺部罕见恶性肿瘤占同期诊断的所有肺部恶性肿瘤的比例逐年下降,其中大细胞癌的比例下降最明显。本研究纳入的所有患者5年总体生存率为16.86%,中位生存时间为8月,明显低于鳞癌及腺癌 [5-6]。此类肿瘤因侵袭性强、恶性程度高、诊治困难、缺乏新药临床试验等导致总体预后差[2]。近年来靶向治疗成为晚期非小细胞肺癌的有效治疗手段,然而Shukuya等[7]的一项汇总分析发现,EGFR突变在肺部罕见恶性肿瘤患者中的检出率为2.0%,明显低于腺癌。此外,携带EGFR突变的肺部罕见恶性肿瘤患者更易发生除19外显子缺失及21L858R突变外的少见突变类型。Hwang等[8]研究发现大细胞癌的KRAS基因突变率高于腺癌。这些分子学研究结果表明,肺部罕见恶性肿瘤驱动基因突变率低,并且发生耐药突变的比例较高,导致靶向药物在这些肿瘤中应用受限。
初诊的大细胞癌在所有肺部恶性肿瘤中的比例由2004年的3.56%下降至2015年的0.48%,期间总的构成比(1.70%)比文献报道的3%低[9],分析原因是本研究中病理分类参照2015年WHO标准,与2004年版WHO分类比较,大细胞神经内分泌癌及淋巴上皮瘤样癌不再归为大细胞癌的亚型。另外随着免疫组织化学的发展,有鳞或腺状免疫标志物阳性的大细胞癌被重新归类为鳞状细胞癌或腺癌,例如TTF-1阳性的大细胞癌归类为腺癌,P63阳性则归类为鳞状细胞癌[10],故本研究的结果更能反映大细胞癌在所有肺部恶性肿瘤中的实际比例。大细胞癌在各病理亚型中5年生存率最低,与易早期发生淋巴结转移、分期晚有关。大细胞癌缺乏腺癌、鳞癌、小细胞癌的组织结构、细胞学及免疫组织化学等方面特征,具有明显的组织学异质性,故应尽可能作免疫组织化学检查、完善驱动基因筛查以确定其类型,以制定对其合理、有效的治疗方案。
大细胞癌对放化疗反应差,外科手术是主要治疗手段,但由于诊断时多处于晚期,失去手术机会,因此开发新的治疗方式显得尤为重要。目前在大细胞癌组织中检测到的基因突变包括EGFR、KRAS、BRAF等[11-12]。同时大细胞癌具有独特的生物学特性,如Chan等[13]发现,大细胞癌中TP53、RTK/RAS/RAF通路、细胞周期调节基因、WNT通路的突变率分别为96%、52%、52%、8%,但靶向这些突变基因的药物开发非常困难,疗效有待进一步研究。Chan等[13]还同时发现80%的大细胞癌患者PD-1表达阳性,PD-1表达大于50%的患者约占40%,故建议大细胞癌患者检测PD-L1表达情况,可能通过免疫治疗延长生存期。
本研究发现,腺鳞癌的新发比例在2004年至2015年间缓慢上升,并在2011年及之后超过大细胞癌,成为肺部罕见恶性肿瘤中发病顺位第一的肿瘤。根据WHO标准,腺鳞癌定义为肿瘤组织中同时含有腺癌和鳞癌两种恶性组织成分,并且任一成分至少占全部肿瘤的10%,必须通过手术标本作出诊断。随着胸部CT在健康体检中的普及,早期肺癌检出率上升,手术机会大,从而增加腺鳞癌诊断的比例。非小细胞肺癌为一组具有高度组织学异质性的疾病,腺癌中可出现鳞状分化的病灶,肿瘤周围可出现鳞状细胞化生,同时鳞状细胞癌中可出现假腺样结构[14],造成光学显微镜下识别两种肿瘤细胞的难度增加。近年来随着免疫组织化学及分子遗传学的进展,它们可辅助鉴别光学显微镜下难以辨别的腺癌及鳞癌细胞,使新诊断的腺鳞癌比例上升。
腺鳞癌侵袭性强,半数以上的患者在诊断时已经发生淋巴结及远处转移。Filosso等[15]发现腺鳞癌的生存率明显低于鳞癌及腺癌,行根治性切除术的Ⅰ期腺鳞癌患者的3年及5年生存率与ⅢA期腺癌及鳞癌患者的生存率接近。手术和化疗是其主要治疗手段,术后辅助化疗是降低远处转移风险的重要因素。由于发病率低,现有文献关于肺腺鳞癌基因突变的研究结果存在较大差异。Wang等[16-17]发现肺腺鳞癌中存在多个基因异常,包括EGFR、KRAS、HER2、ALK融合基因、RET融合基因、AKT1基因E17K突变,这些驱动基因可以作为靶向治疗的参考依据。表皮生长因子受体酪氨酸激酶抑制剂(EGFR-TKI)对具有经典EGFR突变患者的疗效与肺腺癌相当,但42.1%的患者在使用第一代EGFR-TKI治疗后继发T790M突变[17]。但也有研究表明,肺腺鳞癌预后与EGFR突变无明显关系,而与性别、病理亚型、TNM分期有关。腺、鳞两种成分相当者预后与腺癌成分为主者相当,但较鳞癌成分为主者差,且腺癌成分中腺泡型腺癌预后更好[18]。但Zhao等[19]发现两种成分比例相当者预后更佳。免疫治疗方面,Shi等[20]发现肺腺鳞癌患者PD-L1表达阳性率为39.22%,高于腺癌(13.53%)及鳞癌(28.92%),故建议检测肺腺鳞癌患者PD-L1表达情况,筛选出可能获益人群。
上皮来源的其他恶性肿瘤新发病例趋于稳定,与文献报道一致[21-23]。肉瘤样癌的病理亚型以梭形细胞癌及多形性癌为主,肺母细胞癌发病率最低。唾液腺型肿瘤中黏液表皮癌发病率最高,其次为腺样囊性癌,上皮肌上皮癌所占比例极低,其男女发病率无明显差异。
肺部间质性肿瘤起源于肺间质、支气管壁、支气管基质、血管壁等中胚层组织,分为滑膜肉瘤、平滑肌肉瘤、纤维肉瘤、血管肉瘤、神经源性肿瘤、恶性纤维组织细胞瘤、胸膜肺母细胞瘤等多个组织学亚型,临床十分罕见,文献报道多为小样本的回顾性研究或个案报道[24]。本研究发现间质性肿瘤占同期所有肺部恶性肿瘤的0.19%,年发病率趋于稳定,与报道一致[23]。手术是其主要治疗手段,联合放疗及化疗能提高生存率,无淋巴结转移、肿瘤直径小于5 cm是预后良好的指标[25]。本研究发现间质性肿瘤的5年生存率为24.13%,优于大细胞癌、腺鳞癌及肉瘤样癌。可能与其诊断时淋巴结转移率较以上肿瘤低有关。同时间质性肿瘤在50岁以下人群中的发病率高于大细胞癌、腺鳞癌及肉瘤样癌,因该类人群合并高血压、糖尿病、慢性阻塞性肺疾病等慢性疾病的比例更低,且手术耐受性更高,故预后相对以上三类肿瘤较好。但患者的总体预后仍不理想,5年生存率明显低于腺癌(58.0%)、鳞癌(40.8%)[6]及来源于四肢的软组织肉瘤(71%)[25]。
异位来源性肿瘤十分罕见,12年间仅发现42例,既往相关的研究多为个案报道,无相关5年生存率报道。本研究结果提示异位来源性肿瘤的预后仅优于大细胞癌,5年生存率为13.15%,中位生存时间仅5月。
总之,目前对肺部罕见恶性肿瘤的认识存在局限性,由于其诊断困难、缺乏标准治疗方案、缺乏新的临床试验,以及驱动基因突变率低、易发生耐药突变等原因导致总体预后差。本研究以期引起医务人员对肺部罕见恶性肿瘤的重视,加强基础及临床方面的研究,延长肺部罕见恶性肿瘤患者生存时间,从而提高肺部恶性肿瘤的总体生存率。
作者贡献
谢玉华:数据收集、统计、分析及论文撰写
李升锦:研究设计及文章审校
| [1] |
Barta JA, Powell CA, Wisnivesky JP. Global epidemiology of lung cancer[J]. Ann Glob Health, 2019, 85(1): 8. |
| [2] |
Blay JY, Coindre JM, Ducimetière F, et al. The value of research collaborations and consortia in rare cancers[J]. Lancet Oncol, 2016, 17(2): e62-e69. DOI:10.1016/S1470-2045(15)00388-5 |
| [3] |
Fitzmaurice C, Dicker D, Pain A, et al. The global burden of cancer 2013[J]. JAMA Oncol, 2015, 1(4): 505-527. DOI:10.1001/jamaoncol.2015.0735 |
| [4] |
Fitzmaurice C, Allen C, Barber RM, et al. Global, regional, and national cancer incidence, mortality, years of life lost, years lived with disability, and disability-adjusted life-years for 32 cancer groups, 1990 to 2015: a systematic analysis for the global burden of disease study[J]. JAMA Oncol, 2017, 3(4): 524-548. DOI:10.1001/jamaoncol.2016.5688 |
| [5] |
Cooke DT, Nguyen DV, Yang Y, et al. Survival comparison of adenosquamous, squamous cell, and adenocarcinoma of the lung after lobectomy[J]. Ann Thorac Surg, 2010, 90(3): 943-948. DOI:10.1016/j.athoracsur.2010.05.025 |
| [6] |
Maeda H, Matsumura A, Kawabata T, et al. Adenosquamous carcinoma of the lung: surgical results as compared with squamous cell and adenocarcinoma cases[J]. Eur J Cardiothorac Surg, 2012, 41(2): 357-361. DOI:10.1016/j.ejcts.2011.05.050 |
| [7] |
Shukuya T, Takahashi T, Kaira R, et al. Efficacy of gefitinib for non-adenocarcinoma non-small-cell lung cancer patients harboring epidermal growth factor receptor mutations: a pooled analysis of published reports[J]. Cancer Sci, 2011, 102(5): 1032-1037. DOI:10.1111/j.1349-7006.2011.01887.x |
| [8] |
Hwang DH, Szeto DP, Perry AS, et al. Pulmonary large cell carcinoma lacking squamous differentiation is clinicopathologically indistinguishable from solid-subtype adenocarcinoma[J]. Arch Pathol Lab Med, 2014, 138(5): 626-635. DOI:10.5858/arpa.2013-0179-OA |
| [9] |
Sawabata N, Asamura H, Goya T, et al. Japanese Lung Cancer Registry Study: first prospective enrollment of a large number of surgical and nonsurgical cases in 2002[J]. J Thorac Oncol, 2010, 5(9): 1369-1375. DOI:10.1097/JTO.0b013e3181e452b9 |
| [10] |
Carvalho L. Reclassifying bronchial-pulmonary carcinoma: differentiating histological type in biopsies by immunohistochemistry[J]. Rev Port Pneumol(English Edition), 2009, 15(6): 1101-1119. DOI:10.1016/S2173-5115(09)70170-8 |
| [11] |
Bi Y, Qu Y, Liang Z, et al. Clinicopathological analysis of Large Cell Lung Carcinomas definitely diagnosed according to the New World Health Organization Criteria[J]. Pathol Res Pract, 2018, 214(4): 555-559. DOI:10.1016/j.prp.2018.02.006 |
| [12] |
Driver BR, Portier BP, Mody DR, et al. Next-generation sequencing of a cohort of pulmonary large cell carcinomas reclassified by World Health Organization 2015 criteria[J]. Arch Pathol Lab Med, 2016, 140(4): 312-317. DOI:10.5858/arpa.2015-0361-OA |
| [13] |
Chan AW, Chau SL, Tong JH, et al. The landscape of actionable molecular alterations in immunomarker-defined large-cell carcinoma of the lung[J]. J Thorac Oncol, 2019, 14(7): 1213-1222. DOI:10.1016/j.jtho.2019.03.021 |
| [14] |
Rao N. Adenosquamous carcinoma[J]. Semin Diagn Pathol, 2014, 31(4): 271-277. DOI:10.1053/j.semdp.2014.06.004 |
| [15] |
Filosso PL, Ruffini E, Asioli S, et al. Adenosquamous lung carcinomas: a histologic subtype with poor prognosis[J]. Lung Cancer, 2011, 74(1): 25-29. |
| [16] |
Wang R, Zhang Y, Pan Y, et al. Comprehensive investigation of oncogenic driver mutations in Chinese non-small cell lung cancer patients[J]. Oncotarget, 2015, 6(33): 34300-34308. DOI:10.18632/oncotarget.5549 |
| [17] |
Hu M, Zhang B, Xu J, et al. Clinical Outcomes of Different Generations of EGFR Tyrosine Kinase Inhibitors in Advanced Lung Adenosquamous Carcinoma[J]. Mol Diag Ther, 2019, 23(6): 773-779. DOI:10.1007/s40291-019-00425-x |
| [18] |
Zhu L, Jiang L, Yang J, et al. Clinical characteristics and prognosis of patients with lung adenosquamous carcinoma after surgical resection: results from two institutes[J]. J Thorac Dis, 2018, 10(4): 2397-2402. DOI:10.21037/jtd.2018.03.186 |
| [19] |
Zhao H, Yang H, Yao F, et al. Improved survival associated with a balanced structure between adenomatous and squamous components in patients with adenosquamous carcinoma of the lung[J]. Euro J Surg Oncol, 2016, 42(11): 1699-1706. DOI:10.1016/j.ejso.2016.05.009 |
| [20] |
Shi X, Wu S, Sun J, et al. PD-L1 expression in lung adenosquamous carcinomas compared with the more common variants of non-small cell lung cancer[J]. Sci Rep, 2017, 7: 46209. DOI:10.1038/srep46209 |
| [21] |
Travis WD. Pathology of lung cancer[J]. Clin Chest Med, 2011, 32(4): 669-692. DOI:10.1016/j.ccm.2011.08.005 |
| [22] |
Falk N, Weissferdt A, Kalhor N, et al. Primary pulmonary salivary gland-type tumors: a review and update[J]. Adv Anatom Pathol, 2016, 23(1): 13-23. DOI:10.1097/PAP.0000000000000099 |
| [23] |
de Jong WK, Schaapveld M, Blaauwgeers JL, et al. Pulmonary tumours in the Netherlands: focus on temporal trends in histology and stage and on rare tumours[J]. Thorax, 2008, 63(12): 1096-1102. DOI:10.1136/thx.2007.095067 |
| [24] |
Petrov DB, Vlassov VI, Kalaydjiev GT, et al. Primary pulmonary sarcomas and carcinosarcomas-postoperative results and comparative survival analysis[J]. Eur J Cardiothorac Surg, 2003, 23(4): 461-466. DOI:10.1016/S1010-7940(03)00024-1 |
| [25] |
Spraker MB, Bair E, Bair R, et al. An analysis of patient characteristics and clinical outcomes in primary pulmonary sarcoma[J]. J Thorac Oncol, 2013, 8(2): 147-151. DOI:10.1097/JTO.0b013e318277401f |
 2020, Vol. 47
2020, Vol. 47


