文章信息
- 趋化因子CXCL5调控NF-κB与Wnt/β-catenin信号通路抑制肿瘤免疫促进胃癌的机制研究
- CXCL5 Promotes Gastric Cancer via Modulating NF-κB and Wnt/β-catenin Signaling-mediated Inhibition of Tumor Immune
- 肿瘤防治研究, 2020, 47(5): 340-345
- Cancer Research on Prevention and Treatment, 2020, 47(5): 340-345
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2020.19.1156
- 收稿日期: 2019-09-12
- 修回日期: 2020-03-17
2. 442000 十堰,湖北医药学院附属东风医院实验中心
2. Experimental Center of Dongfeng Hospital Affiliated to Hubei Medical College, Shiyan 442000, China
胃癌是我国最常见的消化道恶性肿瘤之一,其发病率和死亡率位居全球肿瘤发病率和死亡率的第二位[1-2]。胃癌的早期诊断率低,临床诊治时常被延误[2-3]。肿瘤标志物的出现为早期胃癌的诊断带来了新的希望[4-5]。虽然目前已发现多种用于胃癌检测的肿瘤标志物,但其特异性均不高,敏感度也不甚理想[6]。晚期胃癌患者的临床治疗手段仍以化疗为主,至今仍没有公认的治疗标准[7-8]。近些年,免疫治疗已成为肿瘤研究的热点,多项研究提示免疫治疗在未来的肿瘤治疗中有巨大前景[8-10]。报道指出,多种细胞因子在肿瘤免疫中发挥作用,已被用于肿瘤的免疫治疗[11-12]。CXC趋化因子配体-5(CXC chemokine ligand-5, CXCL5),又称为上皮中性粒细胞活化肽78(ENA78),是CXC趋化因子家族的成员之一[13-14]。作为炎性介质,CXCL5对中性粒细胞有很强的趋化作用[15]。此外,CXCL5可与其特异性受体CXCR2结合,介导一系列生物学效应进而影响肿瘤的生长与转移[15]。研究指出,CXCL5与非小细胞肺癌、膀胱癌、肝癌等的发生与发展密切相关[16-19]。而CXCL5在胃癌中的确切作用机制尚无报道,本研究探讨CXCL5对胃癌肿瘤免疫的影响及其潜在分子机制。
1 资料与方法 1.1 资料来源本研究共纳入华中科技大学协和深圳医院胃肠外科于2018年7月—2019年4月收治的83例胃癌患者作为研究对象进行回顾性研究; 患者年龄在23~79岁之间,平均年龄51.3±13.8岁; 所有患者中男55例、女28例。所有患者均为首次被诊断为胃癌,均经病理学或影像学(或内镜)确诊。排除复发性胃癌患者、放化疗史的患者、并发其他恶性肿瘤的患者、近期服用影响机体免疫药物的患者、伴有全身感染性疾病的患者、临床资料不全无法进行统计的患者、伴有严重脏器功能障碍的患者、妊娠期或哺乳期女性。胃癌患者的基本信息见表 1。
另选取同期在我院体检科体检的健康者40例作为对照; 年龄在29~67岁之间,平均年龄48.6±14.1岁,其中男27例、女13例。两组年龄与性别相比差异均无统计学意义(均P > 0.05),有可比性。所有纳入者均签署知情同意书,均知晓本研究的目的与方法,本研究获得医院伦理委员会批准。
1.2 材料与设备DMEM培养基(美国Gibco公司); 胎牛血清(FBS)、青霉素和链霉素(美国Hyclone公司)。人胃癌细胞株SNU216和小鼠胃癌细胞株MFC购自武汉大学细胞库。Lipofectamine® 2000转染试剂(美国Thermo Fisher公司)。小鼠淋巴细胞分离液(深圳达科为生物技术有限公司)。人CXCL5 ELISA试剂盒(武汉华美生物工程有限公司)。重组人CXCL5蛋白(上海美迪西生物医药股份有限公司)。SDS-PAGE试剂(上海生工生物工程股份有限公司)。CXCL5抗体、CXCR2抗体、p-ERK1/2抗体、p-MAPK抗体、p-β-catenin抗体(美国Santa Cruz公司); p-PI3K抗体、p-AKT抗体、p-NF-κB抗体(美国CST公司); MAPK抗体、PI3K抗体、NF-κB抗体、β-catenin抗体(美国Abcam公司); ERK1/2抗体、AKT抗体、β-actin抗体(武汉三鹰生物技术有限公司)。NF-κB信号通路抑制剂BAY 11-7082(美国MCE公司),Wnt/β-catenin信号通路抑制剂XAV939(美国Selleckchem公司)。流式细胞术抗体:FITC标记的CD4抗体、APC标记的CD8抗体、FITC标记的CD56抗体、PE标记的CD16抗体(美国BioLegend公司)。pLVX-Tight-Puro质粒(美国Invitrogen公司)。Taq酶(武汉擎科生物技术有限公司)。内切酶BamHⅠ与EcoRⅠ(美国Thermo Fisher公司)。T4 DNA连接酶(日本TaKaRa公司)。C57小鼠购自武汉大学实验动物中心。主要设备有生物安全柜、CO2培养箱、垂直电泳仪、化学发光成像系统、流式细胞仪、Tecan酶标仪等。
1.3 酶联免疫检测CXCL5水平分别抽取胃癌患者和健康者的空腹静脉血10 ml,置于促凝管中,自然凝固,2 600 r/min离心15 min,取上清液储存于-80℃备用。CXCL5 ELISA试剂盒检测血清中CXCL5的水平,检测过程严格按照产品说明书进行。用Tecan酶标仪测量450 nm处的OD值。绘制标准曲线,计算CXCL5浓度。
1.4 Western blot检测CXCL5、CXCR2及NF-κB、β-catenin、ERK和PI3K/AKT信号通路取新鲜或-80℃冻存的患者肿瘤组织、癌旁正常组织和小鼠肿瘤组织,碾磨后用含cocktail蛋白酶抑制剂的RIPA裂解液进行裂解,超声后1 2000 r/min离心,取上清液即为总蛋白。贴壁细胞用PBS润洗,吸弃后加入含cocktail蛋白酶抑制剂的RIPA裂解液进行裂解,收集裂解液,超声后12 000 r/min离心,取上清液即为总蛋白。组织与细胞样品的蛋白浓度均用BCA试剂盒进行测定。SDS-PAGE电泳用5%的浓缩胶与12%的分离胶进行,每孔上蛋白样80~100 μg。电泳后将蛋白转至PVDF膜,用5%BSA封闭,一抗4℃孵育过夜。洗涤,二抗室温孵育,洗涤,DAB显色。
1.5 免疫组织化学染色检测CXCL5与CXCR2采用SP法检测胃癌患者肿瘤及癌旁正常组织中CXCL5与其受体CXCR2的表达。将10%甲醛溶液固定过夜的组织进行石蜡包埋与切片,所有切片常规脱蜡至水,加0.01 mol/L枸橼酸缓冲液(pH6.0),用高压锅进行抗原热修复,加3%H2O2室温避光孵育30 min,PBS洗涤3次。滴加10%的正常非免疫羊血清,37℃孵育60 min,PBS洗涤3次。滴加CXCL5或CXCR2一抗工作液(稀释比例为1:50),4℃孵育过夜,PBS洗涤3次。滴加二抗工作液(稀释比例为1:200),37℃孵育60 min,PBS洗涤3次。滴加辣根过氧化物酶(HRP)标记的链霉卵白素,37℃孵育60 min,PBS洗涤3次。用DAB显色、苏木精对比染色、脱水、二甲苯透明、中性树胶封片。显微镜下观察,每个切片随机选取5个视野进行拍照。用Image Pro Plus软件计算阳性染色的平均吸光度。
1.6 质粒构建与稳定表达细胞株建立根据人CXCL5的mRNA序列(NM_002994.5)和pLVX-Tight-Puro载体图谱,设计引物序列,上游引物:5’-CCGGGATCCATGAGCCTCCTGTCCAGC-3’(BamHⅠ); 下游引物:5’-CCCGGTAGAATTCGTTTTCCTTGTTTCCACC-3’(EcoRⅠ)。从人胃癌细胞株SNU216中提取总RNA并反转录为cDNA。以cDNA为模板,根据Taq酶的说明书进行PCR扩增。扩增产物经鉴定、纯化后备用。用BamHⅠ和EcoRⅠ酶对pLVX-Tight-Puro质粒进行双酶切,酶切产物经鉴定、纯化后备用。根据T4连接酶的说明书将cDNA扩增产物与酶切质粒进行连接,连接产物经转化与鉴定后提取质粒备用。pLVX-CXCL5质粒构建成功后根据pLVX-Tight-Puro的说明书包装慢病毒。慢病毒感染SNU216或MFC细胞,用嘌呤霉素筛选稳定表达CXCL5的细胞。
1.7 小鼠移植瘤模型的建立将30只C57小鼠随机分为CXCL5过表达组和对照组,每组15只。将对数期生长的稳定过表达CXCL5或对照小鼠胃癌MFC细胞消化、离心、PBS重悬、计数后调整细胞浓度至1.0×107/ml,无菌条件下将细胞接种于C57小鼠左前肢腋窝结合部皮下,每只0.1 ml。接种后第3天起隔天记录各小鼠的肿瘤大小,绘制肿瘤生长与生存曲线。用Western blot分析各组小鼠肿瘤组织中CXCL5、磷酸化NF-κB与磷酸化β-catenin的表达水平。分离小鼠胃癌移植瘤细胞。用流式细胞术检测移植瘤中CD4+T细胞、CD8+T细胞与CD56+CD16+NK细胞比例。
1.8 流式细胞术检测CD4+T、CD8+T与CD56+CD16+NK细胞分离小鼠胃癌移植瘤组织切块,置于RPMI1640培养基中消化过夜、研磨、过不锈钢网过筛,经PBS洗涤后制成单细胞悬液,计数并将细胞浓度调整到1.0×107/ml,取0.5 ml细胞悬液加入离心管。根据抗体的使用说明书将待测抗体(CD4、CD8、CD56或CD16)以适当比例加入离心管中。涡旋混匀并将离心管置于避光处室温孵育30 min。低速离心机1 500 r/min离心5 min后弃上清液,并用PBS洗涤3次。再次弃上清液后加入0.3 ml的PBS重悬。涡旋混匀后上流式细胞仪进行检测。
1.9 统计学方法所有数据分析均采用SPSS20.0进行。采用Graph Pad Prism 5.0进行作图。计数资料用频数和百分比(n(%))表示,计量资料用均数±标准差(x±s)表示。采用t检验或Mann-Whitney U检验分析两独立样本之间的差异,采用χ2检验或Fisher精确检验进行计数资料分析。所有统计学分析均为双尾检验,P < 0.05为差异有统计学意义。
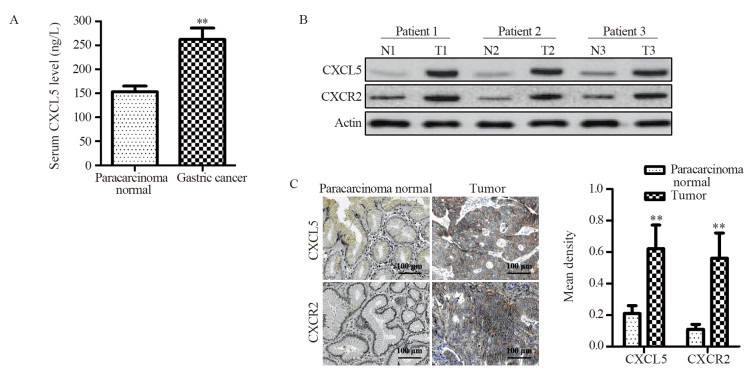
2 结果 2.1 胃癌患者血清及组织中CXCL5水平分析共纳入83例胃癌患者。ELISA分析显示胃癌患者的血清CXCL5水平为(263.1±37.9)ng/L,显著高于健康者的(158.6±18.3)ng/L。Western blot与免疫组织化学分析显示,胃癌患者肿瘤组织中的CXCL5及其受体CXCR2的水平均显著高于癌旁正常组织,见图 1。
|
| **: P < 0.001, compared with paracarcinoma normal group; N: normal; T: tumor. 图 1 胃癌患者血清(A)及肿瘤组织(B, C)中的CXCL5水平 Figure 1 Expression of CXCL5 in serum (A) and tumor tissues (B, C) of gastric cancer patients |
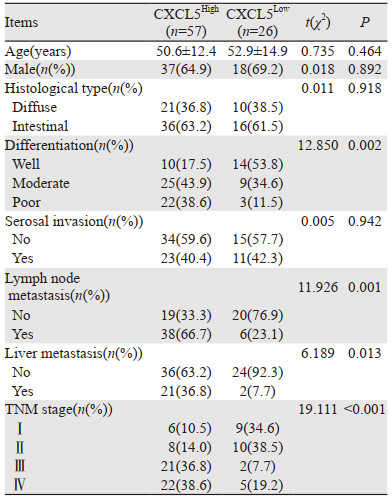
根据患者肿瘤组织中CXCL5的表达水平,以所有患者的平均吸光度值为界限将所有患者分为CXCL5低表达组(CXCL5Low)与CXCL5高表达组(CXCL5High)。CXCL5低表达组26例、CXCL5高表达组57例。胃癌患者中CXCL5高表达与CXCL5低表达组的年龄、性别、组织学类型与浆膜浸润相比差异均无统计学意义(均P > 0.05)。CXCL5高表达组患者的分化程度显著低于CXCL5低表达组(P < 0.05),淋巴结转移、肝转移和TNM分期均显著高于CXCL5低表达组(均P < 0.05),见表 2。
|
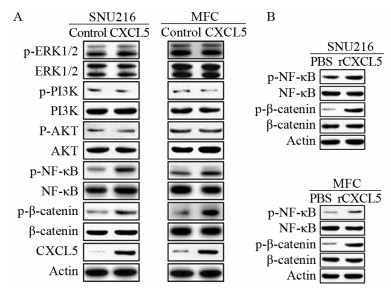
Western blot显示CXCL5过表达能显著增加SNU216与MFC细胞中p-NF-κB与p-β-catenin的表达水平,而不影响p-ERK、p-PI3K与p-AKT的表达水平,见图 2A。进一步分析显示,重组CXCL5蛋白(rCXCL5)也能显著增加SNU216与MFC细胞中p-NF-κB与p-β-catenin的表达水平,见图 2B。
|
| 图 2 CXCL5过表达对胃癌细胞信号通路的影响 Figure 2 Effect of CXCL5 overexpression on signal pathways of gastric cancer cells |
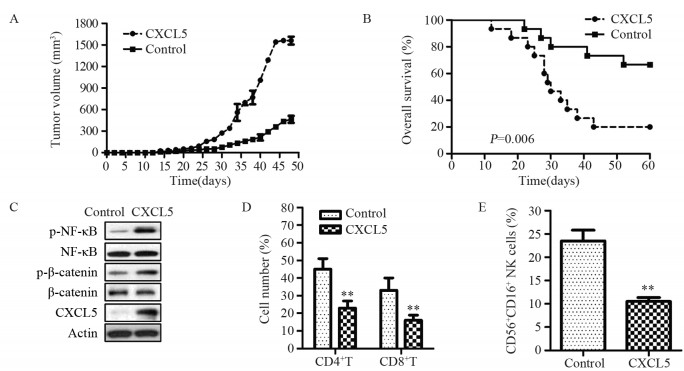
与对照组相比,CXCL5过表达组胃癌移植瘤小鼠的肿瘤体积显著增高(P < 0.05),见图 3A; 生存期显著降低(P=0.006),见图 3B。Western blot结果显示CXCL5过表达组中CXCL5、p-NF-κB与p-β-catenin的表达水平均显著高于对照组,见图 3C。流式分析结果显示CXCL5过表达组中CD4+T细胞、CD8+T细胞与CD56+CD16+NK细胞数量均显著低于对照组,见图 3D~E。
|
| **: P < 0.001, compared with control group of mice. 图 3 CXCL5过表达对胃癌移植瘤小鼠模型的影响 Figure 3 Effect of CXCL5 overexpression on xenograft model of gastric cancer |
胃癌的病理学发生机制涉及多种基因与信号通路的改变,而其确切的发病机制尚未被完全阐明。因此,进一步研究胃癌的发病机制,寻找新的生物指标和治疗靶点至关重要。CXCL5可通过其ELR功能区与CXCR2结合,进而介导肿瘤的生长、浸润与转移[15-16]。研究指出,CXCL5与非小细胞肺癌、膀胱癌、肝癌等的发病机制密切相关[16-18]。多项报道指出胃癌患者的血清CXCL5水平高于健康者[19]。而CXCL5在胃癌中的确切作用机制尚无报道。本研究结果显示,胃癌患者血清与肿瘤组织中的CXCL5水平均出现显著升高。同时,与对照组小鼠相比,过表达CXCL5组胃癌移植瘤小鼠的肿瘤体积显著增高,生存期显著降低。这些结果提示CXCL5可能参与胃癌的发生与发展机制。
胃癌肿瘤组织中NF-κB的表达水平显著高于癌旁正常组织,且NF-κB的表达与胃癌的分化程度和淋巴结转移密切相关[20]。Wnt/β-catenin信号通路作用广泛,Wnt/β-catenin信号通路亦与胃癌密切相关[21]。近年的研究发现,多种靶向Wnt/β-catenin信号通路的治疗均能有效抑制胃癌细胞的增殖与转移[21]。本研究中CXCL5过表达与重组CXCL5蛋白处理均能显著增加SNU216与MFC细胞的p-NF-κB与p-β-catenin的表达水平,而不影响p-ERK、p-PI3K与p-AKT的表达水平,提示CXCL5可能通过NF-κB与Wnt/β-catenin信号通路发挥促胃癌的作用。
免疫治疗利用肿瘤的免疫学特性杀灭肿瘤细胞和肿瘤组织[9-10],现已成为肿瘤治疗的热点之一[8]。肿瘤的免疫治疗通过调动宿主的免疫系统,使宿主对肿瘤的杀伤能力增强,进而消灭肿瘤细胞[8-9]。研究指出,与健康者相比,胃癌患者免疫细胞(如CD4+T细胞等)的数量均出现显著降低[22]。本研究中,CXCL5过表达组胃癌移植瘤小鼠的肿瘤组织中CD4+T细胞、CD8+T细胞与CD56+CD16+NK细胞的数量均显著低于对照组。因此,CXCL5可能通过NF-κB与Wnt/β-catenin信号通路发挥抑制胃癌肿瘤免疫的作用。
综上所述,胃癌患者肿瘤组织及血清中CXCL5水平均显著升高,CXCL5可能通过激活NF-κB与Wnt/β-catenin信号通路抑制胃癌的肿瘤免疫活性进而发挥促进胃癌的作用。
作者贡献
刘立:实验设计与实施、文章写作
盖金娜:文献查阅、数据分析
尹作文:数据分析
陈琴华:课题整体设计、文章修改
| [1] |
左婷婷, 郑荣寿, 曾红梅, 等. 中国胃癌流行病学现状[J]. 中国肿瘤临床, 2017, 44(1): 52-58. [Zuo TT, Zheng RS, Zeng HM, et al. Epidemiology of stomach cancer in China[J]. Zhongguo Zhong Liu Lin Chuang, 2017, 44(1): 52-58. DOI:10.3969/j.issn.1000-8179.2017.01.881] |
| [2] |
Zong L, Abe M, Seto Y, et al. The challenge of screening for early gastric cancer in China[J]. Lancet, 2016, 388(10060): 2606. DOI:10.1016/S0140-6736(16)32226-7 |
| [3] |
Yoon H, Kim N. Diagnosis and management of high risk group for gastric cancer[J]. Gut Liver, 2015, 9(1): 5-17. DOI:10.5009/gnl14118 |
| [4] |
Baretton GB, Aust DE. Current biomarkers for gastric cancer[J]. Pathologe, 2017, 38(2): 93-97. DOI:10.1007/s00292-017-0271-3 |
| [5] |
关晓英, 王芙蓉. 胃黏膜瘤变过程中差异蛋白的表达[J]. 肿瘤防治研究, 2018, 45(8): 576-582. [Guan XY, Wang FR. Proteomics Research on Gastric Intraepithelial Neoplasia[J]. Zhong Liu Fang Zhi Yan Jiu, 2018, 45(8): 576-582. DOI:10.3971/j.issn.1000-8578.2018.17.1439] |
| [6] |
Venerito M, Vasapolli R, Malfertheiner P. Prevention, early diagnosis and therapy of gastric cancer[J]. MMW Fortschr Med, 2016, 158(13): 39-43. DOI:10.1007/s15006-016-8513-5 |
| [7] |
Strong VE. Progress in gastric cancer[J]. Updates Surg, 2018, 70(2): 157-159. DOI:10.1007/s13304-018-0543-3 |
| [8] |
Niccolai E, Taddei A, Prisco D, et al. Gastric cancer and the epoch of immunotherapy approaches[J]. World J Gastroenterol, 2015, 21(19): 5778-5793. DOI:10.3748/wjg.v21.i19.5778 |
| [9] |
Bonotto M, Garattini SK, Basile D, et al. Immunotherapy for gastric cancers: emerging role and future perspectives[J]. Expert Rev Clin Pharmacol, 2017, 10(6): 609-619. DOI:10.1080/17512433.2017.1313113 |
| [10] |
Zhao Q, Cao L, Guan L, et al. Immunotherapy for gastric cancer: dilemmas and prospect[J]. Brief Funct Genomics, 2019, 18(2): 107-112. DOI:10.1093/bfgp/ely019 |
| [11] |
Gerson JN, Skariah S, Denlinger CS, et al. Perspectives of HER2-targeting in gastric and esophageal cancer[J]. Expert Opin Investig Drugs, 2017, 26(5): 531-540. DOI:10.1080/13543784.2017.1315406 |
| [12] |
Gu L, Chen M, Guo D, et al. PD-L1 and gastric cancer prognosis: A systematic review and meta-analysis[J]. PLoS One, 2017, 12(8): e0182692. DOI:10.1371/journal.pone.0182692 |
| [13] |
Nagarsheth N, Wicha MS, Zou W. Chemokines in the cancer microenvironment and their relevance in cancer immunotherapy[J]. Nat Rev Immunol, 2017, 17(9): 559-572. DOI:10.1038/nri.2017.49 |
| [14] |
Roca H, Jones JD, Purica MC, et al. Apoptosis-induced CXCL5 accelerates inflammation and growth of prostate tumor metastases in bone[J]. J Clin Invest, 2018, 128(1): 248-266. |
| [15] |
Yildirim K, Colak E, Aktimur R, et al. Clinical value of CXCL5 for determining of colorectal cancer[J]. Asian Pac J Cancer Prev, 2018, 19(9): 2481-2484. |
| [16] |
Wang L, Shi L, Gu J, et al. CXCL5 regulation of proliferation and migration in human non-small cell lung cancer cells[J]. J Physiol Biochem, 2018, 74(2): 313-324. DOI:10.1007/s13105-018-0619-z |
| [17] |
Qi Y, Zhao W, Li M, et al. High C-X-C motif chemokine 5 expression is associated with malignant phenotypes of prostate cancer cells via autocrine and paracrine pathways[J]. Int J Oncol, 2018, 53(1): 358-370. |
| [18] |
Zhou SL, Zhou ZJ, Hu ZQ, et al. CXCR2/CXCL5 axis contributes to epithelial-mesenchymal transition of HCC cells through activating PI3K/Akt/GSK-3β/Snail signaling[J]. Cancer Lett, 2015, 358(2): 124-135. DOI:10.1016/j.canlet.2014.11.044 |
| [19] |
Lim JB, Chung HW. Serum ENA78/CXCL5, SDF-1/CXCL12, and their combinations as potential biomarkers for prediction of the presence and distant metastasis of primary gastric cancer[J]. Cytokine, 2015, 73(1): 16-22. |
| [20] |
Sokolova O, Naumann M. NF-κB Signaling in Gastric Cancer[J]. Toxins (Basel), 2017, 9(4): pii: E119. DOI:10.3390/toxins9040119 |
| [21] |
Molaei F, Forghanifard MM, Fahim Y, et al. Molecular Signaling in Tumorigenesis of Gastric Cancer[J]. Iran Biomed J, 2018, 22(4): 217-230. DOI:10.29252/ibj.22.4.217 |
| [22] |
Takaya S, Saito H, Ikeguchi M. Upregulation of Immune Checkpoint Molecules, PD-1 and LAG-3, on CD4+ and CD8+ T Cells after Gastric Cancer Surgery[J]. Yonago Acta Med, 2015, 58(1): 39-44. DOI:10.1006/jcec.2000.1673 |
 2020, Vol. 47
2020, Vol. 47