文章信息
- 临床T2N0M0食管鳞癌患者病理分期上升的影响因素
- Risk Factors of Pathological Upstaging for Patients with Clinical T2N0M0 Esophageal Squamous Cell Carcinoma
- 肿瘤防治研究, 2019, 46(9): 802-806
- Cancer Research on Prevention and Treatment, 2019, 46(9): 802-806
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2019.18.1967
- 收稿日期: 2019-02-28
- 修回日期: 2019-05-07
临床T2N0M0食管鳞癌患者病理分期准确率很低[1]。其中,大部分患者术后病理分期大于T2N0M0,这部分实际为局部进展期的患者存在分期不足,另外一部分术后病理分期为T1N0M0患者,这部分患者存在分期过度[1-2]。一般认为,对于分期过度的患者可以采用直接手术治疗,而对于分期不足的患者可能需要进行新辅助治疗。这些分期不足的患者可能没有接受新辅助治疗和扩大淋巴结切除术,导致分期不足的患者比病理T2N0M0患者的存活率更低[3-4]。有研究认为新辅助治疗可以改善临床T2N0M0食管癌患者的生存[5];也有研究认为,新辅助治疗虽然可以降低患者的肿瘤分期,但是并不改善患者的生存,但由于超过一半患者存在分期上升,所以仍推荐新辅助治疗[6];相反,也有研究认为新辅助治疗不利于患者的长期生存[7]。目前,由于临床T2N0M0食管鳞癌患者分期的准确性不高,该类患者治疗模式仍然存在争论。本研究拟通过对临床T2N0M0食管鳞癌患者临床病理资料的分析,探讨患者术后病理分期上升的影响因素,期望为改进患者的治疗策略提供依据。
1 资料与方法 1.1 病例资料通过郑州大学附属肿瘤医院LinkDoc数据库收集2015年12月1日—2017年7月31日在胸外科术前诊断为临床T2N0M0食管鳞癌并且行胸腹腔镜下根治性手术切除+胸腹二野淋巴结清扫术患者的临床资料,包括患者年龄、性别、病变位置、肿瘤分化程度、大体病理类型、超声电子胃镜下肿瘤病变长度、浸润深度、淋巴结切除个数、术后病理分期等。
1.2 诊断方法所有患者均进行超声电子胃镜及胸腹部CT检查。患者肿瘤T2分期通过超声电子胃镜确定,N0分期通过影像学淋巴结短径 < 6 mm确定。食管癌的分段采用美国癌症联合会(AJCC)2009标准。
1.3 手术方法所有患者行胸腹腔镜下食管根治性手术切除+胸腹二野淋巴结清扫术,食管胃颈部吻合。
1.4 统计学方法应用SPSS22.0软件进行统计分析, 计量资料用均数±标准差(x±s)表示。计数资料以频数或百分率表示;两个独立样本组间比较采用t检验;组间率的比较采用χ2检验。单变量和多变量Logistic回归模型用于预测病理分期上升的危险因素。P < 0.05为差异有统计学意义。
2 结果 2.1 一般资料共收集149例患者,其中男102例、女47例,术后病理诊断T2N0M0患者59例,准确率39.6%;15.4%患者病理分期下降(23/149);45%患者病理分期上升(67/149);42例患者发生病理T分期上升(28.2%);45例患者发生淋巴结转移,淋巴结转移率为30.2%(45/149);19例患者同时存在T分期上升和淋巴结转移(12.8%, 19/149);平均每个患者清扫淋巴结29.9个,见表 1。

|
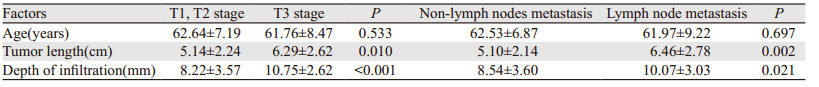
对分层变量进行卡方检验,以P < 0.05为标准,筛选出T分期上升的影响因素为大体病理类型和分化程度,对淋巴结转移的影响因素均无统计学意义,见表 2。由于统计分析时发现蕈伞型食管鳞癌患者肿瘤浸润深度明显大于其他类型,而肿瘤侵入食管壁较浅,考虑蕈伞型食管鳞癌的生物学特性主要是向管腔内生长,与其他类型向食管壁内生长不同,所以在其他数据分析中剔除了大体病理类型为蕈伞型的患者(11例)。对连续变量进行t检验,以P < 0.05为标准,筛选出T分期上升和淋巴结转移的影响因素均为病变长度和浸润深度,见表 3。

|
|
不同病理T分期患者的淋巴结转移率组间差异有统计学意义(χ2=12.24, P=0.002),见表 4。

|
经多变量逐步Logistic回归分析,筛选出T分期上升的影响因素为肿瘤长度、浸润深度和分化程度;建立Logistic回归方程:ln[P/(1-P)]=-1.722+0.255*肿瘤长度+0.161*浸润深度-1.728*中分化程度-1.257*低分化程度。预测正确率为76.1%;其中无T分期上升组预测正确率较高,为88.7%;T分期上升组预测正确率较低,仅为46.3%。筛选出淋巴结转移的影响因素为肿瘤长度、分化程度和病变位置;建立Logistic回归方程:ln[P/(1-P)]= -2.070+0.304*肿瘤长度-1.258*中分化程度-1.217*低分化程度-0.678*食管胸中段-1.214*食管胸下段。预测正确率为74.6%;其中无N分期上升组预测正确率较高,为89.7%;N分期上升组预测正确率较低,仅为39.0%,见表 5。

|
肿瘤的临床分期可以预测患者的生存和筛选患者进行新辅助治疗。对食管癌患者治疗前进行临床分期是至关重要的一步[8-9]。由于目前临床T2N0M0食管癌患者的分期准确性较低,所以它的治疗策略仍然存在争论[5-7]。临床T2N0M0食管鳞癌患者存在明显术后病理分期上升情况[10]。文献报道,使用CT、PET-CT和超声电子胃镜进行分期,准确性较差,即使使用联合诊断,临床T2N0食管癌患者术前分期和实际病理分期的一致性仍然较差[2, 11-13]。分期不足的患者主要是存在隐匿性的淋巴结转移,而分期过度的患者是因为肿瘤浸润深度的识别不准确[5-7, 14]。本研究中我们通过CT和超声电子胃镜对全部临床T2N0食管鳞癌患者进行分期,结果发现,分期准确率为39.6%,45%患者存在分期不足,15.4%患者存在分期过度。这与既往的报道[3, 13-15]相一致。
目前,临床T2N0M0食管鳞癌患者术后病理分期上升的影响因素并不十分明确。本研究将患者年龄、性别、病变位置、肿瘤分化程度、大体病理类型、肿瘤长度、浸润深度作为影响因素进行分析。单因素分析显示,T分期上升的影响因素为病变长度、肿瘤浸润深度、大体病理类型和分化程度;淋巴结转移的影响因素为病变长度和浸润深度。多变量分析结果显示,T分期上升的影响因素为肿瘤长度、浸润深度和分化程度;淋巴结转移的影响因素为肿瘤长度、分化程度和病变位置。我国学者曾仅以食管癌病变长度作为食管癌(1976年阳泉分期)非手术分期的标准, 但病变长度与肿瘤分期是否有关目前尚存在争论[15]。本研究中病变长度是病理T分期上升和淋巴结转移的影响因素。有研究显示,肿瘤分化程度越高淋巴结转移率越低[11, 15],肿瘤细胞分化程度差是病理分期上升的独立影响因素[5-7]。也有研究显示,术前活检病理肿瘤分级升高和存在淋巴管浸润可以共同预测病理分期的上升[1]。但是由于胃镜活检组织块太小,目前很多机构病理结果没有报告淋巴管浸润情况。本研究结果同样显示低分化程度是临床T2N0M0食管鳞癌患者T分期上升和淋巴结转移的危险因素。
有研究显示食管癌的淋巴结转移率和肿瘤浸润深度有关[5-7, 15],通常肿瘤浸润越深,淋巴结转移率越高[16]。所以T分期和N分期并不是相互独立的变量。研究报道临床T2N0食管癌患者的淋巴结转移率为39%到55%[5-7, 11]。本研究显示,随着病理T分期上升,患者的淋巴结转移率也逐渐上升,并且肿瘤浸润越深,患者病理T分期上升的可能越大。多数研究认为胸段食管癌淋巴结转移与肿瘤位置无关[17-18]。本研究中单因素分析结果显示胸段食管癌淋巴结转移与肿瘤位置无关,但是多因素分析显示肿瘤位置是淋巴结转移的影响因素。这可能与本研究中手术方式采用胸腹二野淋巴结清扫术, 清扫范围和数目有限, 尚不能完整显示食管癌淋巴结转移特点和规律有关。
本研究显示大体病理类型是病理T分期上升的影响因素。糜烂性食管癌患者病理T分期上升率很低,淋巴结转移率明显低于其他类型,可能与糜烂性食管癌患者浸润深度大多仅达到浅肌层有关[19]。有报道认为蕈伞型食管癌淋巴结转移率相对较低[11],而本研究中相对较高,但是这并不矛盾。因为其他研究包含了所有分期的蕈伞型食管癌,并且通常蕈伞型食管癌患者由于肿瘤向管腔内生长,很早就出现梗阻症状,所以发现时病理分期较早。本研究中已经排除了临床分期较早的蕈伞型食管癌患者,肿瘤达到临床诊断为T2时肿瘤通常比较大。所以本研究中蕈伞型食管癌患者淋巴结转移率较高。
综上所述,我们认为临床T2N0M0食管鳞癌患者病理分期上升虽有一定规律,但目前诊断方法有限,涉及因素复杂,T2N0M0食管鳞癌患者临床分期仍然高度不准确。临床T2N0M0食管鳞癌患者病理分期上升与肿瘤长度、浸润深度、大体病理类型、分化程度和病变位置有关。准确预测临床T2N0M0食管鳞癌患者病理分期,可以为改进患者的治疗策略提供依据。术后病理分期上升的患者可以选择新辅助治疗或者扩大的淋巴结清扫,从而改善患者生存,同时也可以避免分期过度患者进行不必要的新辅助治疗。
作者贡献
吕宏伟:文章撰写、资料采集及统计学分析
邢文群、申思宁、周美宏:文章审校
刘奇、程纪伟:资料采集及统计学分析
| [1] | Samson P, Puri V, Robinson C, et al. Clinical T2N0 Esophageal Cancer: Identifying Pretreatment Characteristics Associated With Pathologic Upstaging and the Potential Role for Induction Therapy[J]. Ann Thorac Surg, 2016, 101(6): 2102–2111. DOI:10.1016/j.athoracsur.2016.01.033 |
| [2] | Shin S, Kim HK, Choi YS, et al. Clinical stage T1-T2N0M0 oesophageal cancer: accuracy of clinical staging and predictive factors for lymph node metastasis[J]. Eur J Cardiothorac Surg, 2014, 46(2): 274–279. DOI:10.1093/ejcts/ezt607 |
| [3] | Semenkovich TR, Panni RZ, Hudson JL, et al. Comparative effectiveness of upfront esophagectomy versus induction chemoradiation in clinical stage T2N0 esophageal cancer: A decision analysis[J]. J Thorac Cardiovasc Surg, 2018, 155(5): 2221–2230. DOI:10.1016/j.jtcvs.2018.01.006 |
| [4] | Kidane B, Korst RJ, Weksler B, et al. Neoadjuvant therapy vs upfront surgery for clinical T2N0 esophageal cancer: A systematic review[J]. Ann Thorac Surg, 2019, 108(3): 935–944. DOI:10.1016/j.athoracsur.2019.04.008 |
| [5] | Markar SR, Gronnier C, Pasquer A, et al. Role of neoadjuvant treatment in clinical T2N0M0 oesophageal cancer: results from a retrospective multi-center European study[J]. Eur J Cancer, 2016, 56: 59–68. DOI:10.1016/j.ejca.2015.11.024 |
| [6] | Zhang JQ, Hooker CM, Brock MV, et al. Neoadjuvant chemoradiation therapy is beneficial for clinical stage T2 N0 esophageal cancer patients due to inaccurate preoperative staging[J]. Ann Thorac Surg, 2012, 93(2): 429–437. DOI:10.1016/j.athoracsur.2011.10.061 |
| [7] | Speicher PJ, Ganapathi AM, Englum BR, et al. Induction therapy does not improve survival for clinical stage T2N0 esophageal cancer[J]. J Thorac Oncol, 2014, 9(8): 1195–1201. DOI:10.1097/JTO.0000000000000228 |
| [8] | Goense L, Visser E, Haj Mohammad N, et al. Role of neoadjuvant chemoradiotherapy in clinical T2N0M0 esophageal cancer: A population-based cohort study[J]. Eur J Surg Oncol, 2018, 44(5): 620–625. DOI:10.1016/j.ejso.2018.02.005 |
| [9] | Luc G, Vendrely V, Terrebonne E, et al. Neoadjuvant chemoradiotherapy improves histological results compared with perioperative chemotherapy in locally advanced esophageal adenocarcinoma[J]. Ann Surg Oncol, 2015, 22(2): 604–609. DOI:10.1245/s10434-014-4005-y |
| [10] | Dolan JP, Kaur T, Diggs BS, et al. Significant understaging is seen in clinically staged T2N0 esophageal cancer patients undergoing esophagectomy[J]. Dis Esophagus, 2016, 29(4): 320–325. DOI:10.1111/dote.12334 |
| [11] | Stiles BM, Mirza F, Coppolino A, et al. Clinical T2-T3N0M0 esophageal cancer: the risk of node positive disease[J]. Ann Thorac Surg, 2011, 92(2): 491–496. DOI:10.1016/j.athoracsur.2011.04.004 |
| [12] | Shridhar R, Huston J, Meredith KL. Accuracy of endoscopic ultrasound staging for T2N0 esophageal cancer: a National Cancer Database analysis[J]. J Gastrointest Oncol, 2018, 9(5): 887–893. DOI:10.21037/jgo.2018.01.16 |
| [13] | Tekola BD, Sauer BG, Wang AY, et al. Accuracy of endoscopic ultrasound in the diagnosis of T2N0 esophageal cancer[J]. J Gastrointest Cancer, 2014, 45(3): 342–346. DOI:10.1007/s12029-014-9616-9 |
| [14] | Song Y, Tao G, Guo Q, et al. Survival benefit of surgery with radiotherapy vs surgery alone to patients with T2-3N0M0 stage esophageal adenocarcinoma[J]. Oncotarget, 2016, 7(16): 21347–21352. |
| [15] | 林家培, 何子墨, 李嘉睿, 等. 胸段食管癌淋巴结转移影响因素探讨[J]. 长治医学院学报, 2017, 31(3): 184–185, 197. [ Lin JP, He ZM, Li JR, et al. The study of influencing factors of lymphatic metastasis in thoracic esophageal carcinoma[J]. Changzhi Yi Xue Yuan Xue Bao, 2017, 31(3): 184–185, 197. DOI:10.3969/j.issn.1006-0588.2017.03.007 ] |
| [16] | Stein HJ, Feith M, Bruecher BL, et al. Early esophageal cancer: pattern of lymphatic spread and prognostic factors for long-term survival after surgical resection[J]. Ann Surg, 2005, 242(4): 566–575. |
| [17] | 代磊, 任自学, 张安庆, 等. 177例胸段食管癌淋巴结转移规律研究[J]. 中国胸心血管外科临床杂志, 2017, 24(2): 122–126. [ Dai L, Ren ZX, Zhang AQ, et al. Pattern of lymph node metastasis in 177 thoracic esophageal cancer patients[J]. Zhongguo Xiong Xin Xue Guan Wai Ke Lin Chung Za Zhi, 2017, 24(2): 122–126. ] |
| [18] | 亓磊, 田辉, 李林, 等. 微创食管癌切除术后淋巴结转移规律及预后分析[J]. 中华腔镜外科杂志(电子版), 2018, 11(2): 98–102. [ Qi L, Tian H, Li L, et al. Clinicopathological features of lymph node metastasis and prognostic factors in esophageal cancer treated with minimally invasive esophagectomy[J]. Zhonghua Qiang Jing Wai Ke Za Zhi(Dian Zi Ban), 2018, 11(2): 98–102. DOI:10.3877/cma.j.issn.1674-6899.2018.02.009 ] |
| [19] | Gabriel E, Attwood K, Du W, et al. Association Between Clinically Staged Node-Negative Esophageal Adenocarcinoma and Overall Survival Benefit From Neoadjuvant Chemoradiation[J]. JAMA Surg, 2016, 151(3): 234–245. DOI:10.1001/jamasurg.2015.4068 |
 2019, Vol. 46
2019, Vol. 46


