文章信息
- 过表达miR-7对结肠癌HCT-116细胞生物学行为的影响
- Effect of miR-7 Overexpression on Biological Behavior of Colon Carcinoma HCT-116 Cells
- 肿瘤防治研究, 2019, 46(2): 115-120
- Cancer Research on Prevention and Treatment, 2019, 46(2): 115-120
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2019.18.0971
- 收稿日期: 2018-07-16
- 修回日期: 2018-09-09
2. 650032 昆明,昆明医科大学第一附属医院胃肠外科;
3. 400700 重庆,重庆市第九人民医院肛肠外科
2. Department of Gastrointestinal Surgery, First Affiliated Hospital of Kunming Medical University, Kunming 650032, China;
3. Department of Anorectal Surgery, The Ninth People' s Hospital of Chongqing, Chongqing 400700, China
结直肠癌(colorectal cancer, CRC)是常见恶性肿瘤之一。在中国大陆,其发病率每年增加[1]。当前,每年全世界将会有12 500万人诊断为CRC,60多万人死于此病[2]。其发病原因和机制仍有待于进一步研究。研究显示miRNAs与肿瘤的发生发展密切相关,能作为一类潜在的癌基因或抑癌基因发生作用[3]。有关miRNAs的研究进展为CRC的发生机制提供了新的见解和观点[4]。大量研究显示miRNAs的异常表达和肿瘤细胞增殖、分化、凋亡和组织发育密切相关,并参与肿瘤的发生发展[5],可能作为一种潜在的抗癌药物的靶点。有研究表明miR-7(micro-ribonucleic acid-7)与肿瘤密切相关,但在CRC中其具体作用机制尚不清楚。我们拟上调CRC细胞中miR-7的表达,研究其对CRC细胞生物学行为的影响。
1 材料与方法 1.1 主要试剂结肠癌细胞HCT-116购自中国科学院上海细胞库。含10%小牛血清的RPMI1640、DMEM培养基购自美国Gibco公司,CCK-8试剂购自上海Dojindo公司,LipofectamineTM2000转染试剂购自美国Invitrogen公司,miR-7模拟物(mimics)及无义核苷酸序列由上海吉玛公司合成,引物由上海生工生物工程公司合成。Annexin V-FITC/PI、凋亡检测试剂盒购自美国Invitrogen公司,细胞周期检测试剂盒购自上海碧云天公司,相关蛋白抗体购自美国Santa Cruz公司、甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase, GAPDH)抗体及BCA法蛋白质定量试剂盒购自上海碧云天公司。
1.2 细胞及细胞培养HCT-116用含10%小牛血清、100 u/ml青霉素和100 μg/ml链霉素的DMEM培养液,在37℃、饱和湿度、5%CO2的培养箱中培养,取对数生长期的细胞进行实验。
1.3 细胞转染及分组将HCT-116细胞经过0.25%胰蛋白酶消化传代,取对数生长期HCT-116细胞2×105个每孔接种于6孔板,通过脂质体转染miR-7模拟物(miR-7 mimics)及随机序列(miR-Scramble),将细胞分成miR-7 mimics(Mimics)组、阴性对照(Scramble, negative control, NC)组和空白对照(blank control, MOCK)组。分别用无血清RPMI1640 250 μl稀释LipofectamineTM2000转染试剂8 μl和miR-7 mimics/NC/PBS 12.5 μl,室温静置5 min,然后将转染试剂分别与稀释miR-7 mimics/NC/PBS混合,室温下静置20 min后,分别铺到6孔板中的miR-7 mimics组、阴性对照组和空白对照组(转染HCT-116细胞用无血清DMEM),在37℃、5%CO2的培养箱培养,供后续实验使用。
1.4 CCK-8法检测细胞增殖取HCT-116细胞2×103个/孔接种于96孔板,分3组,每组设5个复孔。培养24 h后,3组复孔分别加入miR-21 inhibitor/NC/PBS和转染试剂,每孔的终体积为200 μl,测定0、24、48、72 h时各孔的吸光度值(absorbance, A)(各孔加入CCK-8试剂20 μl, 在37℃培养箱内孵育4 h,酶标仪测定吸光度值),得到4个时间点的吸光度值后绘制细胞增殖曲线。使用已知细胞数目的小孔校正,以时间为横坐标、测得的吸光度值代表细胞相对数为纵坐标,绘制生长曲线。
1.5 流式细胞仪检测细胞周期和凋亡取HCT-116细胞2×105个/孔接种于6孔板,分为miR-7 mimics组、阴性对照组和空白对照组。于培养箱中培养24 h后分别加入转染试剂与miR-7 mimics/NC/PBS,在37℃培养箱内培养24、48、72 h后,离心收集细胞;采用Annexin-Ⅴ试剂盒,流式细胞仪检测细胞凋亡。细胞周期检测用流式细胞仪分别计数G0/G1、S和G2/M期的细胞比例。
1.6 Transwell实验检测细胞侵袭将Matrigel用无血清RPMI1640培养基按1:1比例配制成细胞外基质胶,按30微升/室加入Transwell小室聚碳酸酯膜(直径6.5 mm,孔径8 μm)上面,包被细胞外基质胶。转染24 h后,用2.5%胰酶消化,悬浮于无血清RPMI1640培养基中,调整细胞浓度为1×106个/毫升。置于37℃、5%CO2、饱和湿度培养箱中孵育14 h;每组设3个平行孔,实验重复3次。孵育结束后,擦除小室滤膜内表面的细胞,用4%多聚甲醛固定、PBS轻洗、0.1%结晶紫染色,200倍显微镜下分别计数穿过膜的细胞并拍照,随机选取3个视野,取其平均值。
1.7 实时荧光定量PCR(real-time fluorescence quantitative PCR, RT-Fq-PCR)按TRIzol说明书抽提总RNA。分别测定RNA在分光光度计280 nm、260 nm和230 nm的吸光度值,计算浓度并评估纯度。按照试剂盒说明书测定miR-7水平,以U6snRNA为内参照计算相对表达量。实验重复三次,取其平均值。
1.8 蛋白印迹法检测蛋白表达转染后72 h分别进行细胞裂解收集蛋白,行SDS-PAGE电泳分离蛋白,并转至硝酸纤维素膜上,常规抗体杂交,增强化学发光剂显色。用Bio-Rad凝胶成像仪显色,行发光检测,Quantity One软件显色凝胶图像的光密度值。以GAPDH蛋白为内参照,以各蛋白条带与GAPDH条带吸光度值的比值表示。实验数据均重复3次,求其均值与标准差。
1.9 统计学方法所有数据均采用SPSS 17.0统计软件包进行数据处理,数据以(x±s)表示。两个样本均数比较采用Independent-Sample T test进行检验,多个样本均数比较采用One-way ANOVA分析。P < 0.05为差异有统计学意义。
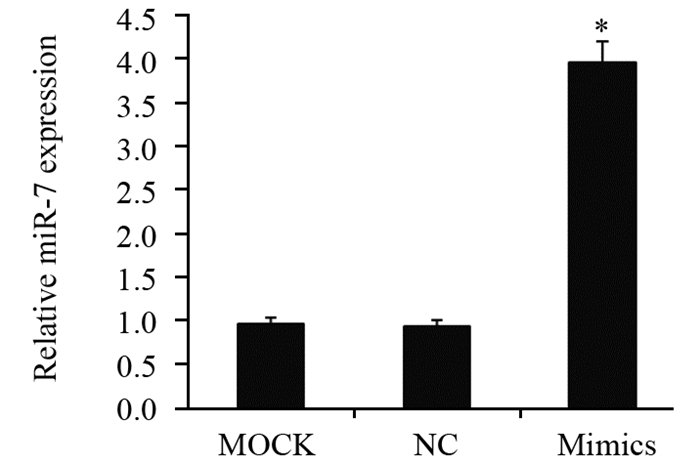
2 结果 2.1 miR-7在HCT-116细胞中的表达转染miR-7 mimics后,RT-Fq-PCR测定miR-7在HCT-116中的相对表达量为(3.95±0.25),明显高于MOCK组(0.96±0.08)和NC组(0.94±0.07),差异有统计学意义(P=0.001),见图 1。
|
| miR-7 mimics; NC: Scramble (negative control) group; MOCK: blank control group; *: P < 0.05, compared with MOCK and NC groups 图 1 上调miR-7对结肠癌HCT-116细胞miR-7表达的影响 Figure 1 Effect of miR-7 mimics on miR-7 expression in HCT-116 cells |
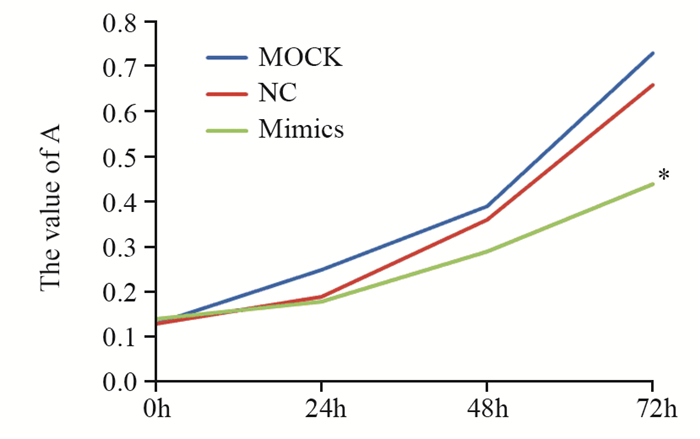
应用CCK-8法检测抑制miR-7表达对HCT-116细胞增殖的影响,结果显示miR-7 mimics组与两对照组之间的细胞增殖在72 h比较差异有统计学意义(P=0.01),对照组之间差异无统计学意义,见图 2。
|
| *: P < 0.05, compared with MOCK and NC groups 图 2 转染miR-7 mimics后对细胞增殖的影响 Figure 2 Effect of miR-7 mimics on HCT-116 cells proliferation |
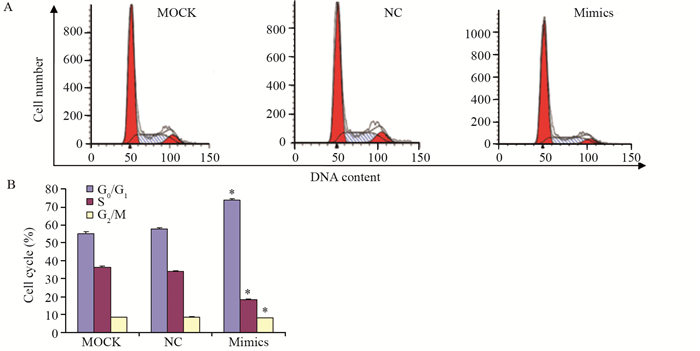
细胞周期分析显示,转染miR-7 mimics的HCT-116细胞48 h后处于G0/G1期的细胞百分比为(73.5±0.8)%,与MOCK组(55.13±0.9)%和NC组(57.5±0.8)%相比明显增加,差异有统计学意义(P=0.001),见图 3。
转染miR-7 mimics后,S期细胞数百分比为(18.30±0.5)%,与MOCK组(36.43±0.6)%和NC组(33.90±0.5)%相比明显减少,差异有统计学意义(P=0.002),见图 3。
|
| *: P < 0.05, compared with MOCK and NC groups 图 3 上调miR-7对结肠癌细胞周期的影响 Figure 3 Effect of miR-7 mimics on cell cycle distribution of HCT-116 cells |
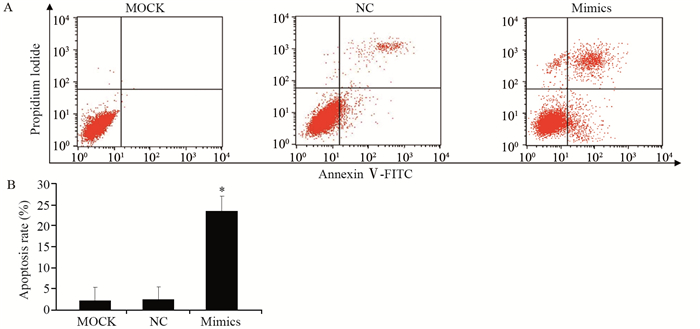
转染miR-7 mimics的HCT-116细胞凋亡率为(23.56±3.50)%,与MOCK(2.12±3.17)%和NC组(2.32±3.21)%相比明显增加,差异有统计学意义(P=0.001),见图 4。
|
| *: P < 0.05, compared with MOCK and NC groups 图 4 上调miR-7对结肠癌细胞凋亡的影响 Figure 4 Effect of miR-7 mimics on HCT-116 cell apoptosis |
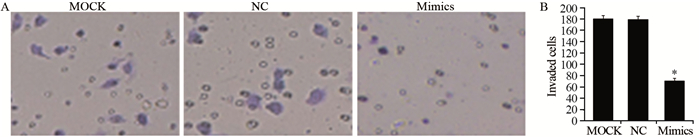
侵袭实验结果显示:miR-7 mimics组穿过细胞数与MOCK组和NC组相比,明显减少(P=0.01),见图 5。提示上调miR-7的表达显著降低细胞的侵袭能力。
|
| *: P < 0.05, compared with MOCK and NC groups 图 5 Transwell实验检测上调miR-7对结肠癌细胞侵袭的影响 Figure 5 Effect of miR-7 mimics on HCT-116 cell invasion detected byTranswell assay |
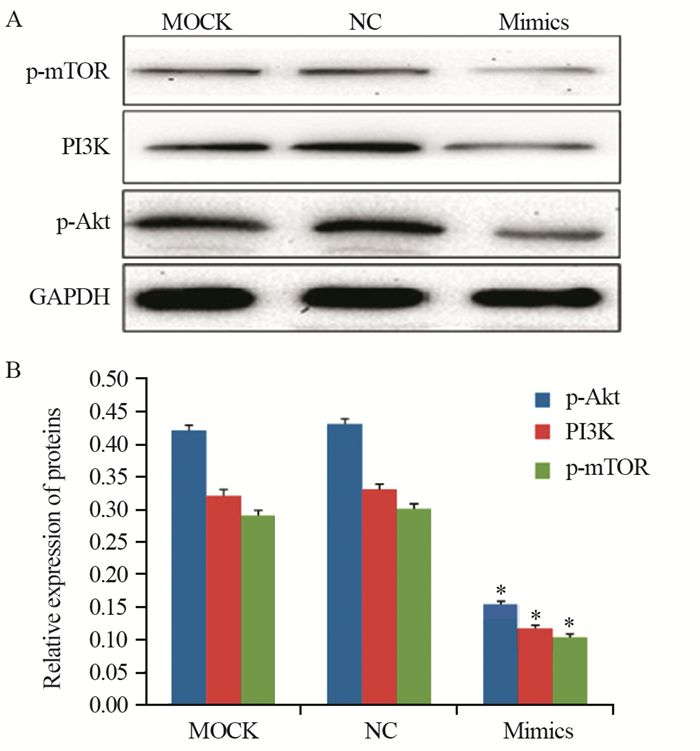
蛋白质印迹法检测结果显示,p-Akt在MOCK、NC和Mimics组的相对表达量分别为(0.42±0.01)、(0.43±0.01)和(0.15±0.01),在Mimics组中明显下降,差异有统计学意义(P=0.01)。PI3K在MOCK、NC和Mimics组的相对表达量分别为(0.32±0.01)、(0.33±0.01)和(0.12±0.01),PI3K在Mimics组中明显下降,差异有统计学意义(P=0.01)。p-mTOR在MOCK、NC和Mimics组的相对表达量分别为(0.29±0.01)、(0.30±0.01)和(0.10±0.01),p-mTOR在Mimics组中明显下降,差异有统计学意义(P =0.02),见图 6。
|
| *: P < 0.05, compared with MOCK and NC groups 图 6 蛋白质印迹法检测上调miR-7对PI3K/AKT信号通路蛋白的影响 Figure 6 Effect of miR-7 mimics on proteins of PI3K/AKT signal pathway detected by Western blot |
微RNA-7(miR-7)是23个核苷酸长的非编码小分子RNA,miR-7在多种肿瘤中低表达,被认为是抑癌基因,与肿瘤生长、转移等密切相关。miR-7可能通过靶向EGFR[6]、FAK[7]、p21-activated kinase 1[8]、PAK1[9]、XRCC2[10]、XIAP[11]、BCL-2[12]、胰岛素样生长因子1受体(insulin-like growth factor 1 receptor, IGF1R)[13]、PAX6[14]等发挥作用,从而抑制肿瘤的发生发展。此外,miR-7还能提高肿瘤对化疗的敏感度,并抑制肿瘤血管生成。
本研究发现,结肠癌细胞转染miR-7 mimics后,miR-7表达水平明显上调。与NC组和MOCK组相比,Mimics组细胞增殖抑制率升高,侵袭能力降低,G0/G1期的细胞比例增高,S期细胞明显减少,细胞凋亡率明显增加。这表明miR-7在CRC中作为一种抑癌基因,可抑制肿瘤细胞的增殖、侵袭,促进肿瘤细胞的凋亡。
进一步研究发现结肠癌细胞转染miR-7 mimics后,PI3K、p-Akt及p-mTOR的蛋白水明显降低。在体外,miR-7过表达通过调控PI3K/AKT信号通路参与细胞周期阻滞和细胞迁移。Fang等[15]研究表明,miR-7可通过参与PI3K/AKT/mTOR途径以及调控靶向基因磷脂酰肌醇-3激酶催化亚基δ(phosphatidylinositol 3-kinasecatalytic subunit δ, PIK3CD)的表达来抑制肿瘤的生长和肝癌细胞的转移,从而充当肿瘤抑制剂。其中PI3K/AKT /mTOR是与细胞增殖和细胞凋亡关系最密切的信号转导通路之一。PI3K/AKT/mTOR信号转导通路活化可以通过调控多个与细胞凋亡有关的家族而抑制细胞凋亡,促进细胞周期进展、细胞的生存和增殖,同时参与血管形成,因此在肿瘤的形成中扮演重要角色,并参与肿瘤的侵袭和转移。
徐瑶等[16]发现Hep-2细胞转染miR-7 mimics后miR-7表达水平明显上调,与NC组和MOCK组相比,miR-7组Hep-2细胞的增殖抑制率升高,迁移能力降低,且PI3K、Akt及p-Akt的mRNA和蛋白水平均降低。研究显示上调喉鳞癌Hep-2细胞中miR-7表达能够抑制肿瘤细胞的增殖与迁移,其机制可能与抑制PI3K/AKT信号通路有关。刘晓智等[17]发现miR-7基因转染组细胞中miR-7水平明显高于对照组和无义序列组;蛋白质印迹法检测结果显示,转染组U251细胞中EGFR、PI3K和Akt2蛋白的水平较对照组均明显降低;U251细胞增殖速度减慢,处于S期的细胞所占比例减少,细胞迁移及软琼脂克隆形成能力均明显降低。所以转染miR-7可有效沉默胶质瘤U251细胞中EGFR/PI3K通路主要成员蛋白的表达,进而逆转其恶性表型,有望成为一种新的胶质瘤基因治疗方法。刘亮洪等[18]发现脑胶质瘤组织中miR-7表达减少,与EGFR/PI3K通路成员表达呈负相关;U251细胞转染miR-7后EGFR、PI3K和AKT表达降低。他们推测EGFR/PI3K通路可能是miR-7调控胶质瘤发生发展的重要机制之一。
miR-7一般认为是抑癌基因,但是少数研究却报道miR-7在肾癌[19]中表达升高,可能是癌基因,这可能与肿瘤组织特异性有关,其具体机制还需要进一步研究。
本研究发现上调miR-7表达可抑制结肠癌细胞的增殖、侵袭和转移,可减少PI3K、p-Akt的表达,miR-7可能通过抑制PI3K/AKT通路抑制肿瘤的发生和发展,但可能还存在多个信号通路与结直肠癌进展有关。miR-7本身也受细胞内复杂机制的调控,其表达量变化及其对肿瘤的调控机制可为肿瘤的诊治提供新思路,具有良好的临床应用前景。miR-7可能是CRC诊断治疗的一个新靶点。
作者贡献
马 利:实验操作,论文撰写 熊兵红 :实验设计,论文撰写以及修改 黄 卫:实验操作,论文撰写 罗华友:论文指导及修改 王昆华:论文指导及修改
| [1] | Dai Z, Zheng RS, Zou XN, et al. Analysis and prediction of colorectal cancer incidence trend in China[J]. Zhonghua Yu Fang Yi Xue Za Zhi, 2012, 46(7): 598–603. |
| [2] | Ferlay J, Shin HR, Bray F, et al. Estimates of worldwide burden of cancer in 2008:GLOBOCAN 2008[J]. Int J Cancer, 2010, 127(12): 2893–917. |
| [3] | Yang S, Sun Z, Zhou Q, et al. MicroRNAs, long noncoding RNAs, and circular RNAs:potential tumor biomarkers and targets for colorectal cancer[J]. Cancer Manag Res, 2018, 10: 2249–57. DOI:10.2147/CMAR |
| [4] | To KK, Tong CW, Wu M, et al. MicroRNAs in the prognosis and therapy of colorectal cancer:From bench to bedside[J]. World J Gastroenterol, 2018, 24(27): 2949–73. DOI:10.3748/wjg.v24.i27.2949 |
| [5] | Horsham JL, Ganda C, Kalinowski FC, et al. MicroRNA-7:A miRNA with expanding roles in development and disease[J]. Int J Biochem Cell Biol, 2015, 69: 215–24. DOI:10.1016/j.biocel.2015.11.001 |
| [6] | Webster RJ, Giles KM, Price KJ, et al. Regulation of epidermal growth factor receptor signaling in human cancer cells by microRNA-7[J]. J Biol Chem, 2009, 284(9): 5731–41. DOI:10.1074/jbc.M804280200 |
| [7] | Cao Q, Mao ZD, Shi YJ, et al. MicroRNA-7 inhibits cell proliferation, migration and invasion in human non-small cell lung cancer cells by targeting FAK through ERK/MAPK signaling pathway[J]. Oncotarget, 2016, 7(47): 77468–81. |
| [8] | Reddy SD, Ohshiro K, Rayala SK, et al. MicroRNA-7, a homeobox D10 target, inhibits p21-activated kinase 1 and regulates its functions[J]. Cancer Res, 2008, 68(20): 8195–200. DOI:10.1158/0008-5472.CAN-08-2103 |
| [9] | Yue K, Wang X, Wu Y, et al. microRNA-7 regulates cell growth, migration and invasion via direct targeting of PAK1 in thyroid cancer[J]. Mol Med Rep, 2016, 14(3): 2127–34. DOI:10.3892/mmr.2016.5477 |
| [10] | Xu K, Chen Z, Qin C, et al. miR-7 inhibits colorectal cancer cell proliferation and induces apoptosis by targeting XRCC2[J]. Oncol Targets Ther, 2014, 7: 325–32. |
| [11] | Liu S, Zhang P, Chen Z, et al. MicroRNA-7 downregulates XIAP expression to suppress cell growth and promote apoptosis in cervical cancer cells[J]. FEBS Lett, 2013, 587(14): 2247–53. DOI:10.1016/j.febslet.2013.05.054 |
| [12] | Xiong S, Zheng Y, Jiang P, et al. MicroRNA-7 inhibits the growth of human non-small cell lung cancer A549 cells through targeting BCL-2[J]. Int J Biol Sci, 2011, 7(6): 805–14. DOI:10.7150/ijbs.7.805 |
| [13] | Wang B, Sun F, Dong N, et al. MicroRNA-7 directly targets insulin-like growth factor 1 receptor to inhibit cellular growth and glucose metabolism in gliomas[J]. Diagn Pathol, 2014, 9: 211. DOI:10.1186/s13000-014-0211-y |
| [14] | Li Y, Li Y, Liu Y, et al. PAX6, a novel target of microRNA-7, promotes cellular proliferation and invasion in human colorectal cancer cells[J]. Dig Dis Sci, 2014, 59(3): 598–606. DOI:10.1007/s10620-013-2929-x |
| [15] | Fang Y, Xue JL, Shen Q, et al. MicroRNA-7 inhibits tumor growth and metastasis by targeting the phosphoinositide 3-kinase/Akt pathway in hepatocellular carcinoma[J]. Hepatology, 2012, 55(6): 1852–62. DOI:10.1002/hep.25576 |
| [16] | 徐瑶, 欧阳学农, 陈曦, 等. miR-7抑制喉鳞癌Hep-2细胞增殖及迁移的研究[J]. 临床肿瘤学杂志, 2015, 12(3): 193–7. [ Xu Y, Ouyang XN, Chen X, et al. Inhibition effect of miR-7 on proliferation and metastasis of Hep-2 laryngeal carcinoma cells[J]. Lin Chuang Zhong Liu Xue Za Zhi, 2015, 12(3): 193–7. ] |
| [17] | 刘晓智, 苏治国, 姜忠敏, 等. 叶酸/聚酰胺-胺介导miR-7治疗小鼠胶质瘤[J]. 中华肿瘤杂志, 2012, 34(5): 325–30. [ Liu XZ, Su ZG, Jiang ZM, et al. Inhibitory effect of folic acid/polyamide-amine as a miR-7 vector on the growth of glioma in mice[J]. Zhonghua Zhong Liu Za Zhi, 2012, 34(5): 325–30. DOI:10.3760/cma.j.issn.0253-3766.2012.05.002 ] |
| [18] | 刘亮洪, 张洪云, 刘晓智, 等. 脑胶质瘤中miR-7与EGFR/PI3K信号通路相关基因蛋白表达的关系[J]. 山东医药, 2014, 54(27): 1–3. [ Liu LH, Zhang HY, Liu XZ, et al. Correlation between miR-7 and expression of EGFR/PI3K signal pathway related protein in glioma[J]. Shandong Yi Yao, 2014, 54(27): 1–3. DOI:10.3969/j.issn.1002-266X.2014.27.001 ] |
| [19] | Yu Z, Ni L, Chen D, et al. Identification of miR-7 as an oncogene in renal cell carcinoma[J]. J Mol Histol, 2013, 44(6): 669–77. DOI:10.1007/s10735-013-9516-5 |
 2019, Vol. 46
2019, Vol. 46


