文章信息
- SCD1抑制剂对乳腺癌细胞增殖凋亡的影响及其机制
- Effect of SCD1 Inhibitor on Proliferation and Apoptosis of Breast Cancer Cells and Related Mechanism
- 肿瘤防治研究, 2018, 45(12): 943-948
- Cancer Research on Prevention and Treatment, 2018, 45(12): 943-948
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2018.18.0707
- 收稿日期: 2018-05-31
- 修回日期: 2018-07-24
2. 050051 石家庄,河北省人民医院整形外科;
3. 050051 石家庄,河北省人民医院临床医学研究中心,河北省老年医学重点实验室;
4. 050200 石家庄,河北中医学院基础医学院
2. Department of Plastic Surgery, Hebei General Hospital, Shijiazhuang 050051, China;
3. The Clinical Trial Center, Hebei Provincial Key Laboratory of Geriatrics, Hebei General Hospital, Shijiazhuang 050051, China;
4. Department of Basic Medicine, Hebei University of Chinese Medicine, Shijiazhuang 050200, China
乳腺癌是女性最常见的恶性肿瘤之一,是全球女性癌症相关死亡的主要原因[1],因此,探索乳腺癌的防治措施至关重要。脂肪酸(fatty acid, FA)合成增强是肿瘤细胞的一个标志性的代谢改变。肿瘤细胞持续分裂增殖需要新合成大量细胞膜,而FA是合成膜磷脂的基本原料砌块,并能为肿瘤细胞提供能量支持,还用于合成一系列促癌脂质信号分子,FA在肿瘤的发生发展过程中起重要作用[2-3]。硬脂酰辅酶A去饱和酶1(stearoyl-CoA desaturase 1, SCD1)是催化饱和脂肪酸(SFA)转化为单不饱和脂肪酸(MUFA)的关键酶,是FA合成途径中最终步骤的限速酶。近年来,在肺癌、结肠癌、肾癌等多种肿瘤组织中,都发现SCD1表达水平升高[4-5]。本研究通过检测SCD1在乳腺癌组织中的表达情况,并应用SCD1特异性的小分子抑制剂——MF-438干预乳腺癌细胞,分析抑制SCD1的功能对乳腺癌细胞增殖凋亡的影响,并初步探讨其可能机制,为SCD1作为乳腺癌治疗的新靶标提供依据。
1 材料与方法 1.1 主要试剂SCD1抑制剂MF-438购自德国Merck Millipore公司;DMSO购自北京Solarbio公司;CellTiter 96 AQueous One Solution Cell Proliferation Assay(MTS)试剂盒购自美国Promega公司;Hoechst NO.33342试剂盒购自北京Coolaber公司;Propidium iodide staining(PI)购自美国Sigma公司;SCD1、Bcl-2、Bax小鼠单克隆抗体均购自美国Santa Cruz Biotechnology公司;β-actin小鼠单克隆抗体购自美国Signalway Antibody公司;辣根酶标记山羊抗小鼠IgG抗体购自北京康为世纪生物科技有限公司;SABC免疫组织化学试剂盒、DAB显示剂均购自北京中杉金桥生物技术有限公司。
1.2 乳腺癌细胞和组织来源人乳腺癌MCF-7细胞株和健康者皮肤成纤维细胞(HSF细胞)为河北省人民医院临床医学研究中心保存。乳腺癌组织由河北省人民医院伦理委员会批准,患者知情同意后,收集2010年1月—2013年12月65例河北省人民医院乳腺癌手术切除的病理标本,另收集37例癌旁正常乳腺组织作对照。所有标本均经常规石蜡包埋切片及组织病理学检查证实。患者术前均未接受过放疗或化疗等新辅助治疗。
1.3 组织微阵列的构建[6]应用组织包埋仪向包埋模中注入蜡液,冷却凝固后在蜡模上挖取组织芯槽。根据HE切片选取富含肿瘤细胞的代表性区域,在相应的石蜡包埋乳腺癌组织块表面上标记。用组织芯穿刺针从所选区域取出直径1.8 mm的组织芯样品。将组织芯柱依次放入组织芯槽中,向芯槽中注入蜡液填满未布组织芯的区域,冷却凝固既得组织芯阵列石蜡包埋块。4 μm厚连续切片,裱片、烤片、冷却后保存于4℃冰箱中。
1.4 免疫组织化学染色采用免疫组织化学SP法染色,操作步骤严格按试剂盒说明书进行。SCD1抗体的稀释比例为1:100,DAB显色,苏木精对比染色。以PBS代替一抗作为阴性对照,以SCD1已知阳性的切片作为阳性对照。
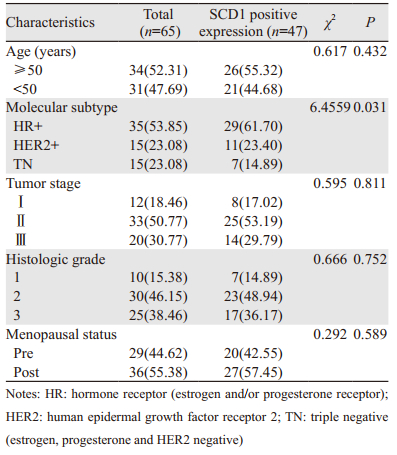
结果判定:SCD1表达阳性细胞的标准是细胞质内染成棕色颗粒,阳性细胞数0~5%为(-),阳性细胞数 > 5%~25%为(+),阳性细胞数 > 25%~50%为(++),阳性细胞数 > 50%为(+++)。将(-)定为表达阴性,将(+~+++)例数相加作为阳性例数。
1.5 MTS法检测SCD1抑制剂对细胞增殖的影响将MCF-7细胞接种于96孔板,8 000个或1×104个/孔,分别用含10%或2%FBS的RPMI1640培养基培养24 h,用不同浓度MF-438或对照DMSO干预细胞48 h,使用MTS法,加入20微升/孔CellTiter 96® AQueous One Solution Reagent,在37℃、5%CO2的培养箱中孵育1 h,使用酶标仪检测490 nm的吸光度值测定细胞活性,并计算IC50值。
1.6 细胞凋亡分析 1.6.1 Hoechst33342染色荧光显微镜观察细胞形态应用2%FBS的RPMI1640培养基培养MCF-7细胞24 h,加入5 μmol/L MF-438或对照DMSO作用48 h,弃培养基,加入荧光染料Hoechst33342,37℃避光染色20 min。荧光显微镜观察并摄像,细胞核呈浓缩或碎片状的细胞为凋亡细胞。在荧光显微镜下随机选取5个视野观察细胞凋亡情况,根据公式计算凋亡指数。凋亡指数=凋亡细胞数/总细胞数×100%。
1.6.2 细胞凋亡率检测应用2%FBS的RPMI1640培养MCF-7细胞24 h,加入5 μmol/L MF-438或对照DMSO作用48 h后,0.25%胰酶消化贴壁细胞,与悬浮细胞一起收集,细胞数目约(1~5)×106个每毫升,离心弃PBS,加入4℃预冷的70%的乙醇固定1~2 h,离心弃固定液,PBS重悬,400目筛网过滤,离心弃PBS,加入1 ml PI染液(100 μg/ml),4℃避光染色30 min,流式细胞仪检测细胞凋亡情况,亚G0/G1峰为凋亡细胞峰,进行细胞凋亡率分析。
1.7 蛋白质印迹法检测凋亡相关蛋白的表达MCF-7细胞经5 μmol/L MF-438或对照DMSO作用48 h,用细胞裂解液提取总蛋白,进行SDS-PAGE电泳分离蛋白,并将凝胶上的目的蛋白转移至PVDF膜上,用5%脱脂奶粉的TBST液封闭PVDF膜2 h,分别加入一抗Bcl-2、Bax和β-actin 4℃摇床孵育过夜,加入二抗,室温反应2 h;将发光液均匀地滴在PVDF膜的蛋白面上,出现明显荧光条带后,依次压片、曝光、显影和定影。将X线胶片于凝胶成像系统照像,Image J v1.8软件进行分析。结果用目的蛋白条带的IOD值与β-actin条带的IOD值的比值表示。
1.8 统计学方法所有数据均应用SPSS 19.0软件进行分析,数据结果以(x±s)表示,应用χ2检验和单因素方差分析进行组间比较,P < 0.05为差异有统计学意义。
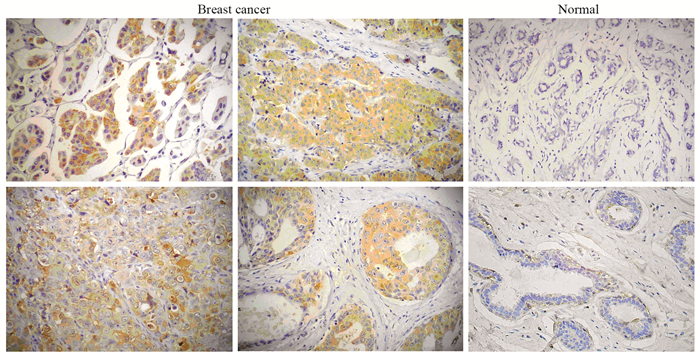
2 结果 2.1 SCD1在乳腺癌及癌旁正常组织中的表达免疫组织化学检测结果显示,SCD1表现出弥漫性胞质染色,SCD1在绝大多数乳腺癌组织标本中为中-高度表达,而在癌周正常乳腺组织中表达较低或不表达,见图 1。SCD1在乳腺癌组织中阳性表达率(72.30%, 47/65)显著高于正常乳腺组织(18.92%, 7/37),差异有统计学意义(χ2=26.976, P=0.000)。SCD1在不同分子亚型的乳腺癌中的表达差异有统计学意义(P=0.031),激素受体阳性(HR+)或HER2+乳腺癌的SCD1表达水平高于三阴性(triple negative, TN)乳腺癌。SCD1的表达与患者年龄、月经状态、肿瘤临床分期和组织分级均无相关性(P > 0.05),见表 1。
|
| Immunohistochemical results evidenced that SCD1 was highly expressed in a large number of human breast cancer samples. Representative photomicrographs of positively-stained tissues were from breast cancer specimens as well as the adjacent normal breast tissues 图 1 SCD1在乳腺癌及正常乳腺组织中的表达(×200, 比例尺: 50 μm) Figure 1 Expression of SCD1 in human breast cancer and normal breast tissues (×200, scale bar: 50 μm) |
|
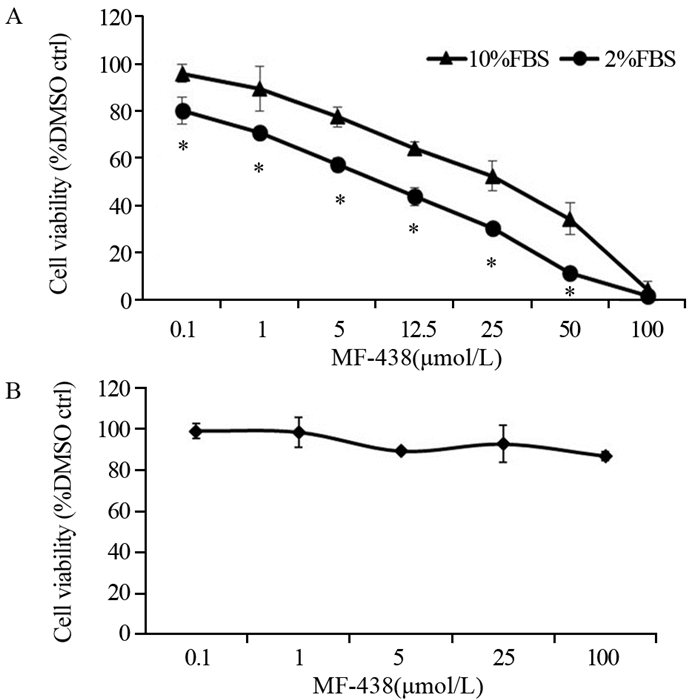
MTS法检测MF-438作用的剂量-效应曲线结果显示,不论是在10%还是2%FBS条件下,与DMSO对照组相比,MF-438在0.1~100 μmol/L浓度范围内作用48 h后,均对MCF-7细胞显示出显著的剂量依赖性增殖抑制作用,即MCF-7细胞增殖活性随MF-438浓度增加而降低,并呈一定的剂量依赖性,见图 2。2%FBS培养时,MF-438在除100 μmol/L以外各浓度作用下的细胞存活率均较10%FBS组降低(P < 0.05)。在10%FBS条件下,MF-438作用的IC50值测定为(18.6±0.35)μmol/L,在2%FBS条件下,IC50为(3.9±0.45)μmol/L。而单纯降低血清浓度(2%FBS)培养时,MCF-7细胞的增殖活性仅有轻微下降。这表明,在低血清浓度中生长的MCF-7细胞对SCD1抑制剂的生长抑制作用更为敏感。在10%FBS条件下,MF-438并未对正常HSF细胞产生明显的生长抑制作用,见图 3。
|
| *: P < 0.05, compared with 10%FBS 图 2 SCD1抑制剂对乳腺癌MCF-7(A)和人成纤维细胞HSF细胞(B)增殖的影响 Figure 2 Effect of SCD1 inhibitor on proliferation of MCF-7 cells(A) and normal human fibroblasts HSF cells(B) |
|
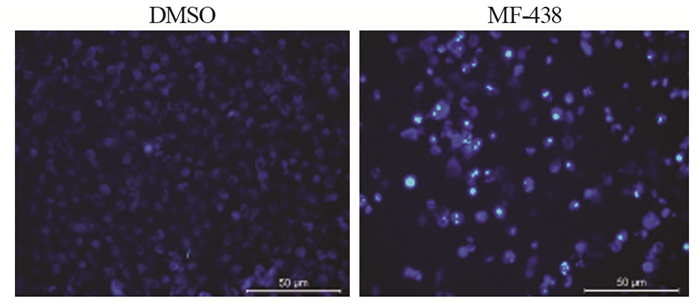
| 图 3 SCD1抑制剂诱导MCF-7细胞凋亡的形态学改变(×200, 比例尺: 50 μm) Figure 3 Morphological change of MCF-7 cells apoptosis induced by SCD1 inhibitor (×200, scale bar: 50 μm) |
荧光显微镜下DMSO干预的对照组MCF-7细胞的核质密度均匀一致,呈弥散均匀的蓝色荧光。而5 μmol/L MF-438作用48 h后,表现出典型的细胞凋亡特征性变化。凋亡细胞荧光增强,与周围细胞脱离接触,细胞全面皱缩变小;胞膜向内皱缩,胞质浓缩;胞核固缩并碎裂,呈大小不等的形似块状、圆形或花瓣状的细胞碎片,凋亡小体形成,也可见染色质浓缩边缘化,而呈新月形蓝色荧光,见图 3。与对照组(5.2±0.05)比较,MCF-7细胞经5 μmol/L MF-438作用后(23.7±0.10),凋亡指数均显著升高(F=13.497, P=0.006)。
2.3.2 SCD1抑制剂作用于MCF-7细胞凋亡率分析5 μmol/L MF-438作用48 h后,MCF-7细胞的凋亡率明显增高(MF-438(4.78±0.22)% vs.对照(0.54±0.12)%, F=828.007, P=0.000),差异有统计学意义。结果表明,SCD1抑制剂促进肿瘤细胞凋亡,见图 4。
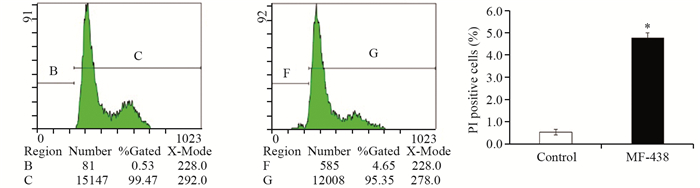
|
| Cell apoptosis was analyzed by flow cytometry after PI staining; *: P < 0.05, compared with the control group; Data represented the x±s from three independent experiments 图 4 SCD1抑制剂对MCF-7细胞凋亡的影响 Figure 4 Effect of SCD1 inhibitor on apoptosis of MCF-7 cells |
5 μmol/L SCD1抑制剂MF-438作用MCF-7细胞48 h后,与DMSO对照组相比,抑凋亡蛋白Bcl-2的表达水平显著低于对照组,降低约28%,差异有统计学意义(F=24.247, P=0.008);而促凋亡蛋白Bax的表达水平显著高于对照组,增加约36%,差异有统计学意义(F=25.012, P=0.007),见图 5。
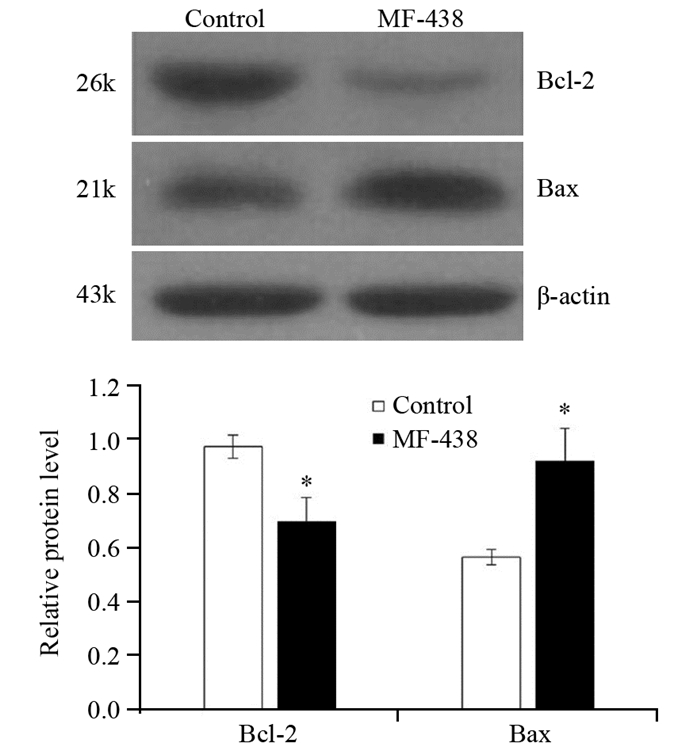
|
| *: P < 0.05, compared with control group 图 5 SCD1抑制剂对MCF-7细胞中Bcl-2及Bax蛋白表达的影响 Figure 5 Effect of SCD1 inhibitor on expressions of Bcl-2 and Bax proteins in MCF-7 cells |
流行病学研究表明,肥胖与乳腺癌的发生发展密切相关,不仅是乳腺癌的危险因素,还与不良预后相关[7-8]。乳腺癌的发生发展还与机体脂代谢密切相关。新细胞膜的形成是细胞生长和增殖的必要条件,脂质双分子层是构成细胞膜的基本支架。MUFA是生物膜结构的主要成分,通过酰化作用生成以磷脂质为主的膜脂质,MUFA在肿瘤细胞的膜结构和功能中发挥着重要作用。SCD1是Δ9脂肪酸去饱和酶,是催化SFA转化为MUFA的关键酶[9]。近年来研究显示,在脂肪肝、糖尿病、肥胖和某些肿瘤患者中均发现SCD1表达水平异常升高,SCD1与脂代谢紊乱有着密切的联系,可能是多种疾病发生发展的枢纽[2, 5, 10]。本研究结果也显示,SCD1在乳腺癌组织中高表达,而在正常乳腺组织中低表达或不表达,差异有统计学意义。本研究中,我们还发现SCD1在HR+和HER2+乳腺癌亚型中的表达高于TN乳腺癌。然而有报道显示雌激素负调节SCD1的表达[11],这似乎与本研究结果矛盾。因本研究样本量较少,需要扩大样本量进一步研究证实不同乳腺癌亚型中SCD1表达的差异。
本研究结果显示,MF-438对MCF-7细胞显示出显著的剂量依赖性的增殖抑制作用,并且在低血清浓度培养条件下的MCF-7细胞对SCD1抑制剂的生长抑制作用更为敏感,然而SCD1抑制未对正常HSF细胞产生明显的生长抑制作用。此外,在结肠癌和肺癌的体外实验中也观察到了抑制SCD1能产生抗肿瘤作用[5, 10]。
在肿瘤的发生发展过程中,除了细胞的异常增殖,更重要的是细胞凋亡能力的降低。本研究进一步从细胞凋亡方面分析SCD1抑制剂对MCF-7细胞增殖的抑制作用。结果显示,在SCD1抑制剂的作用下,MCF-7细胞表现出了典型的细胞凋亡特征性改变,并且MF-438干预组凋亡指数及凋亡率明显高于对照组(P < 0.05)。
Bcl-2和Bax分别是Bcl-2家族中最主要的抑制凋亡和促进凋亡蛋白,两者在肿瘤细胞凋亡信号通路中发挥重要的调控作用[12-17]。因此,本研究进一步检测了Bcl-2和Bax的表达情况,结果显示,抑制乳腺癌MCF-7细胞的SCD1活性能显著降低抑凋亡蛋白Bcl-2的表达,同时明显增加促凋亡蛋白Bax的表达水平,这可能是SCD1抑制剂诱导MCF-7细胞凋亡的分子机制之一。
总之,本研究证实了SCD1在乳腺癌组织中高表达。抑制SCD1的活性能显著抑制乳腺癌MCF-7细胞增殖并诱导细胞凋亡。SCD1抑制剂可能通过降低抑凋亡蛋白Bcl-2的表达并增加促凋亡蛋白Bax的表达,实现其抑制肿瘤细胞增殖促进凋亡的作用。上述结果提示SCD1在乳腺癌的发生发展中发挥着重要作用,对SCD1的深入研究将有望为乳腺癌的分子靶向治疗提供一个新的靶标。
| [1] | Ferlay J, Soerjomataram I, Dikshit R, et al. Cancer incidence and mortality worldwide: sources, methods and major patterns in GLOBOCAN 2012[J]. Int J Cancer, 2015, 136(5): E359–86. DOI:10.1002/ijc.29210 |
| [2] | 赵静, 支政, 宋光耀. 脂肪酸代谢与肿瘤靶向治疗新途径[J]. 肿瘤, 2014, 34(9): 868–74. [ Zhao J, Zhi Z, Song GY. Fatty acid metabolism and novel targeted therapy of cancer[J]. Zhong Liu, 2014, 34(9): 868–74. ] |
| [3] | 梁颖莉, 熊威斌, 李余发, 等. 肿瘤细胞中HER2与脂肪酸合酶的关系[J]. 肿瘤防治研究, 2015, 42(6): 614–7. [ Liang YL, Xiong WB, Li YF, et al. Review on Relationship Between HER2 and Fatty Acid Synthase in Tumor Cells[J]. Zhong Liu Fang Zhi Yan Jiu, 2015, 42(6): 614–7. DOI:10.3971/j.issn.1000-8578.2015.06.018 ] |
| [4] | von Roemeling CA, Marlow LA, Wei JJ, et al. Stearoyl-CoA desaturase 1 is a novel molecular therapeutic target for clear cell renal cell carcinoma[J]. Clin Cancer Res, 2013, 19(9): 2368–80. DOI:10.1158/1078-0432.CCR-12-3249 |
| [5] | Noto A, Raffa S, De Vitis C, et al. Stearoyl-CoA desaturase-1 is a key factor for lung cancer-initiating cells[J]. Cell Death Dis, 2013, 4: e947. DOI:10.1038/cddis.2013.444 |
| [6] | 赵静, 徐明堂, 赵焕芬, 等. 高密度组织芯片简易制作方法及体会[J]. 河北医科大学学报, 2015, 36(9): 1090–3. [ Zhao J, Xu MT, Zhao HF, et al. The simple production method and experiences of high-density tissue microarray[J]. Hebei Yi Ke Da Xue Xue Bao, 2015, 36(9): 1090–3. DOI:10.3969/j.issn.1007-3205.2015.09.030 ] |
| [7] | Jain R, Strickler HD, Fine E, et al. Clinical studies examining the impact of obesity on breast cancer risk and prognosis[J]. J Mammary Gland Biol Neoplasia, 2013, 18(3-4): 257–66. DOI:10.1007/s10911-013-9307-3 |
| [8] | Chajès V, Assi N, Biessy C, et al. A prospective evaluation of plasma phospholipid fatty acids and breast cancer risk in the EPIC study[J]. Ann Oncol, 2017, 28(11): 2836–42. DOI:10.1093/annonc/mdx482 |
| [9] | Iwai T, Kume S, Chin-Kanasaki M, et al. Stearoyl-CoA Desaturase-1 Protects Cells against Lipotoxicity-Mediated Apoptosis in Proximal Tubular Cells[J]. Int J Mol Sci, 2016, 17(11): pii: E1868. DOI:10.3390/ijms17111868 |
| [10] | Mason P, Liang B, Li L, et al. SCD1 inhibition causes cancer cell death by depleting mono-unsaturated fatty acids[J]. PLoS One, 2012, 7(3): e33823. DOI:10.1371/journal.pone.0033823 |
| [11] | Bryzgalova G, Lundholm L, Portwood N, et al. Mechanisms of antidiabetogenic and body weight-lowering effects of estrogen in high-fat diet-fed mice[J]. Am J Physiol Endocrinol Metab, 2008, 295(4): E904–912. DOI:10.1152/ajpendo.90248.2008 |
| [12] | Banuelos J, Shin S, Cao Y, et al. BCL-2 protects human and mouse Th17 cells from glucocorticoid-induced apoptosis[J]. Allergy, 2016, 71(5): 640–50. DOI:10.1111/all.12840 |
| [13] | Reyna DE, Garner TP, Lopez A, et al. Direct Activation of BAX by BTSA1 Overcomes Apoptosis Resistance in Acute Myeloid Leukemia[J]. Cancer Cell, 2017, 32(4): 490–505. DOI:10.1016/j.ccell.2017.09.001 |
| [14] | Pritz JR, Wachter F, Lee S, et al. Allosteric sensitization of proapoptotic BAX[J]. Nat Chem Biol, 2017, 13(9): 961–7. DOI:10.1038/nchembio.2433 |
| [15] | Mirakhor Samani S, Ezazi Bojnordi T, Zarghampour M, et al. Expression of p53, Bcl-2 and Bax in endometrial carcinoma, endometrial hyperplasia and normal endometrium: a histopathological study[J]. J Obstet Gynaecol, 2018: 1–6. |
| [16] | Andreu-Fernández V, Sancho M, Genovés A, et al. Bax transmembrane domain interacts with prosurvival Bcl-2 proteins in biological membranes[J]. Proc Natl Acad Sci U S A, 2016, 114(2): 310–5. |
| [17] | Azimian H, Dayyani M, Toossi MTB, et al. Bax/Bcl-2 expression ratio in prediction of response to breast cancer radiotherapy[J]. Iran J Basic Med Sci, 2018, 21(3): 325–32. |
 2018, Vol. 45
2018, Vol. 45


