文章信息
- 新型免疫检查点—恶性肿瘤免疫治疗研究进展
- New Immune Checkpoint: Advances in Immunotherapy for Malignant Tumors
- 肿瘤防治研究, 2018, 45(12): 1027-1035
- Cancer Research on Prevention and Treatment, 2018, 45(12): 1027-1035
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2018.18.0545
- 收稿日期: 2018-04-23
- 修回日期: 2018-06-14
随着免疫靶向药物在包括恶性黑色素瘤、肺癌、结直肠癌等实体瘤中的临床应用,肿瘤免疫治疗已进入一个崭新的时代。作用于免疫检查点CTLA-4和PD-1/PD-L1的部分药物在多种肿瘤中均有优异的表现,并且适应证不断扩展,从晚期患者的后线治疗到一线治疗[1],再到局部晚期患者放化疗后的治疗。虽然CTLA-4和PD-1/PD-L1抗体取得了重大突破,但单药有效率仍仅为20%左右,且获益人群有限,临床获益仍无法令人满意。而疗效有限的主要原因在于免疫信号通路错综复杂,肿瘤微环境中的免疫细胞、细胞因子、免疫佐剂等参与其中并相互影响,导致只针对一种靶点的药物作用有限。因此,研发针对肿瘤免疫过程中不同环节、不同机制的药物对于提高免疫治疗的疗效至关重要。目前已知仅在T细胞表面就表达了多达29种免疫球蛋白超家族和26种肿瘤坏死因子受体超家族共信号分子受体[2],并已经有相关免疫靶点及其相关药物的临床前或临床研究,本文将从特异性免疫和非特异性免疫两方面对最有临床应用前景的新型免疫靶点进行综述。
1 特异性免疫 1.1 抑制性免疫检查点分子 1.1.1 TIM-3TIM-3是由301个氨基酸组成的Ⅰ型膜蛋白,分别表达在辅助性T细胞、调节性T细胞及非特异性免疫细胞中,半乳糖凝集素9是TIM-3的主要配体,它与TIM-3特异性结合后,可产生一种负性信号,从而引发T细胞的程序性死亡。非小细胞肺癌的动物模型显示,当应用PD-1类药物治疗耐药后,肿瘤组织的TIM-3表达水平明显升高,但正常淋巴结或脾脏中并没有出现这种情况[3],这也就给抗TIM-3治疗可以改善抗PD-1治疗后耐药提供了理论基础。小鼠模型提示单独应用抗-TIM-3治疗疗效甚微,而联合应用抗-TIM-3和抗PD-1治疗可以显著抑制肿瘤的生长[4]。
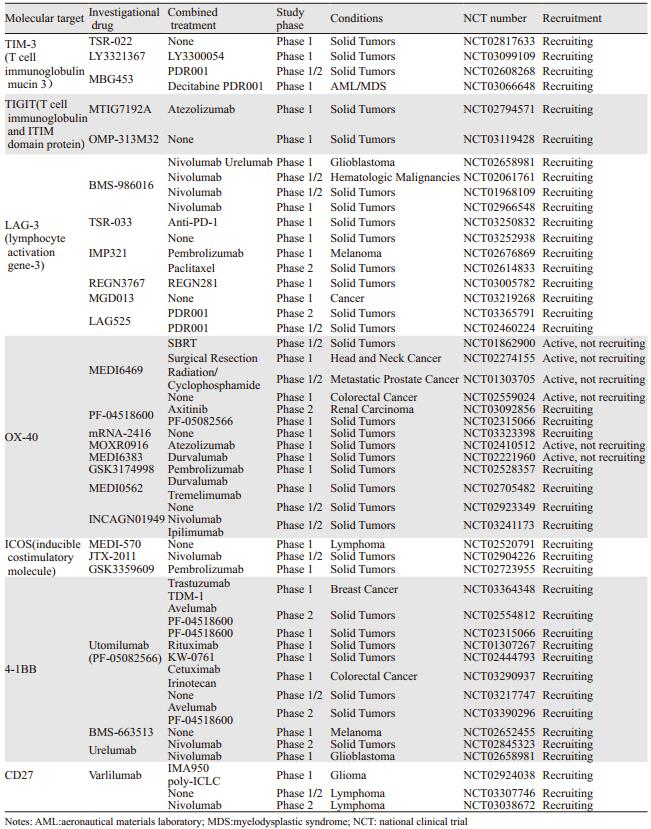
Zong等在恶性黑色素瘤、肺癌、胃癌等患者的肿瘤浸润性淋巴细胞中检测到TIM-3的高表达,并且他们也发现,效应T细胞的枯竭和功能障碍通常与TIM-3和PD-1共表达相关[5]。目前针对TIM-3靶点的临床研究为Ⅰ/Ⅱ期研究,正在验证药物的安全性及有效性,且多数临床研究均合用其他药物,见表 1,我们期待最终的研究结果。
1.1.2 TIGIT(T cell immunoglobulin and ITIM domain protein)TIGIT是一种Ⅰ型跨膜蛋白,由免疫球蛋白可变区(IgV)样结构域、跨膜区和免疫受体酪氨酸抑制序列(immunoreceptor tyrosine-based inhibitory motif, ITIM)共同组成,主要表达在活化T细胞、调节T细胞、记忆T细胞和NK细胞,它与CD226、CD96、CD112、CD155和其他相关的蛋白均属于免疫球蛋白超家族(immunoglobulin superfamily, IgSF)。这些蛋白之间相互作用,影响NK细胞及T细胞的免疫活性,其中CD155和CD112是表达在抗原递呈细胞上(antigen presenting cells, APCs)的两个主要配体。TIGIT和其他免疫检查点共同参与机体的免疫调节过程,同时阻断TIGIT和PD-1信号通路可以使肿瘤特异性的CD8+T细胞表达IFN-γ和TNF-α的水平升高。恶性黑色素瘤小鼠模型显示,敲除TIGIT基因后肿瘤生长速度减慢,小鼠生存时间明显延长[6]。在人体中,Chauvin等也发现了多种免疫检查点共存的现象,在恶性黑色素瘤患者中,TIGIT通常与PD-1和TIM-3共表达[7],肺癌患者中也发现了TIGIT与LAG-3、TIM-3和PD-1等抑制性受体共存的现象,它们共同参与机体的免疫识别,并且与患者的生存期密切相关[8]。基于以上理论依据,目前有两项Ⅰ期的临床研究正在进行,见表 1。
LAG-3是免疫球蛋白超家族的一员,表达在活化的T细胞表面,与CD4同源,并且与主要组织相容性复合体(main histocompatibility complex, MHC)Ⅱ有很高的亲和力。它的表达增多可以使调节T细胞(regulatory T cell, Tregs)活性减弱,使CD8+ T细胞增殖活性降低、细胞因子的产生减少。小鼠模型也显示,应用抗体阻断LAG-3,可以增强T细胞的增殖活性,肿瘤明显缩小,并且LAG-3也常与其他抑制性免疫检查点共表达,同时阻断CD8+T细胞表面的LAG-3和PD-1,可以使细胞的免疫功能恢复,并且同时阻断这两个位点,较单纯阻断任何一个位点抗肿瘤活性均有增强[9]。这就提示临床,也许合用这两种药物治疗效果会更好。
Tassi等在肺癌、乳腺癌等实体瘤患者中也观察到,如存在LAG-3+的肿瘤浸润淋巴细胞(tumor infiltrating lymphocytes, TILs),那么该患者的临床进展迅速,肿瘤的侵袭性更强[10]。一项Ⅰ期临床研究选取的药物是IMP321(NCT00349934),纳入需一线治疗的转移性乳腺癌患者,应用紫杉醇联合不同剂量IMP321的给药方案,30例患者中仅有3例患者在6月内进展,肿瘤的客观缓解率达到50%,明显高于既往25%的研究结果[11]。目前抗LAG-3药物的临床研究正在进行,见表 1,期望结果的揭示。
1.1.4 VISTAVISTA又叫PD-1H、DD1α,是近年发现的免疫调节蛋白,主要表达在淋巴器官及骨髓细胞上,结构与PD-L1类似。研究显示,当APCs表达VISTA时,显示出了对CD4+和CD8+T细胞的抑制作用,而当阻断这个通路时,T细胞介导的免疫功能逐渐增强,这也就验证了VISTA可作为一个负向调节的检查点而抑制T细胞的应答。而在T细胞中,VISTA与PD-1的抑制作用是相互独立的,小鼠模型也验证了同时应用抗PD-1及抗VISTA药物可以抑制肿瘤生长并延长小鼠的生存时间[12]。
Böger等在46%的胃癌患者中发现了VISTA+的TILs,并且部分肿瘤细胞也可以表达VISTA,VISTA高表达的口腔鳞癌患者的生存时间明显缩短[13]。前列腺癌患者应用Ipilimumab治疗后,患者的VISTA+TILs及巨噬细胞水平显著上调,这也从另一方面验证了VISTA是可能的耐药原因之一[14]。因此,我们可以看到,VISTA、PD-1及CTLA-4的信号通路是相互独立的,可以通过单独阻断一种通路或是联合阻断多个通路来抑制肿瘤的生长。目前,无正在进行的临床研究,仅有一项抗VISTA抗体JNJ-61610588治疗实体瘤的临床研究(NCT02671955),并且已结束招募,期待结果的报道。
1.1.5 B和T淋巴细胞弱化子((B and T lymphocyte attenuator, BTLA)BTLA是免疫球蛋白超家族的一员,在T细胞、静止B细胞、巨噬细胞、树突状细胞和NK细胞均有表达,结构和功能与PD-1和CTLA-4相似,均表现为抑制信号,BTLA的配体是疱疹病毒入侵介质(herpes virus entry mediator, HVEM),当BTLA与HVEM结合后会产生抑制信号,从而抑制T细胞的活化。抗BTLA的治疗可以促使T细胞增殖,而BTLA敲除的小鼠显现出了较高的免疫活性。
在恶性黑色素瘤患者中,循环和转移淋巴结中的肿瘤特异性T细胞均表达BTLA,而在患者的肿瘤组织中也检测到了HVEM的表达,当BTLA与HVEM结合后,会导致T细胞的增殖受到抑制,因此应用抗BTLA抗体来逆转这个过程就可以治疗肿瘤[15]。晚期肺癌患者多合并恶性胸腔积液,而在患者的胸腔积液中发现BTLA的表达明显升高,从而可以推断BTLA与肺癌的发生发展密切相关。因此,BTLA作为免疫调节的抑制分子具有广泛的研究前景,目前针对BTLA及HVEM抑制剂的研究仍在临床前阶段,期待相关的药物尽快推出,并进入临床研究验证。
1.2 免疫共刺激分子 1.2.1 OX40OX40,又叫CD134,是肿瘤坏死因子受体超家族成员之一,在T细胞活化后的24~72 h表达。它的配体是OX40L,又叫CD252,主要在活化的APCs表面表达。OX40L和OX40结合后可以激活T细胞,并启动包括T细胞核因子在内的T细胞活化信号,并增强细胞周期蛋白A、Bcl-2凋亡分子、细胞因子和细胞因子受体等的表达。小鼠模型显示,兴奋OX40的特异性抗体可以使Tregs数目减少,从而维持效应T细胞的功能,并显示出了较高的抗肿瘤活性[16]。
针对此位点的临床研究较多,包括单药应用兴奋OX40的特异性抗体,或与化疗、放疗、手术、小分子靶向治疗、细胞因子或其他免疫检查点药物(抗-CD137、PD-1和CTLA-4抗体)联合应用。一项OX40激动剂MOXR0916的研究结果显示,单用或联合Atezolizumab,51名患者中有2名患者疗效为PR[17],更多的Ⅰ/Ⅱ期临床研究正在进行中,见表 1。但到底如何用药,是单独用药还是联合用药,与哪种药物联合应用,具体的方法及机制是怎样的,这些都是未来基础研究和临床试验亟需解决的问题。
1.2.2 诱导共刺激分子(inducible costimulatory molecule, ICOS)ICOS又叫CD278,是免疫球蛋白超家族成员之一,与CD28和CTLA-4同源,在活化T细胞表面表达,在调节T细胞的增殖和功能方面扮演着重要角色。ICOS的活化依赖于它的配体ICOS-L,ICOS-L主要表达在B细胞和APCs。也许因为既往CD28通路的研究大多疗效欠佳,人们对ICOS通路的研究也比较少,现在人们重新对ICOS燃起激情是因为它在肿瘤的免疫治疗中可以扮演标志物的角色,当恶性黑色素瘤患者接受Ipilimumab治疗时,ICOS+的CD4+T细胞的增多是药效学的标志物,可能与较好的疗效相关。小鼠模型发现,单独应用ICOS激动剂似乎很难引发免疫反应,激活ICOS同时应用抗CTLA-4药物存在协同作用,而ICOS基因敲除小鼠对抗CTLA-4治疗的反应较差[18]。同时应用ICOS激动剂和抗PD-1及抗CTLA-4治疗也可以增强抗肺癌效果[19],因此,ICOS通路对CTLA-4(也许还有其他免疫检查点)的治疗是否起效至关重要。目前针对ICOS通路的临床研究正在进行,但多数处在Ⅰ期研究,见表 1。
1.2.3 4-1BB4-1BB,又叫CD137,是肿瘤坏死因子受体家族的成员,表达在活化的CD4+和CD8+T细胞、树突状细胞、NK细胞和内皮细胞等细胞的表面,它的配体4-1BBL由活化的APCs表达。临床前研究显示,4-1BB激动性抗体可以促进CD4+及CD8+T细胞的增殖,并延长小鼠的生存。4-1BB在调节T细胞上的功能复杂,并且现有研究结果的结果自相矛盾。而4-1BB基因敲除的小鼠模型可以进展为自身免疫性疾病,提示它在免疫平衡方面起着重要的作用,并且可以协助免疫细胞进行肿瘤的特异性识别。
目前,有Urelumab和PF-05082566两种4-1BB特异性激动抗体的临床研究正在进行中,初步的结果支持4-1BB特异性抗体对T细胞和NK细胞的增殖和活性有促进作用[20]。除了单药治疗外,联合治疗的临床研究也正在进行,PF-05082566联合Pembrolizumab,纳入对单药PD-1治疗敏感的病种,包括非小细胞肺癌、肾癌等,23例患者中6例患者治疗疗效为CR+PR[21],提示联合治疗也许是以后的一个方向,目前正在进行中的关于4-1BB靶点的临床研究见表 1。
1.2.4 CD27CD27,不同于其他肿瘤坏死因子受体家族的成员,仅在淋巴细胞表面表达,包括幼稚和活化的CD4+和CD8+T细胞,它的配体是CD70,两者相结合可以使效应和记忆T细胞增殖分化,并增强B细胞和NK细胞的活化功能。小鼠模型提示,增强CD27信号通路可以抑制肿瘤的生长。并且人们发现,1/3霍奇金淋巴瘤和弥漫大B细胞淋巴瘤患者的CD27或CD70胚系缺失,大部分弥漫大B细胞淋巴瘤和伯基特淋巴瘤患者调控CD70的基因突变或缺失,这也进一步从侧面验证了CD27/CD70信号通路的抗肿瘤免疫作用[22]。
Varlilumab是一种人源化的CD27单克隆抗体,可以促进细胞因子的产生并激活T细胞,在晚期实体瘤患者中显示出了良好的耐受性并初步观察到较好的疗效。一项Ⅰ期研究总共纳入56例晚期实体瘤患者,仅1例1.0 mg/kg剂量组患者出现3级低钠血症,为剂量限制性毒性,未发现最大耐受剂量,虽然所有患者均出现治疗相关毒性,但多数为1~2级反应。1例晚期肾细胞癌患者疗效PR(肿瘤缩小78%),并且PR状态已持续2.3年,8例患者疾病稳定超过3月,这其中1例晚期肾细胞癌患者疾病稳定状态超过3.9年[23]。除了单药应用外,Varlilumab还与OX-40激动剂或抗PD-1药物联合应用进行抗肿瘤研究,见表 1。新药的不断出现为肿瘤的免疫治疗增添了一种新的可能,但这一药物到底抗肿瘤效果如何,还需要进一步研究来揭示。
2 非特异性免疫 2.1 KIRKIR是一类主要表达在部分NK细胞和T细胞表面的高基因多态性分子,分为多个亚型,其中KIR2DL1-3、KIR3DL1可通过结合MHC分子(HLA-C/HLA-B)发挥抑制作用。因高基因多态性的特点,多种KIR基因和它们的配体结合可引发包括自身免疫性疾病在内的多种疾病,尤其是部分KIR和特定的配体结合可以使肿瘤的患病风险增高。小鼠模型显示,针对活化NK细胞表面受体KIR2DS2的治疗显示出明显优于传统的共刺激分子的抗肿瘤作用[24]。
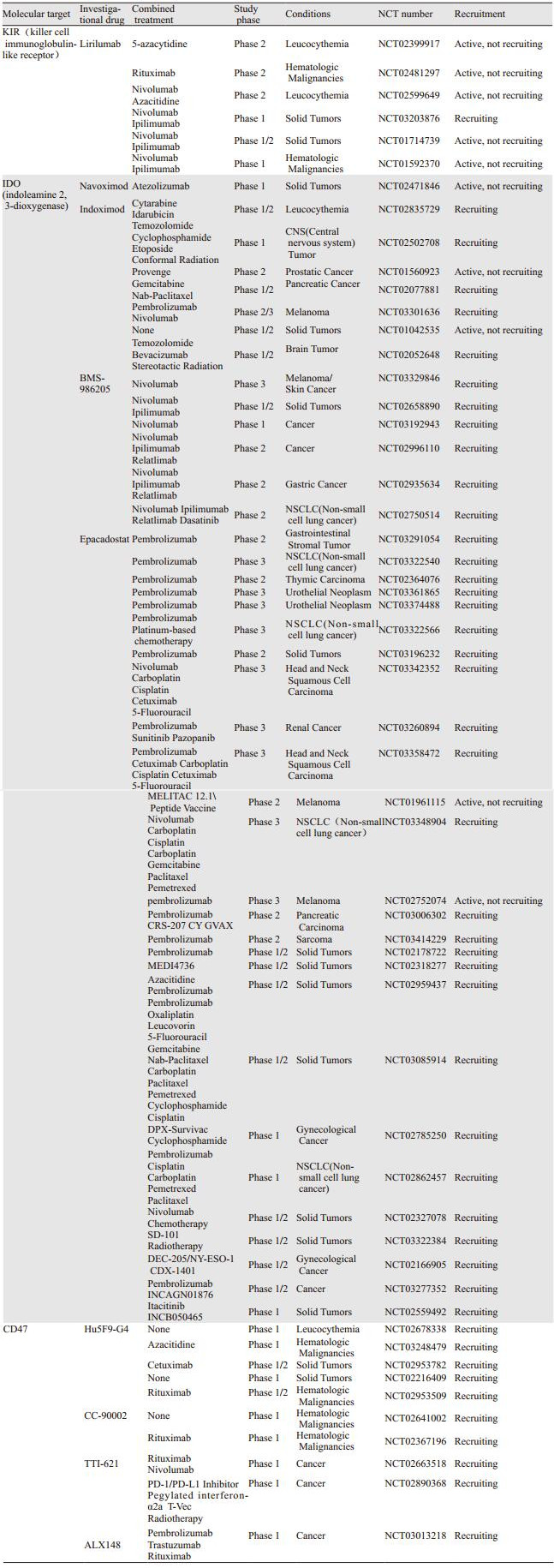
虽然临床前模型显示了较好的疗效,并且也观察到KIR基因的活化与结直肠癌和恶性胶质瘤患者的生存期延长可能相关,但KIR2DL1、KIR2DL2和KIR2DL3抑制剂IPH2101的Ⅰ/Ⅱ期临床研究却仍然呈现了阴性结果。进一步对这些患者的外周血进行分析,Carlsten等发现应用IPH2101后NK细胞通过FcγR APCs清除了KIR2DL1,导致NK细胞活性的降低,这也许是这个临床研究失败的原因之一[25]。而另外一种KIR2DL1、KIR2DL2和KIR2DL3抑制剂Lirilumab联合Nivolumab治疗晚期头颈部肿瘤客观反应率达24%[26],结果令人鼓舞,更多的联合PD-1或CTLA-4类药物,针对晚期实体瘤和血液系统肿瘤的Ⅰ/Ⅱ期临床研究正在进行,我们期待结果的公布,见表 2。
IDO是一种在巨噬细胞和树突状细胞等细胞中检测到的色氨酸代谢酶,可将色氨酸转化为犬尿氨酸,IDO有两种同工酶,IDO1和IDO2,目前的研究主要为IDO1,而人们对IDO2的关注较少。多种类型的肿瘤均表达IDO,小鼠的移植瘤模型显示应用IDO抑制剂治疗可以明显提高T细胞的水平并有显著的抑瘤效果。调控IDO表达的抑癌基因BIN1,在多种肿瘤中均低表达,而小鼠模型进一步验证了敲除BIN1可以使IFNγ的水平升高,从而刺激IDO的表达增多,进一步导致肿瘤免疫活性的改变。临床前的模型已经提示IDO靶点药物与CTLA-4或PD-1/PD-L1等靶点药物联合治疗效果也许会更加理想[27]。
基于以上理论依据,目前正在进行临床研究的主要有4种小分子抑制剂,Indoximod、Navoximod、Epacadostat和BMS-986205,这其中数Epacadostat最为耀眼,进展最快,已有多项Ⅲ期临床研究正在进行。一项Epacadostat的Ⅰ期临床研究总共纳入了52例晚期实体瘤患者,按照3+3模式进行剂量爬坡,剂量从50 mg/d 1次到700 mg/d 2次,其中300 mg和400 mg/d 2次剂量组各出现1例DLT,虽然没有客观缓解的患者,但是有7例患者疾病的稳定时间超过16周[28]。而另外一项Ⅰ/Ⅱ期的临床研究,采用Epacadostat联合Pembrolizumab,纳入54例实体瘤患者,1例患者在Epacadostat 50 mg/d 2次联合Pembrolizumab 2 mg/kg时发生了3级的皮疹,为DLT,截止到数据分析时,7例可评价疗效的恶性黑色素瘤患者ORR和DCR分别为57%和86%,其中2名患者疗效CR,5名结直肠癌患者的ORR和DCR分别为40%和80%[29]。另一项ECHO-301临床研究却提示Epacadostat联合Pembrolizumab并不能改善晚期黑色素瘤患者的PFS,且该研究被提前终止,并将于近期发布相关数据。多项Epacadostat的Ⅲ期临床研究被关闭,受其影响,BMS-986205和Indoximod治疗头颈癌、非小细胞肺癌和恶性黑色素瘤的多项Ⅲ期临床研究也被终止。但无论怎样,初步看到了IDO抑制剂联合抗PD-1抗体类药物治疗的安全性和疗效,并且随着治疗机制研究的不断深入和IDO抑制剂联合抗CTLA-4、化疗及其他免疫检查点抑制剂的更多种类药物、更大宗的临床研究正在进行,更多数据结果的出现会揭示出IDO靶点药物的真实抗肿瘤作用,见表 2。
2.3 CD47CD47,又称整合素相关蛋白,属于免疫球蛋白超家族,存在于细胞表面,通过与巨噬细胞或树突状细胞表面的信号调节蛋白α(SIRPα)结合来调节细胞的增殖、迁移和凋亡等。大部分的肿瘤细胞表面均过表达CD47,向巨噬细胞释放“自己人,不要吃我”的信号,以逃避巨噬细胞的吞噬,而阻断CD47/SIRPα通路可以诱导人和小鼠的巨噬细胞对肿瘤细胞的吞噬,应用抗CD47抗体治疗的小鼠移植瘤模型显示了良好的抑瘤效果[30]。
除了疗效外,毒性也同样不可忽略,CD47抗体Hu5F9-G4的临床前研究发现,应用药物第2天开始出现红细胞数目、红细胞压积及血红蛋白下降,到第5~7天降至最低点,虽然贫血较重,但可通过对症治疗缓解,并且在2~3周内恢复至正常[31]。为了预防贫血,可以在用药前应用促红细胞生成素。但如何研制出只结合肿瘤细胞表面的CD47而不结合红细胞和其他正常细胞表面CD47的药物、如何降低药物副作用是我们关注的重点,更多的针对CD47/SIRPα靶点的临床研究正在进行中,见表 2。除了单药应用外,CD47/PD-L1、CD47/VEGF等靶点联合的双功能抗体也正在研发过程中,期待更多的研究给我们带来更多惊喜的药物。
3 总结与展望目前免疫靶点相关研究是临床研究的热点,本文从特异性免疫和非特异性免疫两方面对新型免疫靶点的作用机制、研究现状和最新进展进行了阐述,虽然新的靶点和药物层出不穷,但目前新型检查点药物尚处于非常早期的研究阶段,临床研究中也观察到部分免疫治疗单药的疗效可能不甚理想,期待其与化疗、放疗或其他免疫靶点药物的联合治疗可能会带来更好的疗效,同时开展相关的生物标志物研究对于筛选获益人群、阐明临床可行性也有重要的价值,期待能有更多的研究结果指导临床实践。
| [1] | Reck M, Rodríguezabreu D, Robinson AG, et al. Pembrolizumab versus Chemotherapy for PD-L1-Positive Non-Small-Cell Lung Cancer[J]. N Engl J Med, 2016, 375(19): 1823–33. DOI:10.1056/NEJMoa1606774 |
| [2] | Giuroiu I, Weber J. Novel checkpoints and cosignaling molecules in cancer immunotherapy[J]. Cancer J, 2017, 23(1): 23–31. DOI:10.1097/PPO.0000000000000241 |
| [3] | Koyama S, Akbay EA, Li YY, et al. Adaptive resistance to therapeutic PD-1 blockade is associated with upregulation of alternative immune checkpoints[J]. Nat Commun, 2016, 7: 10501. DOI:10.1038/ncomms10501 |
| [4] | Kang CW, Dutta A, Chang LY, et al. Apoptosis of tumor infiltrating effector TIM-3+ CD8+ T cells in colon cancer[J]. Sci Rep, 2015, 5: 15659. DOI:10.1038/srep15659 |
| [5] | Zong Y, He S. Identification of Co-inhibitory receptors PD-1 and TIM-3 on t cells from gastric cancer patients[J]. Immunother Open Acc, 2015, 1: 105. |
| [6] | Deuss FA, Gully BS, Rossjohn J, et al. Recognition of nectin-2 by the natural killer cell receptor (TIGIT)[J]. J Biol Chem, 2017, 292(27): 11413–22. DOI:10.1074/jbc.M117.786483 |
| [7] | Chauvin JM, Pagliano O, Fourcade J, et al. TIGIT and PD-1 impair tumor antigen-specific CD8+T cells in melanoma patients[J]. J Clin Invest, 2015, 125(5): 2046–58. DOI:10.1172/JCI80445 |
| [8] | Tassi E, Grazia G, Vegetti C, et al. Early effector t lymphocytes coexpress multiple inhibitory receptors in primary non-small cell lung cancer[J]. Cancer Res, 2017, 77(4): 851–61. DOI:10.1158/0008-5472.CAN-16-1387 |
| [9] | Williams JB, Horton BL, Zheng Y, et al. The EGR2 targets LAG-3 and 4-1BB describe and regulate dysfunctional antigen-specific CD8+ T cells in the tumor microenvironment[J]. J Exp Med, 2017, 214(2): 381–400. DOI:10.1084/jem.20160485 |
| [10] | Tassi E, Grazia G, Vegetti C, et al. Early effector t lymphocytes coexpress multiple inhibitory receptors in primary non-small cell lung cancer[J]. Cancer Res, 2017, 77(4): 851–61. DOI:10.1158/0008-5472.CAN-16-1387 |
| [11] | Brignone C, Gutierrez M, Mefti F, et al. First-line chemoimmunotherapy in metastatic breast carcinoma: combination of paclitaxel and IMP321 (LAG-3Ig) enhances immune responses and antitumor activity[J]. J Transl Med, 2010, 8: 71. DOI:10.1186/1479-5876-8-71 |
| [12] | Liu J, Yuan Y, Chen W, et al. Immune-checkpoint proteins VISTA and PD-1 nonredundantly regulate murine T-cell responses[J]. Proc Natl Acad Sci U S A, 2015, 112(21): 6682–7. DOI:10.1073/pnas.1420370112 |
| [13] | Böger C, Behrens HM, Krüger S, et al. The novel negative checkpoint regulator VISTA is expressed in gastric carcinoma and associated with PD-L1/PD-1: A future perspective for a combined gastric cancer therapy?[J]. Oncoimmunology, 2017, 6(4): e1293215. DOI:10.1080/2162402X.2017.1293215 |
| [14] | Gao J, Ward JF, Pettaway CA, et al. VISTA is an inhibitory immune checkpoint that is increased after ipilimumab therapy in patients with prostate cancer[J]. Nat Med, 2017, 23(5): 551–5. DOI:10.1038/nm.4308 |
| [15] | Derré L, Rivals JP, Jandus C, et al. BTLA mediates inhibition of human tumor-specific CD8+ T cells that can be partially reversed by vaccination[J]. J Clin Invest, 2010, 120(1): 157–67. DOI:10.1172/JCI40070 |
| [16] | Bulliard Y, Jolicoeur R, Zhang J, et al. OX40 engagement depletes intratumoral Tregs via activating FcγRs, leading to antitumor efficacy[J]. Immunol Cell Biol, 2014, 92(6): 475–80. DOI:10.1038/icb.2014.26 |
| [17] | Infante JR, Hansen AR, Pishvaian MJ, et al. A phase Ib dose escalation study of the OX40 agonist MOXR0916 and the PD-L1 inhibitor atezolizumab in patients with advanced solid tumors[J]. J Clin Oncol, 2016, 34(Suppl 15): 101. |
| [18] | Fan X, Quezada SA, Sepulveda MA, et al. Engagement of the ICOS pathway markedly enhances efficacy of CTLA-4 blockade in cancer immunotherapy[J]. J Exp Med, 2014, 211(4): 715–25. DOI:10.1084/jem.20130590 |
| [19] | Kamphorst AO, Pillai RN, Yang S, et al. Proliferation of PD-1+ CD8+T cells in peripheral blood after PD-1-targeted therapy in lung cancer patients[J]. Proc Natl Acad Sci U S A, 2017, 114(19): 4993–8. DOI:10.1073/pnas.1705327114 |
| [20] | Chester C, Chang S, Kurland JF, et al. Biomarker characterization using mass cytometry in a phase 1 trial of urelumab (BMS-663513) in subjects with advanced solid tumors and relapsed/refractory B-cell non-Hodgkin lymphoma[J]. J Clin Oncol, 2014, 32(Suppl 15): 3017. |
| [21] | Tolcher AW, Sznol M, Hu-Lieskovan S, et al. Phase Ib study of utomilumab (PF-05082566), a 4-1BB/CD137 agonist, in combination with pembrolizumab (MK-3475) in patients with advanced solid tumors[J]. Clin Cancer Res, 2017, 23(18): 5349–57. DOI:10.1158/1078-0432.CCR-17-1243 |
| [22] | Buchan SL, Rogel A, Al-Shamkhani A. The immunobiology of CD27 and OX40 and their potential as targets for cancer immunotherapy[J]. Blood, 2018, 131(1): 39–48. |
| [23] | Burris HA, Infante JR, Ansell SM, et al. Safety and activity of varlilumab, a novel and first-in-class agonist anti-CD27 antibody, in patients with advanced solid tumors[J]. J Clin Oncol, 2017, 35(18): 2028–36. DOI:10.1200/JCO.2016.70.1508 |
| [24] | Wang E, Wang LC, Tsai CY, et al. Generation of Potent T-cell Immunotherapy for Cancer Using DAP12-Based, Multichain, Chimeric Immunoreceptors[J]. Cancer Immunol Res, 2015, 3(7): 815–26. DOI:10.1158/2326-6066.CIR-15-0054 |
| [25] | Carlsten M, Korde N, Kotecha R, et al. Checkpoint Inhibition of KIR2D with the Monoclonal Antibody IPH2101 Induces Contraction and Hyporesponsiveness of NK-cells in Patients with Myeloma[J]. Clin Cancer Res, 2016, 22(21): 5211–22. DOI:10.1158/1078-0432.CCR-16-1108 |
| [26] | Leidner R, Kang H, Haddad R, et al. Preliminary efficacy from a phase 1/2 study of the natural killer cell–targeted antibody, lirilumab in combination with nivolumab in squamous cell carcinoma of the head and neck[J]. Immunother Cancer, 2017, 4(Suppl 2): 91. |
| [27] | Spranger S, Koblish HK, Horton B, et al. Mechanism of tumor rejection with doublets of CTLA-4, PD-1/PD-L1, or IDO blockade involves restored IL-2 production and proliferation of CD8+ T cells directly within the tumor microenvironment[J]. J Immunother Cancer, 2014, 2: 3. DOI:10.1186/2051-1426-2-3 |
| [28] | Beatty GL, O'Dwyer PJ, Clark J, et al. First-in-human phase 1 study of the oral inhibitor of indoleamine 2, 3-dioxygenase-1 epacadostat (incb024360) in patients with advanced solid malignancies[J]. Clin Cancer Res, 2017, 23(13): 3269–76. DOI:10.1158/1078-0432.CCR-16-2272 |
| [29] | Gangadhar TC, Hamid O, Smith DC, et al. Preliminary results from a Phase Ⅰ/Ⅱ study of epacadostat (incb024360) in combination with pembrolizumab in patients with selected advanced cancers[J]. J Immunother Cancer, 2015, 3(S2): 07. |
| [30] | Xiao Z, Chung H, Banan B, et al. Antibody mediated therapy targeting CD47 inhibits tumor progression of hepatocellular carcinoma[J]. Cancer Lett, 2015, 360(2): 302–9. DOI:10.1016/j.canlet.2015.02.036 |
| [31] | Liu J, Wang L, Zhao F, et al. Pre-clinical development of a humanized anti-cd47 antibody with anti-cancer therapeutic potential[J]. PLoS One, 2015, 10(9): e0137345. DOI:10.1371/journal.pone.0137345 |
 2018, Vol. 45
2018, Vol. 45