文章信息
- 阿帕替尼在非小细胞肺癌中的研究进展
- Progress of Apatinib in Treatment of Non-small Cell Lung Cancer
- 肿瘤防治研究, 2018, 45(11): 928-931
- Cancer Research on Prevention and Treatment, 2018, 45(11): 928-931
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2018.18.0504
- 收稿日期: 2018-04-17
- 修回日期: 2018-08-07
肺癌是我国发病率和死亡率最高的恶性肿瘤之一。其中, 非小细胞肺癌(non-small cell lung cancer, NSCLC)大约占肺癌总数的85%, 由于临床上大部分NSCLC患者确诊时, 已属晚期, 丧失了手术时机, 5年生存率仅5%[1]。近年来, 针对驱动基因的靶向药物不断出现, 极大地改善了NSCLC患者的生存。对于有表皮生长因子受体(epidermal growth factor receptor-tyrosine kinase, EGFR)基因突变的NSCLC患者, 标准治疗为EGFR酪氨酸激酶抑制剂(tyrosine kinase inhibitor, TKI)药物, 如吉非替尼, 厄洛替尼等[2-3]; 而对于有间变淋巴瘤激酶融合基因突变(anaplastic lymphoma kinase, ALK)的NSCLC患者, 克唑替尼等间变淋巴瘤激酶抑制剂为最佳治疗方案[4]。对于无驱动基因突变的晚期NSCLC患者仍以化学治疗为主, 生存获益极低。在携带驱动基因突变的患者中, 大部分患者仍然最终会获得性耐药[5]。因此, NSCLC迫切需要新的治疗手段。
肿瘤的生长和转移离不开血管新生, 因此阻断新生血管生成是NSCLC的治疗策略之一[6]。甲磺酸阿帕替尼是一种新型血管生成小分子TKI, 其高度选择性地与血管内皮生长因子受体-2(vascular endothelial growth factor receptor-2, VEGFR-2)结合, 降低其酪氨酸激酶活性, 阻断下游的信号转导, 从而发挥抗肿瘤作用[7]。Ⅱ、Ⅲ期临床试验均表明了阿帕替尼可明显延长晚期标准化疗失败后的胃或胃食管结合部腺癌患者的生存期[8-10]。因此, 阿帕替尼已于2014年10月被国家食品药品监督管理局(CFDA)批准用于晚期胃或胃食管结合部腺癌二线以上治疗。阿帕替尼因适用人群广、耐受性好, 口服方便等特点成为临床医师关注的热点。阿帕替尼上市前后, 其用于治疗NSCLC的基础和临床研究也在积极开展, 已经发表了大量相关研究, 但是目前缺乏对这方面内容的疏理总结, 本文拟系统地综述阿帕替尼用于治疗NSCLC相关的基础和临床研究的现状与进展, 为今后的临床应用提供参考。
1 抗血管生成与肺癌1971年Folkman提出了“饿死肿瘤”学说, 该学说是指通过阻断血管生成, 切断肿瘤氧气和营养供应, 从而达到“饿死肿瘤”的目的[6]。血管内皮生长因子(vascular endothelial growth factor, VEGF)是促进肿瘤血管生成的重要因子, 在大部分包括在NSCLC内的实体瘤中高表达[11]。有研究表明, 血清VEGF表达水平高的NSCLC患者生存时间显著短于VEGF表达水平低的患者[12]。VEGF主要包括VEGFA~E和胎盘生长因子等, 通过与其酪氨酸激酶受体(主要是VEGFR l~3)结合, 激活下游一系列信号通路, 刺激内皮细胞增殖、分化和转移, 促进血管生成[13]。抑制血管生成信号通路是目前被广泛采用的一种肿瘤治疗策略[11]。目前临床上抗血管生成药物的主要机制有两种:单克隆抗体阻断VEGF配体; 阻断VEGFR-2的单克隆抗体或直接抑制其酪氨酸活性的TKI[14]。
虽然抗血管生成类药物层出不穷, 如索拉非尼、苏尼替尼和帕唑帕尼在肝细胞癌、肾细胞癌、软组织肉瘤、胰腺神经内分泌肿瘤等晚期实体肿瘤显示了生存获益并获批用于相应的适应证, 但在NSCLC方面, 目前仅有内皮抑素和针对VEGFA的单克隆抗体贝伐珠单抗与以铂类药物为基础的两药化疗方案被CFDA批准用于晚期NSCLC的一线治疗。
2 新型小分子抗血管TKI—阿帕替尼阿帕替尼是我国自主研发的抗血管生成类药物, 是VEGFR的强效TKI, 通过与细胞内VEGFR-2的ATP位点竞争性结合, 阻断下游的信号通路转导, 从而发挥抗肿瘤血管生成的作用, 高剂量阿帕替尼还可以显著抑制c-Kit、Ret、c-SRC和PDGFR酪氨酸激酶的活性[7]。阿帕替尼以剂量依赖性方式抑制人脐静脉内皮细胞(human umbilical vein endothelial cells, HUVEC)的迁移, 从而抑制HUVEC的管腔形成, 对HUVEC的半数抑制浓度(IC50)仅为0.001 μmol/L[7]。
李进教授等[8]开展的阿帕替尼治疗晚期实体瘤的Ⅰ期临床试验为其后来的临床使用剂量提供了初步参考数据。该研究从250 mg开始爬坡, 一直到1 000 mg, 同时观察药物作用效果。850 mg组患者没有出现剂量限制性毒性, 耐受性良好, 故将最大耐受剂量定为每日850 mg。最容易发生的毒性反应为高血压(发生率69.5%)、蛋白尿(发生率47.8%)和手足综合征(发生率45.6%)。入组的46例患者包括:胃肠道肿瘤34例、肺癌和乳腺癌各3例, 其他肿瘤6例, 用药第8周的评价结果为:7例(18.9%)为部分缓解(partial response, PR), 24例(64.9%)稳定(stable disease, SD), 总体疾病控制率(disease control rate, DCR)为83.8%。
2016年, JCO杂志公布了阿帕替尼治疗二线及以上标准化疗失败的晚期胃或胃食管结合部腺癌的Ⅲ期临床研究结果[9]:阿帕替尼每日850 mg组患者的中位总生存时间(median overall survival, mOS)和中位无进展生存时间(median progression free survival, mPFS)较安慰剂组明显延长。正是基于上述Ⅲ期临床研究的结果, 阿帕替尼作为国家1.1类新药被批准用于晚期胃腺癌的治疗。相较于同类抗血管生成药物贝伐珠单抗, 阿帕替尼口服方便, 价格相对低廉, 因此得到更多的关注。
3 阿帕替尼治疗NSCLC 3.1 单药治疗目前阿帕替尼治疗NSCLC的Ⅲ期临床研究正在进行, 因此在肺癌的临床应用中尚未被指南推荐。Li等[8]开展的阿帕替尼治疗实体瘤的Ⅰ期临床试验中, 46例实体瘤患者包括了3例肺癌, 总体结果显示阿帕替尼对肺癌具有一定效果, 耐受性良好。2012年ASCO发布了阿帕替尼对比安慰剂三线治疗晚期非鳞NSCLC的Ⅱ期随机对照研究[15]:入组患者135例, 按2:1随机分配入治疗组和安慰剂组, 治疗组患者每日口服阿帕替尼750 mg。结果显示, 治疗组和安慰剂组的mPFS分别为4.7和1.9月, 阿帕替尼组的客观反应率(objective response rate, ORR)、DCR分别为12.2%和68.9%, 明显优于安慰剂组的0和24.4%。阿帕替尼组与药物有关的不良事件主要为蛋白尿、高血压和手足综合征等, 但均可经药物减量、短暂停药或对症治疗缓解。研究结果显示, 阿帕替尼用于三线及以上治疗晚期非鳞NSCLC患者有较好的有效性和安全性。
虽然目前关于阿帕替尼治疗晚期NSCLC的大型随机对照临床研究的报道较少, 但多数案例显示阿帕替尼治疗晚期NSCLC疗效显著。Xu等[16]报道25例晚期NSCLC, 每日予阿帕替尼片750或500 mg, ORR为8.0%, DCR为68.0%, 中位PFS为7.37月。大量报道证明阿帕替尼治疗晚期NSCLC的临床治疗效果显著, 值得进一步研究和应用[17-21]。
3.2 联合治疗 3.2.1 联合化疗多药耐药(multi-drug resistance, MDR)是肿瘤化疗失败的主要原因, 细胞膜表面的ATP结合盒式蛋白(ABC)转运体通过将化疗药物从细胞内排出, 减弱药物的细胞毒作用参与MDR[22-23]。P-糖蛋白(P-gp)和乳腺癌耐药蛋白(BCRP)是ABC转运蛋白超家族的主要成员, Mi等[24]证实阿帕替尼可下调P-gp或BCRP高表达乳腺癌细胞中P-gp或BCRP的表达, 增加细胞中阿霉素的蓄积, 从而显著增加耐药细胞株的药物敏感度。Liu等[25]发现, NSCLC顺铂耐药细胞株A549/DDP较敏感细胞株高表达MDR1, 而阿帕替尼可以通过抑制ERK的磷酸化水平, 下调A549/DDP细胞MDR1的表达, 逆转顺铂耐药, 显著增加细胞凋亡率。Feng等[26]也证实阿帕替尼可以提高肺癌裸鼠移植瘤肿瘤组织中多西紫杉醇的浓度, 下调P-gp的表达, 增强化疗敏感度。
Tian等[7]最早在肺癌中进行了阿帕替尼联合化疗的尝试, 观察了阿帕替尼分别与多种化疗药物联合用于治疗肺癌裸鼠移植瘤的效果。结果显示, 阿帕替尼联合多西他赛、阿霉素等均可明显抑制肺癌移植瘤的生长, 与阿帕替尼组及化疗单药组相比差异均有统计学意义(P < 0.05)。2017年ASCO大会报道了一项阿帕替尼联合替吉奥治疗一线标准化疗失败的NSCLC的回顾性研究[27], 入组的12例患者中, 10例可评价, 5例达CR, 3例SD, 不良反应可控, 提示阿帕替尼联合化疗可进一步提高疗效。
一项化疗联合贝伐珠单抗随机Ⅱ期研究中, 贝伐珠单抗治疗组有6例患者发生咯血, 有9例患者死于贝伐珠单抗相关毒性, 因此肺鳞癌一直是抗血管药物探索的禁区[28]。阿帕替尼在肺鳞癌的治疗中也有探索, 2017年日本横滨举办的第18届世界肺癌大会上, 史清明教授报道了阿帕替尼联合替吉奥治疗肺鳞癌的一项单臂、多中心临床研究[29], 入组的16例肺鳞癌患者中ORR为6.25%, DCR为43.75%, 主要不良反应集中在高血压、手足皮肤反应、蛋白尿、乏力和腹泻等。另外, 多项阿帕替尼治疗NSCLC的探索性研究[16, 21]中, 也包含了肺鳞癌, 提示鳞癌也可从阿帕替尼中获益。
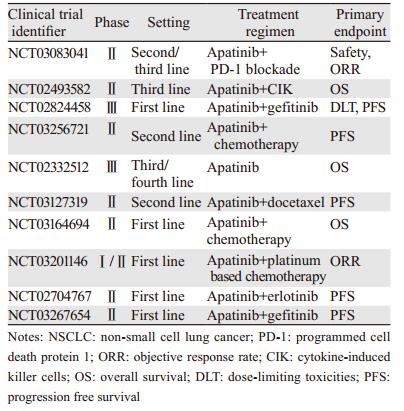
目前, 多项关于阿帕替尼联合化疗治疗NSCLC的临床试验正在开展, 见表 1。
对于EGFR突变型NSCLC, 目前一线标准治疗是吉非替尼, 厄洛替尼等EGFR-TKI, 但大部分患者都会在1年左右出现耐药进展。一代EGFR-TKI耐药后, 大约有50%的患者会发生T790M的耐药突变, 对于这部分患者的标准治疗是继续选择AZD9291(奥希替尼)[30]。然而对于一代EGFR-TKI耐药后没有T790M突变的患者, 只能继续选择含铂两药化疗。
EGFR和VEGFR同为酪氨酸激酶受体, 其下游通路也存在很多交互作用, 已有研究证明联合EGFR和VEGFR TKI存在协同效应[31]。Li等[32]报道了一项回顾性研究, 16例携带EGFR突变的NSCLC患者, 在一线吉非替尼、厄洛替尼或埃克替尼失败后, 选择继续接受EGFR-TKI以及联合阿帕替尼治疗, 结果显示, 14例可评价患者中, 仍然有4例患者获得部分缓解(PR)、10例稳定(SD), 中位PFS可达4.6月。另外, 也有一些小样本的单中心回顾性研究及临床个案报道报道了阿帕替尼联合EGFR-TKI治疗EGFR突变的NSCLC患者具有良好效果[20, 33-34], 多项前瞻性阿帕替尼联合EGFR-TKI的临床试验正在进行, 见表 1。
4 总结和展望现阶段, 对于驱动基因突变阴性的晚期NSCLC治疗方式有限, 而新型小分子抗血管生成药物为NSCLC的临床治疗提供了一种新的选择。当然仍需要更多大型临床研究, 明确抗血管生成后肿瘤微环境的改变、细胞内通路与肿瘤生长、转移的具体机制; 是否具有确切的生物标志物, 筛选出临床上获益的优势人群, 并提供最佳的精准化靶向治疗, 减少耐药产生。目前, 阿帕替尼三线治疗晚期非鳞NSCLC的Ⅲ期临床研究正在进行, 其与化疗药物联合的前景也令人鼓舞。相信随着相关基础研究的不断深入, 临床研究的不断开展, 肺癌的抗血管生成治疗将会成为未来肺癌治疗的重要手段之一。
| [1] | Chen W, Zheng R, Baade PD, et al. Cancer statistics in China, 2015[J]. CA Cancer J Clin, 2016, 66(2): 115–32. DOI:10.3322/caac.21338 |
| [2] | 周清, 魏雪武, 高欣. 中国肺癌临床研究的过去、现在和未来[J]. 医学研究生学报, 2017, 11: 1146–50. [ Zhou Q, Wei XW, Gao X. Clinical trials on primary lung cancer in China:Past, present, and future[J]. Yi Xue Yan Jiu Sheng Xue Bao, 2017, 11: 1146–50. ] |
| [3] | 刘田田, 毕经旺, 王俊. 非小细胞肺癌EGFR突变与脑转移的关系[J]. 肿瘤防治研究, 2017, 44(3): 189–92. [ Liu TT, Bi JW, Wang J. Relationship between EGFR mutation and brain metastasis in non-small cell lung cancer[J]. Zhong Liu Fang Zhi Yan Jiu, 2017, 44(3): 189–92. DOI:10.3971/j.issn.1000-8578.2017.03.007 ] |
| [4] | Hofman P. ALK in Non-Small Cell Lung Cancer (NSCLC) Pathobiology, Epidemiology, Detection from Tumor Tissue and Algorithm Diagnosis in a Daily Practice[J]. Cancers(Basel), 2017, 9(8): pii:E107. |
| [5] | Shi Q, Guan M, Wang Y, et al. Survival analysis of patients with advanced non-small cell lung cancer receiving tyrosine kinase inhibitor (TKI) treatment:A multi-center retrospective study[J]. Thorac Cancer, 2018, 9(2): 278–83. |
| [6] | Hanahan D, Weinberg RA. Hallmarks of cancer:the next generation[J]. Cell, 2011, 144(5): 646–74. DOI:10.1016/j.cell.2011.02.013 |
| [7] | Tian S, Quan H, Xie C, et al. YN968D1 is a novel and selective inhibitor of vascular endothelial growth factor receptor-2 tyrosine kinase with potent activity in vitro and in vivo[J]. Cancer Sci, 2011, 102(7): 1374–80. DOI:10.1111/cas.2011.102.issue-7 |
| [8] | Li J, Zhao X, Chen L, et al. Safety and pharmacokinetics of novel selective vascular endothelial growth factor receptor-2 inhibitor YN968D1 in patients with advanced malignancies[J]. BMC Cancer, 2010, 10: 529. DOI:10.1186/1471-2407-10-529 |
| [9] | Li J, Qin S, Xu J, et al. Randomized, Double-Blind, Placebo-Controlled Phase Ⅲ Trial of Apatinib in Patients With Chemotherapy-Refractory Advanced or Metastatic Adenocarcinoma of the Stomach or Gastroesophageal Junction[J]. J Clin Oncol, 2016, 34(13): 1448–54. DOI:10.1200/JCO.2015.63.5995 |
| [10] | Li J, Qin S, Xu J, et al. Apatinib for chemotherapy-refractory advanced metastatic gastric cancer:results from a randomized, placebo-controlled, parallel-arm, phase Ⅱ trial[J]. J Clin Oncol, 2013, 31(26): 3219–25. DOI:10.1200/JCO.2013.48.8585 |
| [11] | Hicklin DJ, Ellis LM. Role of the vascular endothelial growth factor pathway in tumor growth and angiogenesis[J]. J Clin Oncol, 2005, 23(5): 1011–27. DOI:10.1200/JCO.2005.06.081 |
| [12] | Bremnes RM, Camps C, Sirera R. Angiogenesis in non-small cell lung cancer:the prognostic impact of neoangiogenesis and the cytokines VEGF and bFGF in tumours and blood[J]. Lung Cancer, 2006, 51(2): 143–58. |
| [13] | Olsson AK, Dimberg A, Kreuger J, et al. VEGF receptor signalling-in control of vascular function[J]. Nat Rev Mol Cell Biol, 2006, 7(5): 359–71. DOI:10.1038/nrm1911 |
| [14] | Vasudev NS, Reynolds AR. Anti-angiogenic therapy for cancer:current progress, unresolved questions and future directions[J]. Angiogenesis, 2014, 17(3): 471–94. DOI:10.1007/s10456-014-9420-y |
| [15] | Zhang L, Shi M, Huang C, et al. A phase Ⅱ, multicenter, placebo-controlled trial of apatinib in patients with advanced nonsquamous non-small cell lung cancer (NSCLC) after two previous treatment regimens[J]. J Clin Oncol, 2012, 30(15_suppl): 7548. |
| [16] | Xu J, Liu X, Yang S, et al. Clinical response to apatinib monotherapy in advanced non-small cell lung cancer[J]. Asia Pac J Clin Oncol, 2018, 14(3): 264–9. DOI:10.1111/ajco.2018.14.issue-3 |
| [17] | Song Z, Yu X, Lou G, et al. Salvage treatment with apatinib for advanced non-small-cell lung cancer[J]. Onco Targets Ther, 2017, 10: 1821–5. DOI:10.2147/OTT |
| [18] | Zeng DX, Wang CG, Huang JA, et al. Apatinib in the treatment of advanced lung adenocarcinoma with KRAS mutation[J]. Onco Targets Ther, 2017, 10: 4269–72. DOI:10.2147/OTT |
| [19] | Zeng DX, Wang CG, Lei W, et al. Efficiency of low dosage apatinib in post-first-line treatment of advanced lung adenocarcinoma[J]. Oncotarget, 2017, 8(39): 66248–53. |
| [20] | Fang SC, Zhang HT, Zhang YM, et al. Apatinib as post second-line therapy in EGFR wild-type and ALK-negative advanced lung adenocarcinoma[J]. Onco Targets Ther, 2017, 10: 447–52. DOI:10.2147/OTT |
| [21] | Ding L, Li QJ, You KY, et al. The Use of Apatinib in Treating Nonsmall-Cell Lung Cancer:Case Report and Review of Literature[J]. Medicine (Baltimore), 2016, 95(20): e3598. DOI:10.1097/MD.0000000000003598 |
| [22] | Ozben T. Mechanisms and strategies to overcome multiple drug resistance in cancer[J]. FEBS Lett, 2006, 580(12): 2903–9. DOI:10.1016/j.febslet.2006.02.020 |
| [23] | Perez-Tomas R. Multidrug resistance:retrospect and prospects in anti-cancer drug treatment[J]. Curr Med Chem, 2006, 13(16): 1859–76. DOI:10.2174/092986706777585077 |
| [24] | Mi YJ, Liang YJ, Huang HB, et al. Apatinib (YN968D1) reverses multidrug resistance by inhibiting the efflux function of multiple ATP-binding cassette transporters[J]. Cancer Res, 2010, 70(20): 7981–91. DOI:10.1158/0008-5472.CAN-10-0111 |
| [25] | Liu ZL, Jin BJ, Cheng CG, et al. Apatinib resensitizes cisplatin-resistant non-small cell lung carcinoma A549 cell through reversing multidrug resistance and suppressing ERK signaling pathway[J]. Euro Rev Med Pharm Sci, 2017, 21(23): 5370–7. |
| [26] | Feng SQ, Wang GJ, Zhang JW, et al. Combined treatment with apatinib and docetaxel in A549 xenograft mice and its cellular pharmacokinetic basis[J]. Acta Pharmacol Sin, 2018: 1–11. |
| [27] | Wu Z, Wu J, Dai G, et al. The efficiency of apatinib plus S-1 as second-line or laterline chemotherapy for advanced non-small-cell lung cancer[J]. J Clin Oncol, 2017, 35(15_suppl): e20549–e. DOI:10.1200/JCO.2017.35.15_suppl.e20549 |
| [28] | Ferrara N, Hillan KJ, Gerber HP, et al. Discovery and development of bevacizumab, an anti-VEGF antibody for treating cancer[J]. Nat Rev Drug discov, 2004, 3(5): 391–400. DOI:10.1038/nrd1381 |
| [29] | Shi Q, Guo X, Wang Z, et al.The efficiency and safety of apatinib plus s-1 as second-line or later line chemotherapy for advanced squamous cell lung carcinoma[J].18TH WORLD CONFERENCE ON LUNG CANCER.Yokohama, Japan.October 15-18, 2017. |
| [30] | Mok TS, Wu Y-L, Ahn M-J, et al. Osimertinib or Platinum-Pemetrexed in EGFR T790M-Positive Lung Cancer[J]. N Engl J Med, 2017, 376(7): 629–40. DOI:10.1056/NEJMoa1612674 |
| [31] | Poindessous V, Ouaret D, EI Ouadrani K, et al. EGFR- and VEGF(R)-targeted small molecules show synergistic activity in colorectal cancer models refractory to combinations of monoclonal antibodies[J]. Clin Cancer Res, 2011, 17(20): 6522–30. DOI:10.1158/1078-0432.CCR-11-1607 |
| [32] | Li F, Zhu T, Cao B, et al. Apatinib enhances antitumour activity of EGFR-TKIs in non-small cell lung cancer with EGFR-TKI resistance[J]. Eur J Cancer, 2017, 84: 184–92. DOI:10.1016/j.ejca.2017.07.037 |
| [33] | Xu J, Liu X, Yang S, et al. Apatinib plus icotinib in treating advanced non-small cell lung cancer after icotinib treatment failure:a retrospective study[J]. Onco Targets Ther, 2017, 10: 4989–95. DOI:10.2147/OTT |
| [34] | Peng Y, Cui H, Liu Z, et al. Apatinib to combat EGFR-TKI resistance in an advanced non-small cell lung cancer patient with unknown EGFR status:a case report[J]. Onco Targets Ther, 2017, 10: 2289–95. DOI:10.2147/OTT |
 2018, Vol. 45
2018, Vol. 45