文章信息
- 阿帕替尼联合拓扑替康多线治疗铂类耐药复发性卵巢癌2例报告
- Multi-line Treatment Combined Apatinib with Toptecan for Platinum-resistant Recurrent Ovarian Cancer: Two Cases Report
- 肿瘤防治研究, 2018, 45(3): 188-190
- Cancer Research on Prevention and Treatment, 2018, 45(3): 188-190
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2018.17.0690
- 收稿日期: 2017-06-16
- 修回日期: 2017-09-06
卵巢癌是常见的妇科恶性肿瘤之一,尽管临床上卵巢癌的治疗手段不断提高,但是接受规范化治疗的患者其复发率仍在70%~80%,且晚期卵巢癌患者5年生存率仅为25%~30%[1]。现报道2例铂类耐药复发性卵巢癌多线接受阿帕替尼联合拓扑替康治疗的临床诊治过程,效果良好,并对相关文献进行复习。
1 临床资料患者1,女,62岁,2012年11月20日CT示双侧卵巢肿块,CA125为1 578.0 u/ml。2013年1月25日行“全子宫+双侧附件+大网膜+盆壁肿瘤结节切除术”,术后病理显示:双侧卵巢浆液性乳头状囊腺癌Ⅰ~Ⅱ级,左侧卵巢肿瘤10 cm×10 cm×5.5 cm,右侧卵巢肿瘤5.5 cm×5.0 cm×2.0 cm。T2bN0M0期,影像学未见残余病灶。2012年12月至2013年7月接受TC方案辅助化疗6周期,2013年3月查CA125恢复正常。2015年4月检查PET-CT示盆腔团块,前纵隔、肝周、腹膜后及胰头周围淋巴结,肝内及肝周结节及团块,右侧胸膜增厚及多发结节,FDG代谢增高,考虑肿瘤转移;同时查CA125为220 u/ml。2015年4月至2015年9月给予TP方案联合贝伐珠单抗治疗6周期,治疗期间最佳疗效评价为稳定(SD),治疗结束后CA125恢复至正常。2016年3月查CT示右肺及右侧胸膜多发结节状影,考虑转移,CA125为385 u/ml。2016年3月至2016年10月给予单药拉司太特治疗9周期,期间最佳疗效为SD,CA125最低降至51.0 u/ml。2016年12月CT示盆腔内软组织影增大,CA125为138.7 u/ml,考虑病情进展。2016年12月至2017年1月给予GX方案化疗3周期,治疗期间最佳疗效为SD。2017年2月复查CT示盆腔病灶增大,肝脏病灶稳定,腹膜后淋巴结较前增大,疗效评价进展,同时查CA125为70.9 u/ml。2017年2月18日给予单药拓扑替康(1.2 mg/m2,口服,d1、8、15,每4周重复)联合阿帕替尼(250 mg/d, 持续口服)治疗,治疗第2周尝试增加阿帕替尼(加至500 mg/d)治疗5天,后出现2级腹痛停药5天后疼痛缓解,恢复原剂量(250 mg/d)治疗后未再出现腹痛,其余不良反应包括1级蛋白尿,3级高血压,给予对症处理后好转。2017年4月复查CT示盆腔内病灶、肝脏病灶及腹膜后转移性淋巴结均较前缩小,见图 1、2,查CA125降至正常;疗效评价为PR。目前该患者仍在治疗中。
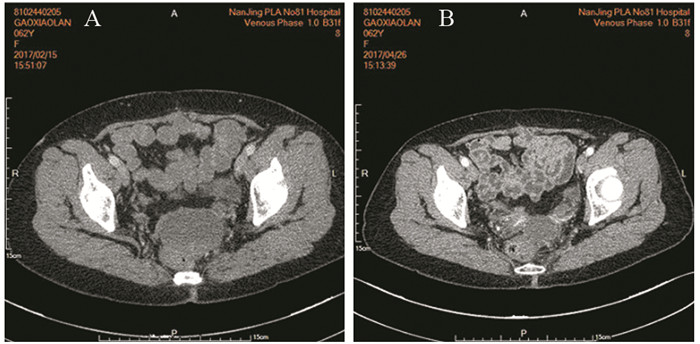
|
| A: before treatment; B: after treatment 图 1 阿帕替尼联合拓朴替康多线治疗后盆腔内病灶缩小 Figure 1 Tumors in the pelvic were smaller after multi-line treatment combined apatinib with toptecan |
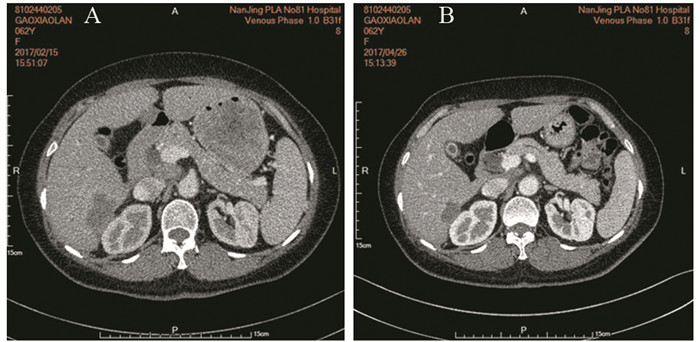
|
| A: before treatment; B: after treatment 图 2 阿帕替尼联合拓朴替康多线治疗后肝脏右后叶病灶缩小 Figure 2 Tumor in the right posterior lobe of liver was smaller after multi-line treatment combined apatinib with toptecan |
患者2,女,48岁,2014年5月29日CT示盆腔多发实性占位,最大7.7 cm×7.4 cm×6.9 cm;CA125为1 191.0 u/ml。2014年6月3日行“肿瘤细胞减灭术(全子宫+双侧附件+大网膜切除术)”,术后影像学未见明确残余病灶。2014年7月至2014年10月接受多西他赛联合奥沙利铂方案辅助化疗6周期,2014年10月CA125恢复正常。2015年6月PET-CT示盆腔右侧髂血管区结节影摄取增高,考虑转移;腹主动脉旁多发略大淋巴结,FDG摄取增高,考虑转移;同时查CA125为91.1 u/ml。2015年6月至2015年10月给予TP方案化疗6周期,治疗期间最佳疗效为PR,CA125恢复正常。2016年2月CT示右髂血管旁病灶较前增大,CA125为172.0 u/ml,遂行右髂血管旁病灶伽玛刀治疗,治疗后该病灶较前缩小,CA125恢复正常。2016年10月CT示盆腔内右侧髂血管旁病灶较前增大,CA125为130.2 u/ml,考虑病情进展。2016年10月至2016年11月给予GX方案化疗2周期,化疗结束后复查CT示右侧髂血管旁结节病灶较前增大,腹主动脉前淋巴结较前增大,考虑转移;疗效评价进展。2016年12月行腹主动脉前淋巴结伽马刀治疗。2017年3月查CT示左侧附件区结节较前增多、增大,腹膜后、双侧髂血管旁及左侧锁骨上窝多发肿大淋巴结较前增多、增大;CA125为315.5 u/ml。因病情进展2017年3月15开始给予拓扑替康(1.2 mg/m2,口服,第1、8、15天,每4周重复)联合阿帕替尼(250 mg/d,持续口服)治疗,治疗第2周尝试增加阿帕替尼剂量(500 mg/d)治疗7天,治疗期间出现3级手足皮肤反应,主要表现为双侧手掌及脚掌多发水疱及破溃,疼痛明显,影响行走,遂减量至250 mg/d继续治疗,并给予尿素软膏治疗,1周后手足皮肤反应缓解。2017年4月复查CT:双侧附件区结节病灶较前缩小,见图 3,全身淋巴结部分较前略缩小,查CA125为75.9 u/ml;疗效评价PR。目前该患者仍在该方案治疗中。
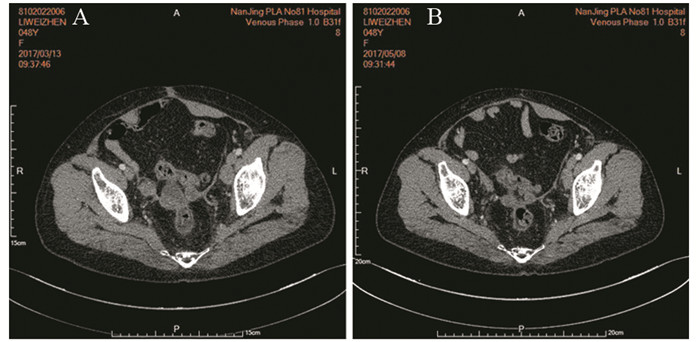
|
| A: before treatment; B:after treatment 图 3 阿帕替尼联合拓朴替康多线治疗后盆腔结节较前缩小 Figure 3 Tumors in the pelvic were smaller after multi-line treatment combined apatinib with toptecan |
卵巢癌发病率及死亡率均位于妇科肿瘤前列,多数患者就医时已为晚期,经过肿瘤细胞减灭术后,后期的系统治疗尤为重要。
NCCN(美国国家综合癌症网)卵巢癌指南(2017年第1版)推荐卡铂联合紫杉醇作为卵巢癌初始治疗的标准化疗方案。复发性卵巢癌分为铂类耐药及铂类敏感两类。其中铂类敏感型卵巢癌患者首选含铂类药物的联合化疗,而对于铂类耐药的复发性卵巢癌,首选非铂类单药治疗,指南推荐的药物有多西他赛(22%有效率)、吉西他滨(19%有效率)、拓扑替康(20%有效率)、脂质体阿霉素(26%有效率)、口服依托泊苷(27%有效率)以及紫杉醇(21%有效率)[2]。另一方面,靶向药物在卵巢癌治疗上也取得了长足的进展。贝伐珠单抗是首个被美国食品及药品监督管理局(FDA)批准用于治疗铂耐药性复发性卵巢癌的靶向药物。两项Ⅲ期临床研究GOG0218和ICON7,一线应用贝伐单抗联合卡铂和紫杉醇治疗晚期卵巢癌,并且化疗结束后继续给予贝伐单抗维持治疗,结果均显示可显著延长患者无进展生存期。另外,两种PARP抑制剂奥拉帕尼和Rucaparib亦被批准用于晚期卵巢癌。但是贝伐珠单抗是其中唯一进入中国市场的。
阿帕替尼是由我国自主研发的一种新型的小分子抗血管生成剂,能通过与血管内皮细胞生长因子受体-2高选择性地结合且抑制其功能,抑制肿瘤血管的生成,从而能有效抑制血管内皮细胞的增殖、迁移以及血管生成。目前已被国家食品药品监督管理总局(CFDA)批准上市用于晚期胃腺癌或胃-食管结合部腺癌三线或三线以上的治疗, 在多种移植瘤模型上有明显的抗肿瘤效果[3],单药或联合治疗[4]胃癌、肺癌、食管癌、肝癌、甲状腺癌、骨肉瘤等肿瘤。临床亦有多篇[5-7]报道阿帕替尼用于二线及二线以上治疗多种恶性实体瘤,均显示出一定的临床效果,其中亦有妇科肿瘤接受阿帕替尼治疗的病例。
本文中,病例1出现3次疾病进展,曾接受4种化疗方案共计24周期化疗,并且联合贝伐珠单抗治疗6月。病例2出现4次疾病进展,曾接受3种化疗方案共计14周期化疗,以及2次腹腔内结节伽马刀治疗。病情再次进展,已无标准治疗方案,结合患者体力状况及骨髓功能,不适宜给予强烈的细胞毒药物治疗。结合现有临床资料,多线治疗可选化疗药物种类少,疗效不尽如人意。参考一项随机多中心的Ⅱ期临床试验(MITO-11),给予紫杉醇周疗法加或不加帕唑帕尼二线治疗铂耐药或晚期难治性卵巢癌,中位随访12.5月,其中周疗紫杉醇组PFS为3.5月,加帕唑帕尼组为6.3月,中位OS周疗紫杉醇组14.8月,加帕唑帕尼组18.7月。其结论认为紫杉醇联合帕唑帕尼可明显延长铂耐药或难治性晚期卵巢癌患者的PFS和OS[8]。我国亦有阿帕替尼联合化疗治疗晚期乳腺癌有效的报道[9]。有鉴于此,因帕唑帕尼尚未在中国上市,我们选择了阿帕替尼。结合2例患者既往化疗方案,我们选择单药拓扑替康化疗并调整为周疗法(1.2 mg/m2,口服,第1、8、15天,每4周重复),同时联合低剂量阿帕替尼(250 mg,1次/日)持续口服。8周后评价疗效,两位患者的肿瘤病灶均有所缩小,达到PR,同时肿瘤标记物CA125均大幅度下降,初步显示出阿帕替尼联合化疗在晚期卵巢癌中的应用前景。
阿帕替尼常见的不良反应包括血液学毒性(白细胞减少、粒细胞减少和血小板减少等)和非血液学毒性(高血压、蛋白尿、手足综合征、乏力和腹泻等)。大多数不良反应可以通过下调剂量、支持及对症处理以及暂停给药予以控制。本组患者出现的不良反应包括手足综合征、高血压、食欲下降和乏力等,经对症处理及阿帕替尼减量后,不良反应有所好转。其中,最主要的不良反应为高血压。本文中,病例1既往有高血压史,长期口服缬沙坦氢氯噻嗪片,血压维持在正常范围内,经服用阿帕替尼后,血压升高,加用硝苯地平后血压控制平稳。病例2出现3级手足皮肤反应,经减量并局部用药后缓解。值得一提的是,两例患者在第1周平稳治疗后,均从第2周开始增加阿帕替尼剂量至500 mg/d。但是加量后出现2级腹痛和3级血压增高,患者不能耐受,不得不减量或停药,最终恢复至250 mg/d,患者可以耐受,治疗得以延续。
综上所述,阿帕替尼联合化疗多线治疗晚期卵巢癌可能有效。但还有待于大规模的临床研究去证实,同时进一步摸索最佳联合药物及剂量,为临床提供一种有效的治疗方案。
| [1] | Liu D, Ha C, Zhang X, et al. Molecular implication of ADAM-15 and 17 in intrauterine adhesions[J]. Eur J ObstGyne Repro Biol, 2013, 170(1): 264–9. DOI:10.1016/j.ejogrb.2013.06.036 |
| [2] | NCCN Clinical Practice Guideline in Oncology (NCCN Guidelines®). Ovarian Cancer Including Fallopian Tube Cancer and Primary Peritoneal Cancer Version 1[EB/OL]. [2017-04-12] https://www.nccn.org/professionals/physician_gls/f_guidelines.asp#ovarian. |
| [3] | 李旭, 张翠翠, 谭红叶, 等. 甲磺酸阿帕替尼片治疗晚期非小细胞肺癌的临床效果观察[J]. 中国生化药物杂志, 2016, 36(2): 91–3. [ Li X, Zhang CC, Tan HY, et al. Clinical observation of Apa imatinib mesylate in treatment of advanced non-small cell lung cancer[J]. Zhongguo Sheng Hua Yao Wu Za Zhi, 2016, 36(2): 91–3. ] |
| [4] | 涂艳, 彭枫. 阿帕替尼治疗恶性肿瘤的临床研究进展[J]. 中国肿瘤临床, 2016, 43(12): 545–8. [ Tu Y, Peng F. Clinical research advances of apatinib in the treatment of malignancies[J]. Zhongguo Zhong Liu Lin Chuang, 2016, 43(12): 545–8. DOI:10.3969/j.issn.1000-8179.2016.12.304 ] |
| [5] | 宋锦添, 陈奕贵, 许春伟, 等. 阿帕替尼治疗53例晚期原发性肝癌的疗效[J]. 临床与病理杂志, 2017, 37(3): 557–63. [ Song JT, Chen YG, Xu CW, et al. The effect of apatinib treatment of 53 cases of advanced primary liver cancer[J]. Lin Chuang Yu Bing Li Za Zhi, 2017, 37(3): 557–63. DOI:10.3978/j.issn.2095-6959.2017.03.019 ] |
| [6] | 李玲, 张芳文, 南飞飞, 等. 阿帕替尼治疗难治性恶性肿瘤43例疗效观察[J]. 中华实用诊断与治疗杂志, 2017, 31(6): 594–6. [ Li L, Zhang FW, Nan FF, et al. Therapeutic effect of apatinib on refractory malignant tumor in 43 cases[J]. Zhonghua Shi Yong Zhen Duan Yu Zhi Liao Za Zhi, 2017, 31(6): 594–6. ] |
| [7] | 彭雨, 李海涛, 林大任, 等. 阿帕替尼治疗三线及三线以上晚期实体恶性肿瘤的临床疗效[J]. 包头医学院学报, 2017, 33(3): 8–9, 16. [ Peng Y, Li HT, Lin DR, et al. The clinical curative effect of apatinib treatment of three and more than three lines of advanced solid tumors[J]. Bao Tou Yi Xue Yuan Xue Bao, 2017, 33(3): 8–9, 16. ] |
| [8] | Pignata S, Lorusso D, Scambia G, et al. MITO-11: a randomized multicenter phase Ⅱ trial testing the addition of pazopanib to weekly paclitaxel in platinum-resistant or -refractory advanced ovarian cancer (AOC)[J]. J Clin Oncol, 2014, 32: 5e(suppl: abstr 5503). |
| [9] | 张月明, 徐海燕, 张凤春. 阿帕替尼联合治疗复发难治性乳腺癌: 2例病例报告及文献复习[J]. 肿瘤, 2017, 37(5): 518–23. [ Zhang YM, Xu HY, Zhang FC. Combined treatment with Apatinib for relapsed and refractory breast cancer: a report of 2 cases report and related literature review[J]. Zhong Liu, 2017, 37(5): 518–23. ] |
 2018, Vol. 45
2018, Vol. 45


