文章信息
- 低浓度阿司匹林通过活化ERK促进肺癌PC14细胞增殖
- Low Concentration of Aspirin Promotes Growth of Human Lung Cancer PC14 Cells Through Activating ERK Signaling
- 肿瘤防治研究, 2017, 44(12): 787-791
- Cancer Research on Prevention and Treatment, 2017, 44(12): 787-791
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2017.17.0671
- 收稿日期: 2017-06-12
- 修回日期: 2017-09-26
2. 121000 锦州,锦州医科大学护理学院;
3. 121000 锦州,锦州医科大学医学教育研究所
2. School of Nursing, Jinzhou Medical University, Jinzhou 121000, China;
3. Institute of Medical Education, Jinzhou Medical University, Jinzhou 121000, China
癌症仍然是世界上重要的公共健康问题,肺癌是一种非常常见的恶性肿瘤,随着我国工业化的不断发展,环境出现一定程度的恶化,肺癌的发病率和死亡率在过去十年里不断升高,严重地威胁着人类的生活质量[1]。阿司匹林可以说是人类历史上最常用的合成药物,最初是在19世纪末被开发和销售,主要用于治疗炎性反应性疾病,但其作用机制在20世纪后半叶仍然未知。自20世纪80年代末以来,小剂量阿司匹林一直是心血管疾病预防的基石,用于心血管疾病的一级和二级预防,防止血栓形成[2]。近年来,阿司匹林的抗肿瘤活性时常被报道[3],另外阿司匹林联合抗肿瘤药物也可以增强抗肿瘤活性[4],过去二十年的流行病学和临床资料均支持阿司匹林具有抗癌特性的假说,其机制包括阿司匹林通过抑制环氧合酶或对多重代谢的信号通路产生影响,以及通过抗血小板作用等达到抗癌效果[5-7]。阿司匹林的摄入对降低癌症风险有一定的作用,但其是否可以用作癌症患者的抗癌药物,直到最近才知道[8]。然而阿司匹林在肺癌上的作用鲜有报道,基于阿司匹林多年来在临床上应用的安全性以及近年来其抗肿瘤活性被不断报道,我们设想阿司匹林在肺癌上也能起到一定的治疗作用,因此观察阿司匹林对肺癌PC14细胞的影响,多次实验证明,阿司匹林在低浓度下有刺激肺癌PC14细胞增殖的作用。本研究拟探讨阿司匹林对肺癌细胞增殖的影响以及其作用机制。
促分裂原活化蛋白激酶(MAPK)信号途径参与细胞的生长、存活和死亡等过程。MAPK的成员ERK对细胞增殖和存活至关重要,并通过促有丝分裂刺激被激活,例如生长因子和细胞因子的刺激[9]。ERK的激活和过表达常见于多种癌细胞[10],例如,超过50%的急性骨髓性白血病和急性淋巴细胞白血病激活ERK途径[11]。与此同时,激活的ERK途径在肺癌细胞中也有报道[12]。
1 材料和方法 1.1 材料DMEM培养液、胎牛血清(FBS)购自美国赛默飞世尔科技公司;阿司匹林(临用前溶于终浓度<0.25%的DMSO)、二甲基亚砜(DMSO)、MTT和结晶紫均购自美国Sigma-Aldrich公司;PD98059(ERK抑制剂)购自MedChem Express公司(上海);青霉素-链霉素溶液(100×)、ECL化学发光显色液均购自北京索莱宝科技有限公司;ERK、p-ERK一抗均购自沈阳万类生物科技公司;HRP标记二抗购自美国Santa Cruz公司;人肺癌PC14细胞购自上海细胞库。
1.2 PC14和A549细胞培养和分组PC14细胞和A549细胞用含10%FBS(胎牛血清)的DMEM培养液培养,置于37℃、5%CO2培养箱中培养,0.25%EDTA胰酶消化细胞,每3天传代一次,取对数生长期细胞用于实验。实验分组:单药组为0.25%DMSO(对照组)以及不同浓度(1、2、4、8、16 mmol/L)阿司匹林处理组,抑制剂组为单药组基础上预先加入10 μmol/L PD98059。
1.3 MTT比色法检测阿司匹林对PC14细胞和A549细胞活力的影响采用MTT比色法检测阿司匹林对细胞活力的影响,取对数期生长的细胞接种于96孔板(每孔2 000个细胞),待贴壁后,以0.25%DMSO(对照组)及不同浓度(1、2、4、8、16 mmol/L)阿司匹林作用PC14及A549细胞48 h,同时设置抑制剂组作比较,随后加入MTT(5 mg/ml)溶液,置于37℃、5%CO2培养箱中培养4 h,弃去上清液,加入150 μl DMSO,在37℃环境中振摇10 min直到结晶充分溶解。用酶标仪(Bio-Rad)在波长570 nm处检测吸光度值, 用吸光度OD值作为检测单位。
1.4 阿司匹林及抑制剂PD98059对PC14细胞集落形成面积的影响将PC14细胞以每孔600个的量接种于12孔板,待细胞贴壁后以0.25% DMSO(对照组)及不同浓度阿司匹林作用细胞,并设置抑制剂组作比较,培养7天。4%多聚甲醛固定20 min,PBS洗3遍,结晶紫染色,Image J软件计算集落形成面积。
1.5 Western blot检测蛋白表达水平预冷的PBS洗细胞3次,加入RIPA细胞裂解液,临用前加入0.1%苯甲基磺酰氟(phenylmethanesulfonyl fluoride, PMSF)提取细胞总蛋白,BCA法测定蛋白浓度。取60 μg总蛋白进行聚丙烯酰胺凝胶电泳,待电泳完成后电转移至聚偏氟乙烯(polyvinylidene fluoride, PVDF)膜。用5%的BSA封闭2 h,加入待检测一抗4℃摇床过夜。TBST充分洗膜后,以HRP标记的二抗室温孵育2 h,TBST充分洗膜后化学发光法(enhanced chemi luminescence, ECL)显色。
1.6 统计学方法采用SPSS19.0进行数据分析。两组间比较用独立样本t检验,多组间比较用单因素方差分析。P<0.05为差异具有统计学意义。
2 结果 2.1 阿司匹林对PC14和A549细胞活力的影响与对照组相比,不同浓度阿司匹林处理PC14和A549细胞48 h后,MTT检测结果显示,随着阿司匹林剂量的增加,细胞活力先升高后降低,见图 1。
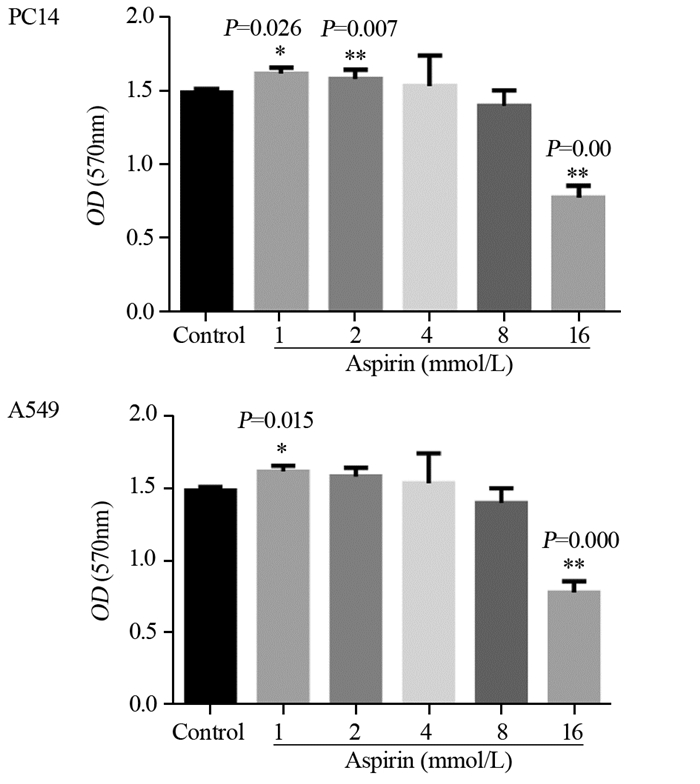
|
| x±s, n=6, *: P < 0.05, **: P < 0.01, compared with control group 图 1 不同浓度阿司匹林作用PC14和A549细胞48 h后对其活力的影响 Figure 1 Viabilities of PC14 and A549 cells after aspirin treatment at different concentrations for 48 h |
与对照组相比,不同浓度阿司匹林处理PC14细胞7d后,集落形成实验结果显示,浓度1~2 mmol/L集落形成面积增加,并且单个集落较大;4 mmol/L集落形成面积与对照组差异无统计学意义;8、16 mmol/L集落形成面积降低。16 mmol/L基本不形成集落,见图 2。
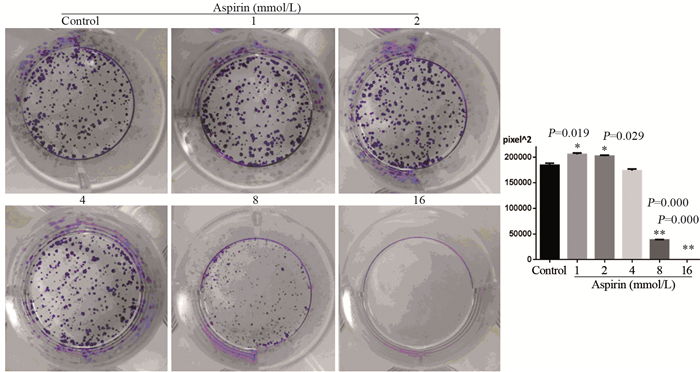
|
| x±s, n=3, *: P < 0.05, **: P < 0.01, compared with control group 图 2 不同浓度阿司匹林对PC14细胞7 d集落形成的影响 Figure 2 Colony formation of PC14 cells after aspirin treatment at different concentrations for 7 d |
PD98059抑制剂组与单药阿司匹林组相比,作用48 h后MTT检测结果显示,细胞活力增加,见图 3。而集落形成实验结果显示抑制剂组较单药阿司匹林组集落形成面积减小,单个集落较小,见图 4。
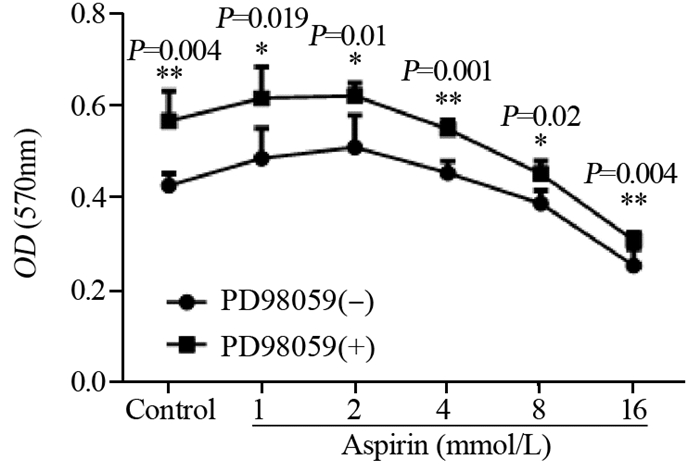
|
| x±s, n=6, *: P < 0.05, **: P < 0.01, single drug group vs. inhibitor group 图 3 48 h PD98059对不同浓度阿司匹林作用下PC14细胞活力的影响 Figure 3 Effect of PD98059 on viability of PC14 cells upon aspirin stimulation for 48 h |
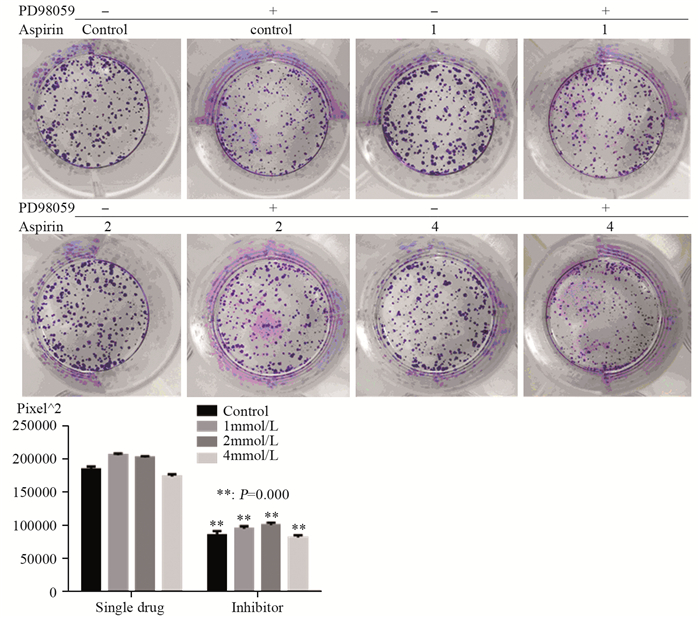
|
| x±s, n=3, **: P < 0.01, single drug group vs. inhibitor group 图 4 PD98059对阿司匹林作用下PC14集落形成的影响 Figure 4 Effect of PD98059 on colony formation of PC14 cells upon aspirin stimulation |
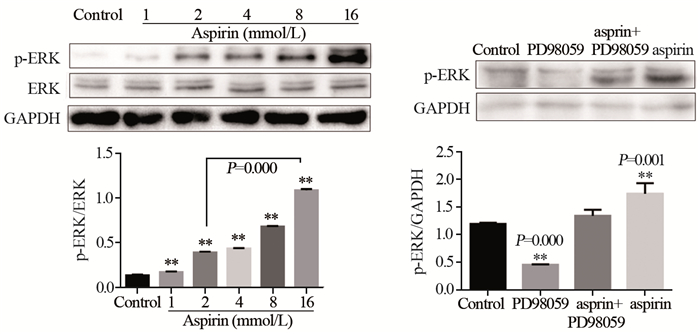
与对照组相比,不同浓度的阿司匹林处理PC14细胞24 h后,Western blot结果显示,PC14细胞ERK的表达未发生明显变化,而不同浓度的阿司匹林可显著增强磷酸化ERK(phospho-ERK)的表达,见图 5。
|
| x±s, n=3, **: P < 0.01, compared with control group 图 5 阿司匹林对PC14细胞ERK活化的影响 Figure 5 Effect of aspirin on activation of ERK in PC14 cells |
本研究结果显示,阿司匹林在低浓度时可以刺激肺癌PC14和A549细胞增殖,为了研究其机制,进行Western blot实验,结果显示不同浓度的阿司匹林可显著增强磷酸化ERK的表达。抑制剂组与单药组的MTT结果与集落形成实验结果虽有所不同,但间接反映了ERK在PC14细胞中的作用具有时间相关性,短时间内ERK表现为抑制细胞增殖,PD98059抑制剂通过抑制ERK而表现出促进细胞增殖的功能。随着时间推移,在时间较长的集落形成实验中,ERK表现出促进细胞增殖的能力,此时PD98059在集落实验组中通过抑制ERK而表现出抑制细胞增殖的能力。因此集落形成实验呈现出抑制剂组死细胞多、集落形成面积小的结果。
外界刺激通过MAPK/ERK途径的激活可能促进细胞增殖[13-14],也可能抑制细胞生长[15]。ERK及p-ERK的平衡在细胞增殖中起到重要作用,结合本实验,低浓度阿司匹林增强p-ERK表达,对细胞生长有促进作用,随着ERK活化形式表达过强,又反过来抑制细胞生长,提示不同浓度阿司匹林可能通过活化ERK途径对肺癌PC14细胞起到促增殖或抑生长的双重作用。
综上所述,本研究首次发现小剂量阿司匹林有促进肺癌细胞增殖的潜能,其机制与促进ERK活化有关。阿司匹林用于抑制血小板聚集,应用小剂量,50~150 mg,每24 h 1次;解热、镇痛,一次0.3~0.6 g,一日3次,必要时每4 h 1次;抗风湿,一日3~5 g(急性风湿热可用到7~8 g),分4次口服。有文献报道,健康志愿者服用25 mg阿司匹林血药浓度Cmax=1.49mg/ml[16],4 mmol/L阿司匹林(分子量:180)即为0.72 mg/ml,因此预防心脑血管疾病剂量的阿司匹林随着药物在体内代谢,会降到本文提到的小剂量阿司匹林浓度(4 mmol/L以下);此外,阿司匹林一次服药后1~2 h可达血药峰值。镇痛、解热时血药浓度为0.025~0.05 mg/ml;抗风湿、消炎时为0.15~0.30 mg/ml,以上浓度范围与研究涉及浓度有交叉,对于临床有一定参考意义。
本研究结果提示,对于肺癌与心血管共患病者,阿司匹林的使用可能存在导致癌症恶化的风险,结论有待进一步证实。
| [1] | Torre LA, Siegel RL, Jemal A. Lung Cancer Statistics[J]. Adv Exp Med Biol, 2016, 893: 1–19. DOI:10.1007/978-3-319-24223-1 |
| [2] | Kim J, Becker RC. Aspirin dosing frequency in the primary and secondary prevention of cardiovascular events[J]. J Thromb Thrombolysis, 2016, 41(3): 493–504. DOI:10.1007/s11239-015-1307-2 |
| [3] | 刘国华, 陈燕明, 冯一中. 阿司匹林抑制肺癌细胞增殖的实验研究[J]. 肿瘤防治研究, 2005, 32(11): 695–8. [ Liu GH, Chen YM, Feng YZ. Experimental Study on Inhibitive Effecs of Aspirin on the Proliferation of Human Lung Cancer Cells[J]. Zhong Liu Fang Zhi Yan Jiu, 2005, 32(11): 695–8. ] |
| [4] | 刘国华, 黄建安. 阿司匹林对肺癌细胞增殖的影响及机制探讨[J]. 肿瘤防治杂志, 2005, 12(11): 824–8. [ Liu GH, Huang JA. Influence of aspirin on proliferation of human lung cancer cells and it mechanism[J]. Zhong Liu Fang Zhi Za Zhi, 2005, 12(11): 824–8. DOI:10.3969/j.issn.1673-5269.2005.11.007 ] |
| [5] | Di Francesco L, López Contreras LA, Sacco A, et al. New Insights into the Mechanism of Action of Aspirin in the Prevention of Colorectal Neoplasia[J]. Curr Pharm Des, 2015, 21(35): 5116–26. DOI:10.2174/1381612821666150915110706 |
| [6] | Usman MW, Luo F, Cheng H, et al. Chemopreventive effects of aspirin at a glance[J]. Biochim Biophys Acta, 2015, 1855(2): 254–63. |
| [7] | Yang G, Wang Y, Feng J, et al. Aspirin suppresses the abnormal lipid metabolism in liver cancer cells via disrupting an NFkappaB-ACSL1 signaling[J]. Biochem Biophys Res Commun, 2017, 486(3): 827–32. DOI:10.1016/j.bbrc.2017.03.139 |
| [8] | Pasche B, Wang M, Pennison M, et al. Prevention and treatment of cancer with aspirin: where do we stand?[J]. Semin Oncol, 2014, 41(3): 397–401. DOI:10.1053/j.seminoncol.2014.04.012 |
| [9] | Sever R, Brugge JS. Signal transduction in cancer[J]. Cold Spring Harb Perspect Med, 2015, 5(4): a006098. DOI:10.1101/cshperspect.a006098 |
| [10] | Dhillon AS, Hagan S, Rath O, et al. MAP kinase signalling pathways in cancer[J]. Oncogene, 2007, 26(22): 3279–90. DOI:10.1038/sj.onc.1210421 |
| [11] | McCubrey JA, Steelman LS, Chappell WH, et al. Roles of the Raf/MEK/ERK pathway in cell growth, malignant transformation and drug resistance[J]. Biochim Biophys Acta, 2007, 1773(8): 1263–84. DOI:10.1016/j.bbamcr.2006.10.001 |
| [12] | Yamakawa K, Yokohira M, Nakano Y, et al. Activation of MEK1/2-ERK1/2 signaling during NNK-induced lung carcinogenesis in female A/J mice[J]. Cancer Med, 2016, 5(5): 903–13. DOI:10.1002/cam4.2016.5.issue-5 |
| [13] | Li T, Zhang C, Ding Y, et al. Umbilical cord-derived mesenchymal stem cells promote proliferation and migration in MCF-7 and MDA-MB-231 breast cancer cells through activation of the ERK pathway[J]. Oncol Rep, 2015, 34(3): 1469–77. DOI:10.3892/or.2015.4109 |
| [14] | 张颖, 胡舜英, 尹彤. 利拉鲁肽通过PI3K/Akt和MAPK/ERK通路促进心肌微血管内皮细胞的增殖和迁移[J]. 南方医科大学学报, 2015, 35(9): 1221–6. [ Zhang Y, Hu SY, Yin T, et al. Liraglutide promotes proliferation and migration of cardiac microvascular endothelial cells through PI3K/Akt and MAPK/ERK signaling pathways[J]. Nan Fang Yi Ke Da Xue Xue Bao, 2015, 35(9): 1221–6. ] |
| [15] | Zhang YN, Wu XY, Zhong N, et al. Stimulatory effects of sorafenib on human nonsmall cell lung cancer cells in vitro by regulating MAPK/ERK activation[J]. Mol Med Rep, 2014, 9(1): 365–9. DOI:10.3892/mmr.2013.1782 |
| [16] | 周燕文, 陈丽, 兰聪贤. 人血浆中水杨酸的测定及阿司匹林的人体药物动力学研究[J]. 华西药学杂志, 2008, 23(5): 572–4. [ Zhou YW, Chen L, Lan CX. Determination of salicylic acid in plasma by HPLC-FLU and pharmacokinetics of aspirin In healthy volunteers[J]. Hua Xi Yao Xue Za Zhi, 2008, 23(5): 572–4. ] |
 2017, Vol. 44
2017, Vol. 44


