文章信息
- 金丝桃苷诱导人胃癌细胞MKN-45凋亡及其机制
- Hyperoside Induces Apoptosis of Gastric Cancer Cell Line MKN-45 and Related Mechanism
- 肿瘤防治研究, 2017, 44(12): 792-795
- Cancer Research on Prevention and Treatment, 2017, 44(12): 792-795
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2017.17.0461
- 收稿日期: 2017-04-27
- 修回日期: 2017-08-09
2. 121000 锦州,锦州医科大学附属第一医院消化内科
2. Department of Gastroenterology, First Affiliated Hospital of Jinzhou Medical University, Jinzhou 121000, China
胃癌是一种发病率和病死率均较高的恶性肿瘤,最近一项研究显示,在已确诊的950 000例胃癌的新病例中,每年有超过720 000人死亡[1]。胃癌的治疗方式主要为手术切除及术后化疗,但患者术后复发率和转移率较高,化疗药物存在很多不良反应,因此,新的抗癌药物的研发一直是发展趋势。
金丝桃苷(hyperoside, Hyp)属黄酮类化合物, 又名槲皮素3-O-β-半乳糖苷,是贯叶金丝桃的主要活性成分,具有抗氧化、抗炎、抗血栓等多种生理活性[2]。近年来国内外研究发现金丝桃苷具有抗结肠癌、肺癌、胰腺癌等肿瘤细胞的作用,其机制是通过抑制凋亡通路来实现的[3],但对Hyp抗胃癌细胞的研究较少。本实验旨在探讨Hyp对胃癌MKN-45细胞株在体外增殖、凋亡的影响及其机制,进一步探讨Hyp的抗肿瘤作用。
1 材料与方法 1.1 实验材料人MKN-45胃癌细胞株(上海生科院细胞资源中心)、DMEM培养液、胎牛血清(美国Gibco公司)、Hyp(南京春秋生物科技公司)、MTT(美国Sigma公司)、Annexin V-FITC/PI双染法细胞凋亡试剂盒(美国BD公司)、NF-κB P65、caspase-3、Bax、Bcl-2抗体(英国Abcam公司)。
1.2 细胞培养将MKN-45胃癌细胞株置于含10%胎牛血清、100 µg/ml青霉素/链霉素双抗溶液和10 µg/ml环丙沙星的高糖DMEM培养液中,于37℃、5%CO2饱和湿度的培养箱中培养,胰蛋白酶消化,每2~3天传代一次并观察细胞的变化。
1.3 MTT法检测Hyp对MKN-45细胞增殖的影响取对数生长期的MKN-45细胞悬液200 µl,分别以每孔1×104接种于96孔板中,细胞培养24 h后加入药物。实验分组:Hyp(12.5、25、50、100、200 µg/ml)作用于MKN-45细胞,对照组为不加药物。每个剂量设5个复孔,加药后分别培养24和48 h,随后每孔加入MTT 20 µl,放入培养箱继续培养4 h,吸弃培养液,每孔加150 µl二甲基亚砜(DMSO),避光振荡10 min,以使结晶物充分融解,用酶标仪(490 nm)测定各孔的吸光度OD值,计算每组细胞的增殖率,并绘制折线图 1。
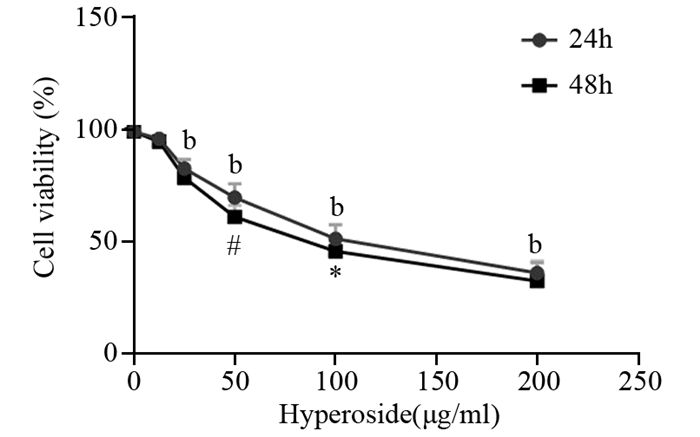
|
| *: P < 0.05, #: P < 0.01, compared with the same concentration of hyperoside; b: P < 0.01, compared with control group 图 1 不同浓度Hyp作用不同时间后对MKN-45细胞增殖率的影响 Figure 1 Proliferation of gastric cancer cells MKN-45 treated with hyperoside at various concentrations for 24 and 48h |
分别收集对照组及经25、50、100 µg/ml Hyp处理48 h后的MKN-45细胞,预冷PBS洗涤细胞2次,70%冷乙醇固定过夜。取1 ml各组细胞悬液(调整其细胞浓度为5×105/ml),分别加50 mg/ml RNaseA和PI染液,37℃温育30 min,然后上流式细胞仪进行周期分析。
1.5 流式细胞术检测Hyp对MKN-45细胞凋亡的影响采用Annexin V-FITC/PI双染法检测细胞的凋亡率,分别收集对照组和经25、50、100 µg/ml Hyp作用48 h的MKN-45细胞,调整细胞密度,按说明处理细胞:PBS洗细胞2次;收集5×105个细胞,加入500 µl Bingding Buffer重悬细胞;分别加入5 µl Annexin V-FITC和PI室温避光染色15 min,流式细胞仪检测,分析凋亡率。
1.6 Western blot法检测NF-κB P65、caspase-3、Bcl-2、Bax蛋白水平以浓度为25、50、100 µg/ml的Hyp分别处理细胞48 h,胰酶消化后收集细胞(>5×106/ml),置于冰上;RIPA溶液裂解蛋白,BCA蛋白定量,转膜,TBST洗膜,5%脱脂牛奶封闭1 h后加一抗4℃孵育过夜,TBST漂洗3次,每次5 min,加入二抗,摇床摇动2 h,显影及定影,使用Image-J软件,定量分析扫描图片中的电泳条带灰度值。
1.7 统计学方法采用SPSS 19.0软件进行单因素方差分析,实验结果以(x±s)表示,P<0.05为差异有统计学意义。
2 结果 2.1 不同浓度Hyp作用后对胃癌细胞MKN-45增殖的影响作用相同时间,随着药物浓度的增加,Hyp对MKN-45细胞生长的抑制力增强。低浓度Hyp(12.5 µg/ml)作用细胞24和48 h后,与对照组相比,差异无统计学意义(P=0.178、P=0.135),25、50、100、200 µg/ml Hyp分别作用细胞24和48 h后,与对照组相比,各组间相比差异均有统计学意义(P=0.000),见图 1。
2.2 不同浓度Hyp对细胞周期的影响不同浓度的Hyp作用于胃癌MKN-45细胞48 h后,随着药物浓度的增加,G0/G1期比率明显增加,S和G2/M期明显减少,与对照组相比,差异有统计学意义,见图 2。
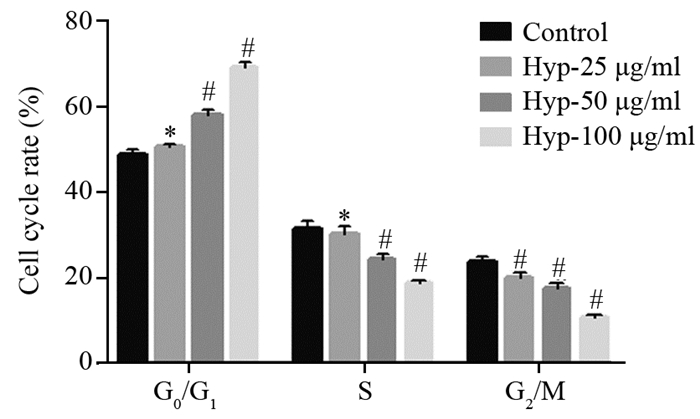
|
| *: P < 0.05, compared with control group; #: P < 0.01, compared with control group; n=5 图 2 48 h后不同浓度Hyp对MKN-45细胞周期分布的影响 Figure 2 Cell cycle of gastric cancer cells MKN-45 treated with hyperoside at various concentrations after 48h in vitro |
不同浓度的Hyp作用MKN-45细胞48 h后,其凋亡率随着药物浓度的增加而增加。100 µg/ml Hyp作用48 h后,细胞凋亡率由对照组的(4.63±0.65)%升高至(35.23±0.58)%,差异有统计学意义(P=0.000)。由此可见,Hyp可诱导MKN-45细胞的凋亡,并且呈剂量依赖性,见图 3。
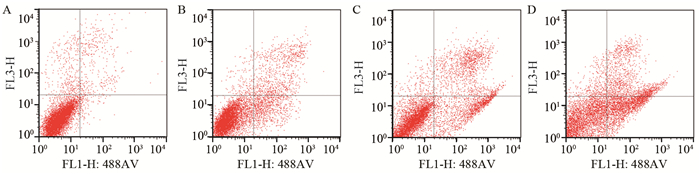
|
| A: control group; B: Hyp (25μg/ml) group; C: Hyp (50μg/ml) group; D: Hyp (100μg/ml) group 图 3 48 h后不同浓度Hyp组对细胞凋亡率的影响 Figure 3 Apoptosis of gastric cancer cells MKN-45 treated with hyperoside at various concentrations after 48h in vitro |
用25 µg/ml Hyp处理MKN-45细胞48 h后,通过Western blot法检测相关蛋白表达。Caspase-3(P=0.000)、Bax(P=0.006)表达明显上升,NF-κB P65(P=0.026)、Bcl-2(P=0.013)表达量降低,随着药物浓度的增加差异越显著,见图 4。

|
| 1: control group; 2: Hyp (25μg/ml) group; 3: Hyp (50μg/ml) group; 4: Hyp (100μg/ml) group 图 4 48 h后不同浓度Hyp对NF-κB P65、casepase-3、Bax、Bcl-2蛋白表达的影响 Figure 4 Expressions of NF-κB P65, casepase-3, Bax and Bcl-2 protein treated with hyperoside at various concentrations after 48h |
在我国,胃癌的发病率日益增长,现有抗癌药物存在不良反应大及耐药性等问题,新药的研发一直是热点,而我国传统中药的抗癌研究已成为重点之一[4]。近年来,有研究表明黄酮类中药金丝桃苷在抗肿瘤方面有较好疗效,但因研究较少,对于一些肿瘤并未涉及且治疗机制仍需进一步研究。
目前,探讨肿瘤细胞凋亡是药物研究的趋势,细胞凋亡不同于细胞坏死,是一种基因调控下细胞自主的有序死亡过程,在维持内环境中发挥了重要作用。细胞凋亡的失调与肿瘤的发生、发展及退化密切相关。诱导细胞凋亡,已成为阻止癌细胞生长和发展的有效途径之一[5]。阻滞细胞周期是抑制肿瘤生长的重要原因之一,细胞周期的正常运转受到多个调控点的作用,若药物可作用于某调控点,阻滞细胞周期,可使细胞终止分裂。孙时华等[6]研究发现,胃癌细胞BGC-823经一定浓度金丝桃苷作用后,细胞在G0/G1期被阻滞,从而抑制细胞增殖,细胞凋亡率也由对照组的3.66%增至53.48%;Zhang等[7]研究显示,经一定浓度金丝桃苷处理后的骨肉瘤细胞,增殖率下降,并在G0/G1期出现停滞,且发生明显的凋亡现象。本研究发现,不同浓度金丝桃苷处理胃癌MKN-45细胞后,随着药物浓度的增加,G0/G1期细胞百分率不断增加,使癌细胞停滞于G0/G1期,从而达到抗肿瘤的目的。
Bcl-2家族是迄今为止研究最多的凋亡基因组之一,它在滤泡性淋巴瘤的癌基因中首次被提出,并已被证明可抑制细胞凋亡[8]。Bcl-2家族蛋白分为抗凋亡蛋白Bcl-2、Bcl-xL和促凋亡蛋白Bax、Bak。Bcl-2基因是细胞凋亡的重要负调控因子,一方面它通过抑制细胞凋亡延长肿瘤细胞存活时间,另一方面,Bax可加速死亡信号传递。尽管Bcl-2家族如何精确地调控细胞凋亡尚不明确,但大量研究表明,Bcl-2可通过调节ER和线粒体之间Ca2+的平衡,抑制Cyt-c从线粒体释放,从而抑制细胞凋亡[9]。Bcl-2家族蛋白的表达已在人类多种恶性肿瘤中被报道,有研究显示Bcl-2家族蛋白的表达可预测胃癌患者的预后[10];近期Boukes等[11]发现,在体内外实验中,金丝桃苷均可以通过抑制Bcl-2家族基因来抑制胰腺癌的增殖并促进其凋亡,本研究结果显示,胃癌细胞MKN-45经一定浓度金丝桃苷处理后,Bcl-2家族蛋白的表达发生变化,促凋亡蛋白Bax表达增加,抗凋亡蛋白Bcl-2表达降低,最终诱导其凋亡,验证了金丝桃苷的抗肿瘤作用。
核因子κB(NF-κB)是一种具有多种功能的转录因子,对多种肿瘤的发展至关重要。NF-κB参与癌细胞转化的很多过程,在诱发基因抗凋亡、血管生成、癌细胞的转移和扩散中均扮演着重要的作用[12]。通过磷酸化触发IκB的降解,使游离的NF-κB进入细胞核暴露其核识别位点,从而促进NF-κB调控基因的转录,减少相关蛋白的表达。凋亡过程受到多个通路和基因调控,最后多条通路可共同激活caspase-3,因此,caspase-3的检测是提供细胞凋亡的有利证据。caspase-3作为蛋白酶级联过程中的中心节点,NF-κB也能直接抑制caspase-3的活化,从而抑制caspase-3下游一系列的反应,最终抑制肿瘤细胞凋亡[13]。目前,大量文献已阐明,阻断NF-κB通路可抑制胃癌细胞的增殖并诱导其凋亡,如姜黄素[14]、槲皮素[15]和厚朴酚[16]等抑制相关癌细胞的凋亡均可通过抑制NF-κB信号通路来实现。近几年,Liu等[17]研究显示,金丝桃苷可通过抑制NF-κB通路,上调caspase-3促进肺腺癌细胞A的凋亡。Li等[18]发现,金丝桃苷通过抑制NF-κB通路,抑制胰腺癌细胞PANC-1和BxPC-3的增殖,并促进其凋亡。多年前,王维等[19]研究表明,胃癌患者中NF-κB P65蛋白的表达明显高于健康者,随着胃癌恶性程度的增加,P65蛋白的表达明显增加,因此P65蛋白的分析在胃癌的研究中有重要意义。本研究的细胞凋亡结果显示,金丝桃苷可能通过阻断NF-κB通路,抑制NF-κB P65蛋白的表达,上调caspase-3,促进细胞凋亡有关,但具体阻断NF-κB信号通路的方式还需进一步研究。
综上所述,体外培养MKN-45胃癌细胞株接受金丝桃苷这种来自黄酮类化合物的传统中药治疗,肿瘤细胞被抑制并促进其凋亡,机制可能与其抑制NF-κB通路及调控Bcl-2家族蛋白表达,下调NF-κB P65及Bcl-2蛋白,上调casepase-3及Bax蛋白有关。此研究说明金丝桃苷可能成为前景很好的预防及治疗胃癌的药物,未来的研究应该确定金丝桃在体内诱导分化胃癌细胞的活性,这还需进行进一步动物实验及临床研究来验证,本研究仍存在不足,具体抗肿瘤机制需不断探索,为临床应用提供新的治疗方案。
| [1] | Katona BW, Rustgi AK. Gastric Cancer Genomics: Advances and Future Directions[J]. Cell Mol Gastroenterol Hepatol, 2017, 3(2): 211–7. DOI:10.1016/j.jcmgh.2017.01.003 |
| [2] | Yang B, Yang Q, Yang X, et al. Hyperoside protects human primary melanocytes against H2O2-induced oxidative damage[J]. Mol Med Rep, 2016, 13(6): 4613–9. DOI:10.3892/mmr.2016.5107 |
| [3] | 代培培, 陈剑群. 金丝桃苷抗肿瘤和免疫调节作用的研究进展[J]. 医学综述, 2014, 20(11): 1979–81. [ Dai PP, Chen JQ. Research progress of anti-tumor effects and immunomodulatory effects of hyperoside[J]. Yi Xue Zong Shu, 2014, 20(11): 1979–81. DOI:10.3969/j.issn.1006-2084.2014.11.025 ] |
| [4] | Zhang YS, Shen Q, Li J. Traditional Chinese medicine targeting apoptotic mechanisms for esophageal cancer therapy[J]. Acta Pharmacol Sin, 2016, 37(3): 295–302. DOI:10.1038/aps.2015.116 |
| [5] | Misra A, Rai S, Misra D. Functional role of apoptosis in oral diseases: An update[J]. J Oral Maxillofac Pathol, 2016, 20(3): 491–6. DOI:10.4103/0973-029X.190953 |
| [6] | 孙时华, 姜荣华, 祝海燕, 等. 金丝桃苷体外抗胃癌作用及其机制研究[J]. 中国临床药理学与治疗学, 2014, 19(9): 979–83. [ Sun SH, Jiang RH, Zhu HY, et al. Hyperoside anti gastric cancer in vitro and its mechasim[J]. Zhongguo Lin Chuang Yao Li Xue Yu Zhi Liao Xue, 2014, 19(9): 979–83. ] |
| [7] | Zhang N, Ying MD, Wu YP, et al. Hyperoside, a flavonoid compound, inhibits proliferation and stimulates osteogenic differentiation of human osteosarcoma cells[J]. PLoS One, 2014, 9(7): e98973. DOI:10.1371/journal.pone.0098973 |
| [8] | Korsmeyer SJ. Bcl-2 initiates a new category of oncogenes: regulators of cell death[J]. Blood, 1992, 80(4): 879–86. |
| [9] | Ashkenazi A, Fairbrother WJ, Leverson JD, et al. From basic apoptosis discoveries to advanced selective BCL-2 family inhibitors[J]. Nat Rev Drug Discov, 2017, 16(4): 273–84. DOI:10.1038/nrd.2016.253 |
| [10] | Cheng H, Wang X, Li T, et al. Bcl-2 expression and patient survival in gastric cancer: a systematic review of the literature with meta-analysis[J]. Med Oncol, 2015, 32(1): 389. DOI:10.1007/s12032-014-0389-6 |
| [11] | Boukes GJ, van de Venter M. The apoptotic and autophagic properties of two natural occurring prodrugs, hyperoside and hypoxoside, against pancreatic cancer cell lines[J]. Biomed Pharmacother, 2016, 83: 617–26. DOI:10.1016/j.biopha.2016.07.029 |
| [12] | Sen R, Baltimore D. Multiple nuclear factors interact with the immunoglobulin enhancer sequences[J]. Cell, 1986, 4646(55): 705–16. |
| [13] | Li L, Aggarwal BB, Shishodia S, et al. Nuclear factor-kappaB and IkappaB kinase are constitutively active in human pancreatic cells, and their down-regulation by curcumin (diferuloylmethane) is associated with the suppression of proliferation and the induction of apoptosis[J]. Cancer, 2004, 101(10): 2351–62. DOI:10.1002/(ISSN)1097-0142 |
| [14] | Dai C, Li B, Zhou Y, et al. Curcumin attenuates quinocetone induced apoptosis and inflammation via the opposite modulation of Nrf2/HO-1 and NF-κB pathway in human hepatocyte L02 cells[J]. Food Chem Toxicol, 2016, 95: 52–63. DOI:10.1016/j.fct.2016.06.025 |
| [15] | Lee DH, Nam YJ, Lee CS. Quercetin-3-O-(2″-galloyl)-α-L-rhamnopyranoside attenuates cholesterol oxidation product-induced apoptosis by suppressing NF-κB-mediated cell death process in differentiated PC12 cells[J]. Naunyn Schmiedebergs Arch Pharmacol, 2015, 388(8): 869–81. DOI:10.1007/s00210-015-1120-7 |
| [16] | Ou HC, Chou FP, Sheu WH, et al. Protective effects of magnolol against oxidized LDL-induced apoptosis in endothelial cells[J]. Arch Toxicol, 2007, 81(6): 421–32. DOI:10.1007/s00204-006-0172-3 |
| [17] | Liu YH, Liu GH, Mei JJ, et al. The preventive effects of hyperoside on lung cancer in vitro by inducing apoptosis and inhibiting proliferation through Caspase-3 and P53 signaling pathway[J]. Biomed Pharmacother, 2016, 83: 381–91. DOI:10.1016/j.biopha.2016.06.035 |
| [18] | Li Y, Wang Y, Li L, et al. Hyperoside induces apoptosis and inhibits growth in pancreatic cancer via Bcl-2 family and NF-κB signaling pathway both in vitro and in vivo[J]. Tumour Biol, 2016, 37(6): 7345–55. DOI:10.1007/s13277-015-4552-2 |
| [19] | 王维, 罗和生, 余保平. 人胃癌及癌前病变中NF-KappaB和c-myc蛋白的表达与意义[J]. 肿瘤防治研究, 2002, 29(4): 285–7. [ Wang W, Luo HS, Yu BP. Expression of NF-KappaB and c-myc protein in gastric carcinogenesis[J]. Zhong Liu Fang Zhi Yan Jiu, 2002, 29(4): 285–7. ] |
 2017, Vol. 44
2017, Vol. 44


