文章信息
- miRNA-302b在结肠癌HT-29细胞“干性”维持中的作用
- Effect of miRNA-302b on "Stemness" Maintaining of Colon Cancer HT-29 Cells
- 肿瘤防治研究, 2017, 44(8): 515-519
- Cancer Research on Prevention and Treatment, 2017, 44(8): 515-519
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2017.17.0420
- 收稿日期: 2017-04-18
- 修回日期: 2017-05-24
肿瘤干细胞(cancer stem cells, CSCs),是指肿瘤细胞中代表着“种子”和“源头”的一小群细胞,与肿瘤的形成进展、侵袭转移、治疗抵抗和术后复发等密切相关,是目前肿瘤研究的热点之一。目前,人们已经成功分离和培养了结肠癌干细胞,并且发现它们有一些特征性“干性”标志物:Ascl2、Lgr5、Oct4、Sox2、CD133和CD44等[1-4]。
微小RNAs(microRNAs, miRNAs)是一类小分子非编码RNA,大小约22 nt,通过结合mRNA的3’非编码区,使基因表达在转录后沉默。miRNAs与CSCs关系密切,在其维持“干性”、调节分化等过程中发挥着非常重要的作用[5]。鉴于此,本课题组将miRNA-302b mimics转染入HT-29细胞,检测多个结肠癌“干性”标志物(Lgr5、Ascl2、Oct4和Sox2)的表达,同时观察细胞克隆形成和干细胞成球情况,以期进一步阐明miRNA-302b在结肠癌“干性”维持中的作用及机制。
1 材料与方法 1.1 材料人结肠癌细胞株HT-29由第三军医大学消化实验室/全军消化病研究所馈赠;超低黏附24孔板购自美国Corning公司;DMEM/F12培养液购自美国Hyclone公司;EGF和bFGF购自美国Peprotech公司;B27购自美国Gibco公司;LipofectamineTM 2000购自美国Invitrogen公司;miRNA-mimics购自广州锐博生物科技有限公司;荧光定量PCR试剂盒购自大连TaKaRa公司;Ascl2和Lgr 5一抗购自美国Abcam公司;Oct4和Sox2一抗购自北京博奥森生物技术有限公司;二抗和ECL发光剂购自北京全式金生物科技有限公司;吉姆萨染色液购于上海馨晟试化工科技有限公司。
1.2 方法 1.2.1 细胞的培养结肠癌HT-29细胞培养于含10%胎牛血清的RPMI 1640培养液,静置于5% CO2、37℃培养箱,采用0.02% EDTA-0.25%胰蛋白酶混合液进行消化传代。
1.2.2 miRNA-mimics转染实验取对数生长期的HT-29细胞消化为单细胞悬液,以4×105个/孔接种至6孔板,24 h后进行miRNA-302b mimics和NC-mimics的转染,将实验分为control组(未转染mimics)、NC-mimics组和miR-302b mimics组。严格按说明书进行转染操作,48 h后收集细胞,进行后续实验。
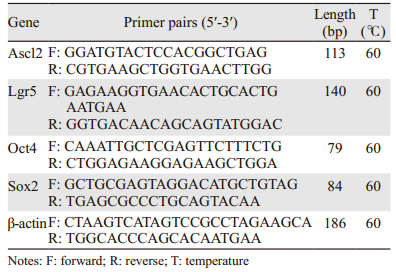
1.2.3 Real-timePCR检测结肠癌“干性”标志物Ascl2、Lgr5、Oct4和Sox2 mRNA表达情况转染HT-29细胞48 h收集标本,按TRIzol试剂盒操作说明提取总RNA,并进行RNA浓度和纯度的测定。由上海生工生物工程有限公司合成的PCR引物见表 1。反转录总反应体系为20 μl,反应条件为:37℃ 15 min,85℃ 5 s,4℃保持。扩增反应总体系20 μl,反应条件为:95℃ 3 min,95℃ 10 s,60℃ 30 s(共39个循环),65℃~95℃ 0.05 s。采用相对定量法(2-ΔΔCT法)进行结果分析处理,计算mRNA相对表达量。实验重复3次。
转染HT-29细胞48 h收集标本,加入RIPA裂解液提取总蛋白,采用BCA试剂盒行蛋白定量,然后配胶、上样、电泳、电转、封闭、加一抗(Ascl2: 1:1 000,Lgr5: 1:1 000,Oct4: 1:500,Sox2: 1:500),4℃过夜、洗涤、加相应二抗(1:5 000)、显色、分析结果,采用Image-plus软件测定灰度值,将目的蛋白/β-actin的校准值进行最后统计。实验重复3次。
1.2.5 克隆形成实验检测细胞克隆形成能力差异情况将control、NC-mimics和miR-302b mimics组细胞各自消化为单细胞悬液,以1 000个/皿接种于直径35 mm的培养皿,培养20天,使用吉姆萨染色,观察、拍照、计数,每组设3个重复,每皿计数3次,取平均值。
1.2.6 干细胞成球实验检测细胞球形成能力差异情况将control、NC-mimics和miR-302b mimics组细胞各自消化为单细胞悬液,接种于24孔超低黏附细胞培养板,1 000个/孔,每3天半量换液(干细胞成球培养液的配置:无血清、不含双抗的DMEM/F12培养液98 ml;EGF 2 μg;bFGF 2μg,B27 2 ml),培养10天,观察、拍照,计数细胞球,每组设5个重复,每孔计数3次,取平均值。
1.3 统计学方法实验数据按完全随机对照设计的要求进行收集整理,以均数±标准差(x±s)表示,采用SPSS16.0统计学软件包予以处理,组间比较采用单因素方差分析,P < 0.05为差异有统计学意义。
2 结果 2.1 miRNA-302b mimics上调HT-29细胞结肠癌“干性”标志物Ascl2、Lgr5、Oct4和Sox2 mRNA的表达Real-time PCR结果显示,miRNA-302b mimics转染HT-29细胞48 h,结肠癌“干性”标志物Ascl2、Lgr5、Oct4和Sox2 mRNA表达出现一致性上调,与control组和NC-mimics组相比差异均有统计学意义(均P < 0.001),而control组与NC-mimics组相比差异无统计学意义(均P > 0.05),见图 1。
|
| *P < 0.001, compared with control and NC-mimics groups 图 1 miRNA-302b mimics对HT-29细胞“干性”标志物mRNA表达的影响 Figure 1 Effects of miRNA-302b mimics on mRNA expressions of "stemness" markers in HT-29 cells |
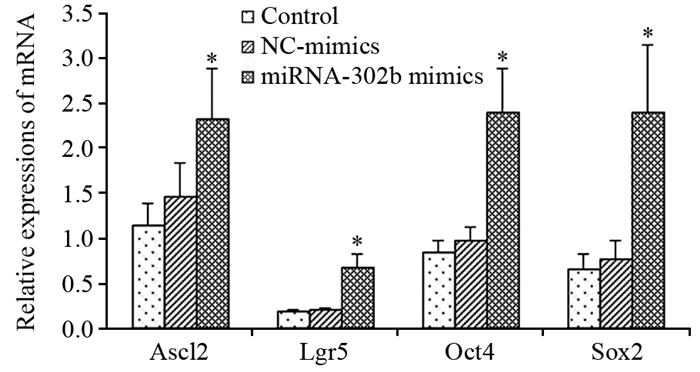
Western blot结果显示,miRNA-302b mimics转染HT-29细胞48 h,结肠癌“干性”标志物Ascl2、Lgr5、Oct4和Sox2蛋白表达均上调,与control组和NC-mimics组比较,差异均有统计学意义(均P < 0.01),control组与NC-mimics组比较差异无统计学意义(均P > 0.05),见图 2。
|
| 图 2 miRNA-302b mimics对HT-29细胞“干性”标志蛋白表达的影响 Figure 2 Effects of miRNA-302b mimics on protein expressions of "stemness" markers in HT-29 cells |
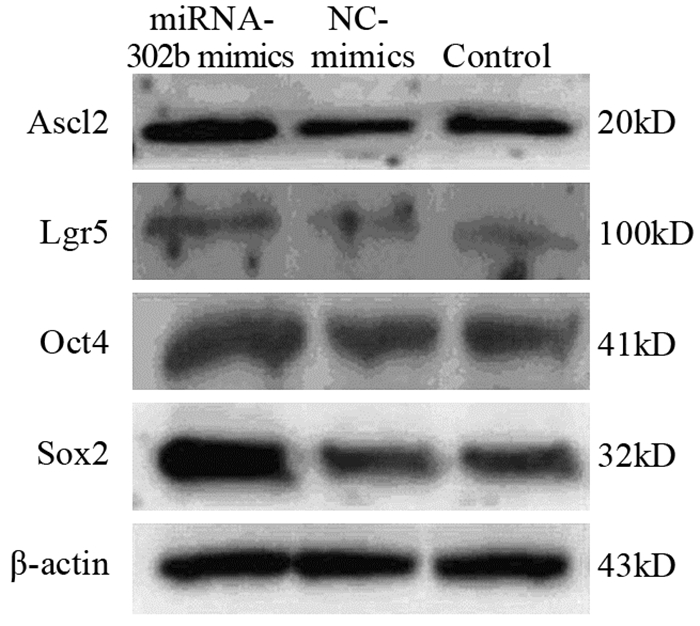
克隆形成实验结果显示,miRNA-302b mimics转染组克隆形成数明显多于control组和NC-mimics转染组,差异有统计学意义(F=141.30, P < 0.001),见图 3。
|
| *: P < 0.001, compared with control and NC-mimics groups 图 3 miRNA-302b mimics对HT-29细胞克隆形成能力的影响 Figure 3 Effects of miRNA-302b mimics on clone formation ability of HT-29 cells |
干细胞成球实验结果显示,miRNA-302b mimics转染组所形成的细胞球数量及每个细胞球所含细胞数均明显多于control组和NC-mimics转染组,差异有统计学意义(F=25.87, P < 0.001; F=72.48, P < 0.001),见图 4。
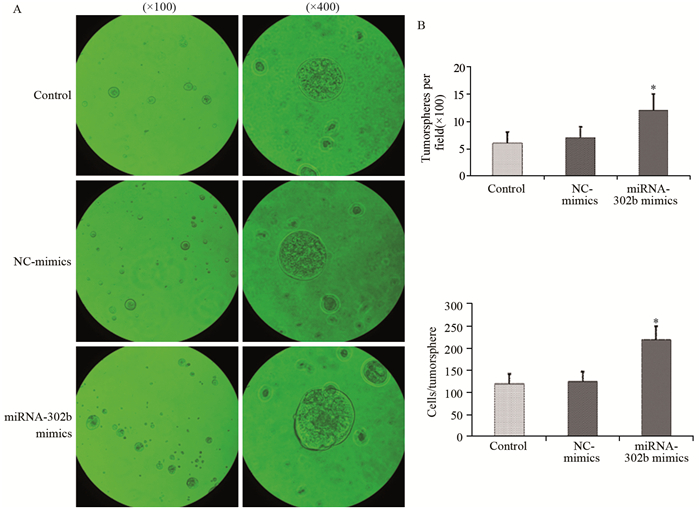
|
| *: P < 0.001, compared with control and NC-mimics groups 图 4 miRNA-302b mimics对HT-29细胞球形成能力的影响 Figure 4 Effects of miRNA-302b mimics on sphere formation ability of HT-29 cells |
结肠癌的发病率与死亡率居高不下,发生、转移和复发均难以解决[6]。学者们近来提出了CSCs理论,认为要从根本上消除结肠癌,需针对作为种子和根源的CSCs。然而,CSCs的特性及调控均相当复杂,经过学者们的努力,目前已经成功分离和培养了结肠癌干细胞,并且发现它们具有一些特征性的“干性”标志物(Ascl2、Lgr5、Oct4和Sox2等),这些标志物不仅作为标记,而且对CSCs自我更新、维持“干性”、致瘤成瘤、转移复发等均发挥着极其重要的作用[1-3]。
Ascl2和Lgr5均是成体肠隐窝干细胞公认的标志物[7-8],正常情况下在肠道的表达仅限于隐窝干细胞,当它们发生表达和调控紊乱时,隐窝干细胞即可能发生恶性转变从而引发肿瘤。多项研究表明,Ascl2和Lgr5在结肠癌标本中表达上调,并且与结肠癌的分化程度、浸润和转移均密切相关[9-10],可能成为结肠癌治疗的有效靶点。目前两者已被认为是结肠癌干细胞比较特异的标志物[1, 11]。不仅如此,两者既是Wnt信号通路的重要靶标,同时又对该通路起调控作用,影响结肠癌的发生发展。Oct4和Sox2同样是重要的干细胞标志物,它们与多种恶性肿瘤均密切相关,两者可维持干细胞的自我更新和多向分化潜能,并与结肠癌的发生、转移、治疗抵抗和预后密切关联,研究认为两者可能作为关键的调控基因参与结肠癌干细胞的功能调控[3, 12]。因此,本研究选择以上四种具有代表性的CSCs标志物作为研究对象,观察miRNA-302b对结肠癌HT-29细胞“干性”调控的影响。
miRNAs作为转录后调节因子,由于其在蛋白质翻译和mRNA稳定性调控过程中的重要作用,近年来成为研究热点。miRNAs调控着人类约1/3的基因表达,它们构成复杂的网络系统参与多种肿瘤发生发展、侵袭和转移,可调节肿瘤细胞的增殖与凋亡、肿瘤血管生成、肿瘤表型与分化、肿瘤代谢与耐药等过程,部分起决定性作用。miR-302-367簇包括4个miRNA-302成员(miRNA-302a-d)和miR-367,在胚胎干细胞增殖、多向分化调控方面起关键作用,有学者发现,在小鼠模型中基因敲除miR-302-367簇,将导致胚胎的早期死亡和开放性神经管缺陷,并促进神经祖细胞分化和凋亡[13]。miRNA-302b作为该簇成员之一,其在小鼠外胚层干细胞中呈高表达[14]。Bourguignon等[15]研究发现hyaluronan-cd44v3与oct4-sox2-nanog相互作用共同促进miR-302b和a表达导致头颈部鳞状细胞癌干细胞自我更新、克隆形成能力增强。在结肠癌中,miRNA-302b可能与CSCs“干性”维持相关。干扰在结肠癌HT-29细胞“干性”标志物Ascl2的表达,miRNA-302b表达下调;在shRNA-Ascl2/HT-29细胞中上调miRNA-302b的表达,Ascl2表达得以恢复[1]。本研究结果显示,HT-29细胞转染miRNA-302b mimics后,“干性”标志物Ascl2、Lgr5、Oct4和Sox2一致性上调,并且克隆形成实验和干细胞成球实验结果显示,HT-29细胞的克隆形成和细胞球形成能力明显增强,说明miRNA-302b与结肠CSCs的“干性”维持相关,能增强CSCs的自我更新和复制能力。
miRNAs对CSCs的调控是极其复杂的过程,目前发现至少100多种miRNA参与了结肠癌的调控,某些miRNAs可能起到调控关键点的作用[16],希望找到这些关键点,作为治疗靶点应用于临床、减轻病患痛苦。本研究发现miRNA-302b可调节“干性”标志物Ascl2、Lgr5、Oct4和Sox2的表达,增强克隆形成和细胞球形成能力,证实了其与结肠CSCs的“干性”维持相关。但进一步的机制尚需更深入的研究,同时,如果以原代人结肠癌干细胞为研究对象,并且应用动物在体实验证实,可能获得更多有意义的结果。尽管如此,本研究已证明miRNA-302b与结肠癌“干性”维持相关,希望未来继续深入研究,最终miRNA-302b可作为一个结肠癌治疗的根本靶点,应用于临床。
| [1] | Zhu R, Yang Y, Tian Y, et al. Ascl2 knockdown results in tumor growth arrest by miRNA-302b-related inhibition of colon cancer progenitor cells[J]. PLoS One, 2012, 7(2): e32170. DOI:10.1371/journal.pone.0032170 |
| [2] | Yanai H, Atsumi N, Tanaka T, et al. Intestinal cancer stem cells marked by Bmi1 or Lgr5 expression contribute to tumor propagation via clonal expansion[J]. Sci Rep, 2017, 7: 41838. DOI:10.1038/srep41838 |
| [3] | Oshima N, Yamada Y, Nagayama S, et al. Induction of Cancer Stem Cell Properties in Colon Cancer Cells by Defined Factors[J]. PLoS One, 2014, 9(7): e101735. DOI:10.1371/journal.pone.0101735 |
| [4] | Paschall AV, Yang D, Lu C, et al. CD133+CD24lo defines a 5-Fluorouracil-resistant colon cancer stem cell-like phenotype[J]. Oncotarget, 2016, 7(48): 78698–712. |
| [5] | Garofalo M, Croce CM. Role of microRNAs in maintaining cancer stem cells[J]. Adv Drug Deliv Rev, 2015, 81: 53–61. DOI:10.1016/j.addr.2014.11.014 |
| [6] | Hu T, Li Z, Gao CY, et al. Mechanisms of drug resistance in colon cancer and its therapeutic strategies[J]. World J Gastroenterol, 2016, 22(30): 6876–89. DOI:10.3748/wjg.v22.i30.6876 |
| [7] | Biswas S, Davis H, Irshad S, et al. Microenvironmental control of stem cell fate in intestinal homeostasis and disease[J]. J Pathol, 2015, 237(2): 135–45. DOI:10.1002/path.4563 |
| [8] | Sasaki N, Sachs N, Wiebrands K, et al. Reg4+ deep crypt secretory cells function as epithelial niche for Lgr5+ stem cells in colon[J]. Proc Natl Acad Sci U S A, 2016, 113(37): E5399–407. DOI:10.1073/pnas.1607327113 |
| [9] | Wang CY, Shahi P, Huang JT, et al. Systematic analysis of the achaete-scute complex-like gene signature in clinical cancer patients[J]. Mol Clin Oncol, 2017, 6(1): 7–18. DOI:10.3892/mco.2016.1094 |
| [10] | Baker AM, Graham TA, Elia G, et al. Characterization of LGR5 stem cells in colorectal adenomas and carcinomas[J]. Sci Rep, 2015, 5: 8654. DOI:10.1038/srep08654 |
| [11] | Chen X, Wei B, Han X, et al. LGR5 is required for the maintenance of spheroid-derived colon cancer stem cells[J]. Int J Mol Med, 2014, 34(1): 35–42. DOI:10.3892/ijmm.2014.1752 |
| [12] | Qureshi-Baig K, Ullmann P, Rodriguez F, et al. What Do We Learn from Spheroid Culture Systems? Insights from Tumorspheres Derived from Primary Colon Cancer Tissue[J]. PLoS One, 2016, 11(1): e0146052. DOI:10.1371/journal.pone.0146052 |
| [13] | Yang SL, Yang M, Herrlinger S, et al. MiR-302/367 regulate neural progenitor proliferation, differentiation, and survival in neurulation[J]. Dev Biol, 2015, 408(1): 140–50. DOI:10.1016/j.ydbio.2015.09.020 |
| [14] | Stadler B, Ivanovska I, Mehta K, et al. Characterization of microRNAs involved in embryonic ctem cell ctates[J]. Stem Cells Dev, 2010, 19(7): 935–50. DOI:10.1089/scd.2009.0426 |
| [15] | Bourguignon LY, Wong G, Earle C, et al. Hyaluronan-CD44v3 interaction with Oct4-Sox2-Nanog promotes miR-302 expression leading to self-renewal, clonal formation, and cisplatin resistance in cancer stem cells from head and neck squamous cell carcinoma[J]. J Biol Chem, 2012, 287(39): 32800–24. DOI:10.1074/jbc.M111.308528 |
| [16] | Wang J, Du Y, Liu X, et al. MicroRNAs as Regulator of Signaling Networks in Metastatic Colon Cancer[J]. Biomed Res Int, 2015, 2015: 823620. |
 2017, Vol. 44
2017, Vol. 44