文章信息
- 血小板新型活化受体CLEC-2和平足蛋白在肿瘤转移中的研究进展
- Research Progress of New Platelet Receptor CLEC-2 and Podoplanin in Tumor Metastasis
- 肿瘤防治研究, 2017, 44(12): 840-844
- Cancer Research on Prevention and Treatment, 2017, 44(12): 840-844
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2017.17.0397
- 收稿日期: 2017-04-12
- 修回日期: 2017-07-27
在我国,癌症的发病率和死亡率越来越高,已经成为导致死亡的主要疾病[1],尤其是发生转移的患者,然而临床上对于肿瘤转移患者的治疗疗效并不十分理想。肿瘤的转移是一个涉及多分子参与的、高度有序的、有器官选择性的复杂过程。Tesfamariam[2]总结了大量的实验数据,发现血小板可参与肿瘤的生长和转移,且人为的诱导血小板减少可以抑制转移的发生。其机制之一:表达于多种肿瘤细胞的平足蛋白(podoplanin, PDPN),通过与血小板表面的C型凝集素受体2(C-type lectin-like receptor-2, CLEC-2)结合激活血小板[3]。已知肿瘤细胞在血液循环中会受到血流剪切应力及宿主免疫捕获等,故只有非常少量的肿瘤细胞能在24小时后幸存[4]。然而活化的血小板可聚集并包被于肿瘤细胞团表面,从而帮助肿瘤细胞逃避宿主攻击并进一步形成新的转移灶。本文旨在探讨PDPN和CLEC-2介导的肿瘤转移机制,总结针对这两个新靶点的最新治疗研究进展,望为肿瘤转移的早期预防,后续治疗提供新的研究思路。
1 平足蛋白的结构和表达平足蛋白于1996年由Wetterwald等首次发现并报道,随后在大鼠的肾小球足突细胞表面发现,并具有维持肾小球通透性和调节足突细胞形态的功能,被命名为Podoplanin蛋白。人类PDPN是分子量为38kDa的Ⅰ型唾液酸跨膜糖蛋白,包含一个靠近蛋白质游离羧基端的胞内域结构,一个高度保守的跨膜结构和一个靠近游离氨基端的富含丝氨酸和苏氨酸(Thr)残基的胞外域结构。胞外域中的EDxxVTPG片段被认为是刺激血小板聚集区域(platelet-aggregation-stimulating, PLAG),PLAG区由3个重复序列(PLAG1~3)组成,但近年来Takaya等[5]发现了一个与PLAG3高度同源的PLAG4区,位于人类PDPN的81~85氨基酸,研究表明PLAG4区的突变或缺失可以减少PDPN和CLEC-2的结合。目前已知位于PLAG3区且经O-聚糖唾液酸化的Thr52对于诱导血小板聚集至关重要,但其他氨基酸残基是否能够发挥诱导作用尚不明确。
平足蛋白可表达于许多正常细胞和组织中,如淋巴内皮细胞,肾脏足突细胞,Ⅰ型肺泡细胞,骨骼肌等。另外,PDPN也表达于多种恶性肿瘤,如肺鳞状细胞癌[6]、乳腺癌[7]、口腔癌[8]、中枢神经系统肿瘤[9],此外在79%的皮肤鳞癌及食管癌、宫颈癌肿瘤边缘都呈高表达[10]。Kaneko等[11]将转染了人PDPN的中国仓鼠卵巢细胞经尾静脉注射到裸鼠体内,同时将等量的细胞与抗人PDPN单克隆抗体NZ-1孵育后以相同方式接种到另一组裸鼠体内,19~21天后发现经NZ-1预处理小鼠组,其肺上的结节数目较未接种NZ-1组的明显减少,提示PDPN可能与恶性肿瘤的侵袭和转移相关。
2 C型凝集素受体2(CLEC-2)的结构和表达CLEC-2是分子量为32kDa的Ⅱ型跨膜蛋白,属于非经典型凝集素样受体。CLEC-2高表达于血小板和巨核细胞,且低表达于肝窦内皮细胞和肝脏库普弗细胞[12]与PDPN的结构截然相反的是,CLEC-2的胞质尾区靠近游离的氨基端。CLEC-2包含一个由41个氨基酸构成的跨膜区和一个由31个氨基酸构成的胞质尾区,其中YXXL序列对于CLEC-2的信号转导至关重要。目前为止,PDPN是CLEC-2唯一的内源性配体,两者结合后的信号通路转导依赖于Src、Syk酪氨酸激酶的磷酸化。一个Syk含有两个SH2(sre homology 2, Src二聚体2)结构域,其活化需要两个磷酸化的YXXL。因此,CLEC-2的活化需在血小板表面形成同源二聚体,一方面弥补了酪氨酸残基数量的不足,保证信号的有效传递,另一方面满足了其与PDPN的结合[13]。
3 PDPN和CLEC-2相互作用激活血小板肿瘤细胞诱导的血小板聚集(tumor cell-induced platelet aggregation, TCIPA)通路之一:表达于多种肿瘤细胞表面的PDPN,与血小板表面的CLEC-2相互作用后,通过Src、Syk依赖酪氨酸激酶,使一系列适配体和效应蛋白发生磷酸化,累积激活磷脂酶γ2(PLCγ2)和血小板活化。已报道的高表达PDPN的人纤维肉瘤细胞HT1080[14],人胶质瘤细胞LN319[15]等能在体外直接诱导血小板聚集,且应用针对人PDPN的单克隆抗体后能够抑制血小板聚集。Riedl等[16]对213名脑肿瘤患者(其中151名PDPN表达阳性)进行免疫组织化学染色。发现PDPN表达阳性的患者血小板计数的中位数和四分位数间距为[227(186~285)]×109/L,明显低于PDPN表达阴性的患者[286(241~355)]×109/L,差异有统计学意义(P<0.001)。患者组织中PDPN染色强度与其血管内血小板聚集体的增加水平呈正相关(P<0.001)。盛敏佳等[17]构建CLEC-2基因缺陷小鼠模型,分别对小鼠血小板和PDPN表达阳性细胞(PDPN+)进行荧光染色,两者混合后在显微镜下观察到:仅野生型血小板与PDPN+细胞组可见血小板围绕在肿瘤细胞周围并聚集成团,而其他组几乎无聚集,表明PDPN与CLEC-2的结合能够使血小板聚集。
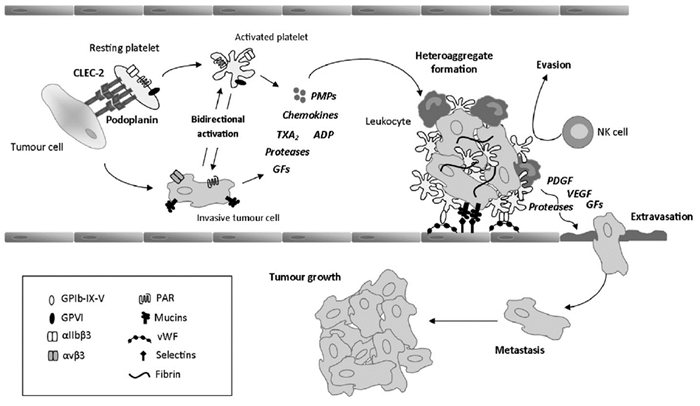
4 活化的血小板促进肿瘤的转移肿瘤细胞表面的PDPN和血小板表面CLEC-2结合后,引起血小板的活化聚集。聚集的血小板包被在肿瘤细胞团周围,并通过协助黏附、逃避宿主免疫攻击,促进外渗等多重机制促进了肿瘤的生长和转移,见图 1[13]。
肿瘤细胞黏附到血管壁的过程中,P选择素发挥了一定的作用。研究发现,P选择素基因缺陷型小鼠的血小板与肿瘤细胞的相互作用明显减少。Korniluk等[18]检测53名结直肠癌患者血浆中可溶性P选择素的含量,结果发现53名患者的P选择素水平(74.29±19.62)ng/ml都显著高于正常人(40.62±11.15)ng/ml,差异有统计学意义(P<0.001)。另外,血小板黏附受体糖蛋白Ⅱb~Ⅲa(GlycoproteinⅡb~Ⅲa, GPⅡb~Ⅲa)在介导肿瘤细胞黏附于血管壁也发挥了重要作用。此外,循环中的肿瘤细胞,血小板和纤维蛋白相互作用后可形成微小癌栓,从而保护肿瘤细胞逃避免疫细胞的攻击和血管剪切力的破坏[19]。
4.2 血小板对肿瘤细胞的外渗及生长作用活化的血小板可释放基质金属蛋白酶(matrix metalloproteinase, MMP)和蛋白水解酶,它们可直接降解基底膜的结构组分,使血管通透性增加[20]。另外血小板释放的生长因子如转化生长因子-β(transforming growth factor-β, TGF-β)、血管内皮生长因子(vascular endothelial growth factor, VEGF)、溶血磷脂酸(lysophosphatidic acid, LPA)等,会直接破坏血管的完整性。研究表明,许多肿瘤中高浓度的LPA具有驱动肿瘤生长转移、促进血管生成等多重作用[21]。活化的血小板释放的血小板微粒(PMPs),可表达多种生物活性物质,可以被转移到周围细胞膜如肿瘤细胞,增加肿瘤细胞的存活率和侵袭能力。血小板也能够释放超过30种具有抗血管生成及促血管生成作用的蛋白,其中大部分是能释放到肿瘤微环境中的循环血管内皮生长因子。VEGF可促进内皮细胞增殖和肿瘤新生血管的生成,从而为肿瘤的生长建立了丰富的血液供应。已经明确的非小细胞肺癌[22]患者血清中的VEGF水平增加与肿瘤发展的进程、预后相关。
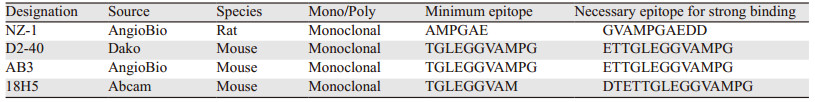
5 PDPN及CLEC-2可作为抗肿瘤转移的新型靶点PDPN和CLEC-2结合引起血小板活化聚集,并参与肿瘤的转移,提示PDPN可作为治疗肿瘤转移的新靶点,特别是高表达PDPN的肿瘤。近年来,许多针对人PDPN的单克隆抗体已经成功制备,其中研究较多的有NZ-1、D2-40、18H5和AB3。NZ-1识别的抗原表位是PLAG2/3区,其最小表位是6个氨基酸(AMPGAE)。而D2-40、AB3和18H5识别的抗原表位是PLAG1/2区,D2-40和AB3的最小表位是11个氨基酸(TGLEGGVAMPG),18H5的最小表位是9个氨基酸(TGLEGGVAM)[23]见表 1。D2-40在免疫组织化学染色中应用广泛,现阶段已应用到临床病理诊断和分析中。然而以上几种抗体只有NZ-1可以抑制PDPN和CLEC-2的相互作用,这可能是抗体识别的抗原表位不同导致的功能差异。NZ-1是大鼠源性的抗体,种属的差异性使其应用受到限制。最近报道Kaneko等[24]制备了新的大鼠-人嵌合抗体NZ-12,证实NZ-12与PDPN的结合亲和力,以及抗体依赖的细胞毒作用都比NZ-1更有优势。Nakazawa等[14]制备出针对人PDPN的小鼠-人嵌合抗体hP2-0,经人源嵌合化的抗体仍维持了P2-0抑制血小板聚集的能力,但其临床安全性尚未评估,仍需要进行相关的动物模型研究和临床前研究,为安全有效的临床应用奠定基础。
CLEC-2也可成为治疗肿瘤转移的另一个新靶点。CLEC-2基因缺失的血小板仍能与经典的血小板激动剂如胶原、ADP、凝血酶反应,并且能够与胶原、纤维蛋白原和血管性血友病因子正常结合,因此并不会影响血小板的正常止血功能。Syk是CLEC-2信号通路下游的关键介质,R406作为Syk的选择性抑制剂可显著抑制Syc下游酪氨酸磷酸化,减少血小板的活化聚集。盛敏佳等[17]用流式细胞术检测黏附在PDPN+细胞表面的血小板的平均荧光强度(mean fluorescence intensity, MFI),发现经R406预处理血小板的小鼠与未处理小鼠相比,MFI值显著降低(P<0.05)。另外经R406灌胃处理的小鼠再注射PDPN+细胞,发现小鼠肺上的结节数量明显少于未处理组(P<0.05)。AACT是CLEC-2的外源性配体蛇毒蛋白凝集素的一段多肽(位于106~136位氨基酸残基),已经明确的肝癌细胞HepG2和HuH-7(两株高表达PDPN的细胞)可在体外诱导血小板聚集,经AACT预处理的肝癌细胞,其诱导血小板聚集的时间明显延长。经尾静脉注射106个HuH-7肝癌细胞到小鼠,经21天后,与未经AACT处理小鼠组进行观察和比较,发现处理组小鼠的肺转移灶明显减少[25]。提示AACT和R406可能是以CLEC-2为切入点治疗肿瘤转移的方式之一。另外针对胞外域受体和配体的作用位点如单克隆抗体可能更具有特异性。Shirai等[26]用抗小鼠CLEC-2的单克隆抗体2A2B10预处理小鼠,并注射PDPN+的小鼠黑色素瘤细胞B16F10。结果与正常小鼠相比,缺乏CLEC-2小鼠的肿瘤血行转移显著减少,提示阻断CLEC-2信号通路是一种潜在的预防肿瘤转移的有效途径。
6 结语近年来肿瘤诱导的血小板聚集在促进肿瘤生长,转移和预后方面的研究成为了新的热点。目前临床上治疗肿瘤除了传统的放化疗方法外,许多新型药物也正在应用,如针对血小板的低分子量肝素、GPⅡb~Ⅲa的抑制剂等,但治疗效果仍需进一步评估。未来的研究方向可为:(1)制备PDPN和CLEC-2基因敲除小鼠模型并应用到相关肿瘤模型中,研究两者之间在肿瘤转移中的作用;(2)利用抗PDPN和CLEC-2单克隆抗体进一步探索两者在治疗肿瘤转移中的作用;(3)针对PDPN与血小板CLEC-2信号通路的研究也为研制靶向药物提供了新的思路。期望以PDPN和CLEC-2为切入点,为更好的预防和治疗肿瘤转移为目标,早日寻求到更加安全有效的治疗方案。
| [1] | 邝新红, 卫晓慧, 孙立, 等. 胶原翻译后修饰酶与肿瘤关系的研究进展[J]. 肿瘤防治研究, 2016, 43(12): 1085–9. [ Kuang XH, Wei XH, Sun L, et al. Progress on Relationship Between Posttranslational Modification Enzymes of Collagen and Tumor[J]. Zhong Liu Fang Zhi Yan Jiu, 2016, 43(12): 1085–9. DOI:10.3971/j.issn.1000-8578.2016.12.016 ] |
| [2] | Tesfamariam B. Involvement of platelets in tumor cell metastasis[J]. Pharmacol Ther, 2016, 157: 112–119. DOI:10.1016/j.pharmthera.2015.11.005 |
| [3] | Chang YW, Hsieh PW, Chang YT, et al. Identification of a novel platelet antagonist that binds to CLEC-2 and suppresses podoplanin-indued platelet aggregation and cancer metastasis[J]. Oncotarget, 2015, 6(40): 42733–48. DOI:10.18632/oncotarget.v6i40 |
| [4] | Regmi S, Fu A, Luo KQ. High Shear Stresses under Exercise Condition Destroy Circulating Tumor Cells in a Microfluidic System[J]. Sci Rep, 2017, 7: 39975. DOI:10.1038/srep39975 |
| [5] | Sekiguchi T, Takemoto A, Takagi S, et al. Targeting a novel domain in podoplanin for inhibiting platelet-mediated tumor metastasis[J]. Oncotarget, 2016, 7(4): 3934–46. DOI:10.18632/oncotarget.v7i4 |
| [6] | Ono S, Ishii G, Nagai K, et al. Podoplanin-positive cancer-associated fibroblasts could have prognostic value independent of cancer cell phenotype in stageⅠlung squamous cell carcinoma: usefulness of combining analysis of both cancer cell phenotype and cancer-associated fibroblast phenotype[J]. Chest, 2013, 143(4): 963–70. DOI:10.1378/chest.12-0913 |
| [7] | Jung YY, Lee YK, Koo JS. Expression of cancer-associated fibroblast-related proteins in adipose stroma of breast cancer[J]. Tumour Biol, 2015, 36(11): 8685–95. DOI:10.1007/s13277-015-3594-9 |
| [8] | de Vicente JC, Santamarta TR, Rodrigo JP, et al. Expression of podoplanin in the invasion front of oral squamous cell carcinoma is not prognostic for survival[J]. Virchows Arch, 2015, 466(5): 549–58. DOI:10.1007/s00428-015-1746-3 |
| [9] | Kolar K, Freitas-Andrade M, Bechberger JF, et al. Podoplanin: a marker for reactive gliosis in gliomas and brain injury[J]. J Neuropathol Exp Neurol, 2015, 74(1): 64–74. DOI:10.1097/NEN.0000000000000150 |
| [10] | 王静文, 唐建武, 赵君怡. VGFC/D-VEGFR3/NRP2轴通路相关分子在肿瘤及其淋巴道转移时的变化与意义[J]. 现代肿瘤医学, 2016, 24(17): 2808–11. [ Wang JW, Tang JW, Zhao JY. The alterations and significances of pathway-related molecules of the VEGFC/D-VEGFR3/NRP2 axis in tumor and lymphatic metastasis[J]. Xian Dai Zhong Liu Yi Xue, 2016, 24(17): 2808–11. DOI:10.3969/j.issn.1672-4992.2016.17.041 ] |
| [11] | Kaneko MK, Kunita A, Abe S, et al. Chimeric anti-podoplanin antibody suppresses tumor metastasis through neutralization and antibody-dependent cellular cytotoxicity[J]. Cancer Sci, 2012, 103(11): 1913–9. DOI:10.1111/cas.2012.103.issue-11 |
| [12] | Ozaki Y, Tamura S, Suzuki-Inoue K. New horizon in platelet function: with special reference to a recently-found molecule, CLEC-2[J]. Thromb J, 2016, 14(Suppl 1): 27. |
| [13] | Lowe KL, Navarro-Nunez L, Watson SP. Platelet CLEC-2 and podoplanin in cancer metastasis[J]. Thromb Res, 2012, 129(Suppl 1): S30–7. |
| [14] | Nakazawa Y, Takagi S, Sato S, et al. Prevention of hematogenous metastasis by neutralizing mice and its chimericanti-Aggrus/podoplanin antibodies[J]. Cancer Sci, 2011, 102(11): 2051–7. DOI:10.1111/cas.2011.102.issue-11 |
| [15] | Kato Y, Kaneko MK, Kuno A, et al. Inhibition of tumor cell-induced platelet aggregation using a novel anti-podoplanin antibody reacting with its platelet-aggregation-stimulating domain[J]. Biochem Biophys Res Commun, 2006, 349(4): 1301–7. DOI:10.1016/j.bbrc.2006.08.171 |
| [16] | Riedl J, Preusser M, Nazari PM, et al. Podoplanin expression in primary brain tumors induces platelet aggregation and increases risk of venous thromboembolism[J]. Blood, 2017, 129(13): 1831–9. DOI:10.1182/blood-2016-06-720714 |
| [17] | 盛敏佳. PDPN与CLEC-2促进血小板介导的小鼠黑色素瘤的肺转移的实验研究[D]. 长春: 吉林大学, 2015. [ Sheng MJ. PDPN and CLEC-2 interaction promotes platelet mediated murine melanoma pulmonary metastasis[D]. Changchun: Ji Lin University, 2015. ] http://cdmd.cnki.com.cn/Article/CDMD-10183-1015590912.htm |
| [18] | Korniluk A, Kamińska J, Kiszlo P, et al. Lectin adhesion proteins (P-, L-and E-selectins) as biomarkers in colorectal cancer[J]. Biomarkers, 2016: 1–6. |
| [19] | 张光明, 王征, 张雪伟, 等. 恶性肿瘤患者血液高凝状态形成机制及防治[J]. 国际肿瘤学杂志, 2015, 42(6): 445–7. [ Zhang GM, Wang Z, Zhang XW, et al. Mechanism and prevention of the formation of hypercoagulable state in patients with malignant tumor[J]. Guo Ji Zhong Liu Xue Za Zhi, 2015, 42(6): 445–7. ] |
| [20] | Choi HJ, Kwon I, Kim NE, et al. Fc-saxatilin, a snake venom disintegrin, suppresses hypoxia-induced vascular leakage by regulating endothelial occludin expression[J]. Thromb Haemost, 2017, 117(3): 595–605. |
| [21] | Benesch MG, Tang X, Venkatraman G, et al. Recent advances in targeting the autotaxin-lysophosphatidate-lipid phosphate phosphatase axis in vivo[J]. J Biomed Res, 2016, 30(4): 272–84. |
| [22] | Costache MI, Ioana M, Iordache S, et al. VEGF Expression in Pancreatic Cancer and Other Malignancies: A Review of the Literature[J]. Rom J Intern Med, 2015, 53(3): 199–208. |
| [23] | Ogasawara S, Kaneko MK, Price JE, et al. Characterization of anti-podoplanin monoclonal antibodies: critical epitopes for neutralizing the interaction between podoplanin and CLEC-2[J]. Hybridoma (Larchmt), 2008, 27(4): 259–67. DOI:10.1089/hyb.2008.0017 |
| [24] | Kaneko MK, Abe S, Ogasawara S, et al. Chimeric Anti-Human Podoplanin Antibody NZ-12 of Lambda Light Chain Exerts Higher Antibody-Dependent Cellular Cytotoxicity and Complement-Dependent Cytotoxicity Compared with NZ-8 of Kappa Light Chain[J]. Monoclon Antib Immunodiagn Immunother, 2017, 36(1): 25–9. DOI:10.1089/mab.2016.0047 |
| [25] | Chang CH, Chung CH, Hsu CC, et al. Inhibitory effects of polypeptides derived from a snake venom C-type lectin, aggretin, on tumor cell-induced platelet aggregation[J]. J Thromb Haemost, 2014, 12(4): 540–9. DOI:10.1111/jth.12519 |
| [26] | Shirai T, Inoue O, Tamura S, et al. C-type lectin-like receptor 2 promotes hematogenous tumor metastasis and prothrombotic state in tumor-bearing mice[J]. J Thromb Haemost, 2017, 15(3): 513–25. DOI:10.1111/jth.13604 |
 2017, Vol. 44
2017, Vol. 44