文章信息
- 一种与前列腺癌高转移细胞表面受体特异性结合的多肽片段的筛选及验证
- Selection and Validation of Polypeptide Fragment Specially Locating on Surface of Highly Metastatic Prostate Cancer Cells
- 肿瘤防治研究, 2017, 44(9): 596-600
- Cancer Research on Prevention and Treatment, 2017, 44(9): 596-600
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2017.17.0396
- 收稿日期: 2017-04-12
- 修回日期: 2017-07-16
前列腺癌是危害男性健康的肿瘤之一,尽管相比西方发达国家,我国前列腺癌的发病率较低,但近年来也表现出了逐渐上升的态势,情况不容忽视。由于前列腺癌起病隐匿,确诊时多有骨转移。而对于晚期的前列腺癌患者,传统的内分泌治疗和化疗具有一定的局限性,如部分患者产生对内分泌治疗的耐受,常规的化疗药物难以渗入前列腺中并发挥疗效等,因而需要探索新的治疗方式。而代表了肿瘤生物治疗发展方向的分子靶向治疗,正逐渐成为前列腺癌防治研究的新热点[1-3]。
肽库技术实际上是通过噬菌体展示技术将一定长度的所有外源多肽展示于噬菌体载体表面,实现基因表达产物与亲和筛选相结合的一种技术。它将基因型、表型及分子结合活性与噬菌体/细菌的可扩增性结合在一起,是一种高效的、无偏倚的筛选技术。目前已成功地应用于抗原表位分析、单抗筛选、蛋白质功能拮抗多肽或模拟多肽的确定等方面[4-7]。本研究利用细菌表面展示随机肽库(Bacterial Display Random Peptide Library),通过对高低转移潜能配对的前列腺癌细胞株进行正负筛选,旨在尝试获取可以特异地结合高转移潜能前列腺癌细胞的细胞膜表面特殊分子标记的肽段,为前列腺癌的靶向基因治疗和靶向化疗研究提供实验基础。
1 材料与方法 1.1 主要试剂及随机肽库FliTrxTM Random Peptide Display Library,FliTrxTM Panning Kit,鼠抗Thio均购自美国Invitrogen公司,原始肽库的细菌滴度为1.77×108 pfu/ml;测序引物由上海博亚生物工程公司合成;TMTP1肽(GCGNVVRQGC)、错序肽svTMTP1(GCGVNQRVGC)及其FITC修饰均由西安华辰生物科技有限公司合成,纯度 > 90%,FITC购自美国Sigma公司。
1.2 细胞及试剂高转移潜能前列腺癌细胞PC-3M-1E8、不转移前列腺癌细胞PC-3M-2B4由北京大学医学院病理学系郑杰教授提供,均用含10%胎牛血清的RPMI 1640培养液培养,置于37℃、5%CO2、90%湿度培养箱。
1.3 实验动物雄性Balb/c裸小鼠,购自中国科学院上海实验动物中心(SLACCAS)国家啮齿类实验动物种子中心上海分中心(NLARSH),鼠龄5~6周,体质量18~22 g,在SPF级条件下饲养。
1.4 生物淘洗取对数生长期的PC-3M-2B4细胞接种于10 cm平皿,待90%融合度后与经诱导的肽库菌液于室温共孵育1 h,吸取共孵育菌液加入已经封闭好的PC-3M-1E8细胞平皿中共孵育1 h,弃培养液后加入洗脱液反复洗脱5次,取最后的洗脱液经摇菌扩增后再重复上述正负筛选共4次,最后一轮筛选后的摇菌过夜培养产物倍比稀释,涂于RMG平板,25℃倒置培养;从中随机挑取100个克隆,摇菌扩增,保种后送测序。
1.5 测序、翻译由上海宝生物公司进行测序分析,将测序结果中编码多肽的核苷酸序列翻译成氨基酸序列,利用计算机分析获得重复2~3次以上的三肽以上多肽序列,BLAST及EST数据库中查询同源序列。
1.6 细胞结合实验及亲和拮抗实验取对数生长期的PC-3M-1E8/PC-3M-2B4细胞,以1.2×105个/孔种于12孔板内,37℃培养过夜待贴壁完全后,加入含20 μmol/L FITC-TMTP1/ FITC-svTMTP1的RPMI 1640培养液,37℃孵育3 h后,吸去培养液换入4℃预冷PBS漂洗5 min×3次后,胰酶消化后PBS重悬上流式细胞仪检测阳性率。亲和拮抗试验则在细胞贴壁完全后,将不同摩尔比(1:1至1:5)的未标记FITC的TMTP1/svTMTP1与FITC-TMTP1(20 μmol/L)共同加入到PC-3M-1E8细胞培养液中孵育3 h,其余步骤同结合实验。
1.7 荷瘤小鼠体内结合实验PC-3M-1E8/PC-3M-2B4细胞经胰酶消化后,经漂洗重悬,在40 min内,于小鼠的后臀部位皮下注射,单次注射剂量为2×106个细胞以形成皮丘(所有动物为4周龄的BALB/c nu/nu裸鼠),然后放回培养容器内观测成瘤。当肿瘤体积长到约1 cm3大小时,选取成瘤小鼠并将其随机分为两组(每组不少于5只),分别予以FITC-TMTP1、FITC-svTMTP1尾静脉注射如小鼠体内,24 h后小鼠脱颈处死,解剖取原发灶、腹腔内转移灶及心、肝、脾、肺、肾脏等组织器官利用整体荧光光学成像系统观测[8]或冰冻切片后荧光显微镜下检测、以分析软件Image J计算每幅图片平均荧光强度,对实验组及对照组平均荧光强度进行统计学分析。
1.8 统计学方法所有的统计数据均采用SPSS 21.0统计软件进行分析,计算结果使用均数±标准差表示,两样本间比较采用独立样本t检验,P < 0.05为差异有统计学意义。
2 结果 2.1 筛选及多肽氨基酸序列测定结果四轮体外筛选后,随机挑取100个细菌克隆,测序分析后利用计算机进行序列比对分析,获得六个重复出现2次以上,长度≥3个氨基酸的短肽序列,再用免疫荧光法对上述含有重复性短肽序列的细菌克隆进行体外验证,获得与PC-3M-1E8细胞亲和力最强的细菌克隆27#和50#,其共同拥有一段重复了三次的5肽序列(NVVRQ),经BLAST检索未得到与已知的序列具有同源性,我们将该短肽命名为TMTP1。
2.2 多肽FITC-TMTP1体外验证结合结果利用20 μmol/L FITC-TMTP1/FITC-svTMTP1分别与PC-3M-1E8、PC-3M-2B4细胞孵育,荧光显微镜观察显示FITC-TMTP1与PC-3M-1E8有明显的细胞膜荧光染色,而与PC-3M-2B4细胞孵育仅见微弱的荧光,FITC-svTMTP1几乎未见明显荧光信号,见图 1A。流式细胞仪分别检测孵育后两种细胞的荧光标记率,高转移潜能的PC-3M-1E8细胞阳性率约为低转移潜能的PC-3M-2B4细胞的6倍((60.8±2.6)% vs.(11.1±1.2)%),差异有统计学意义(P < 0.01),见图 1B。
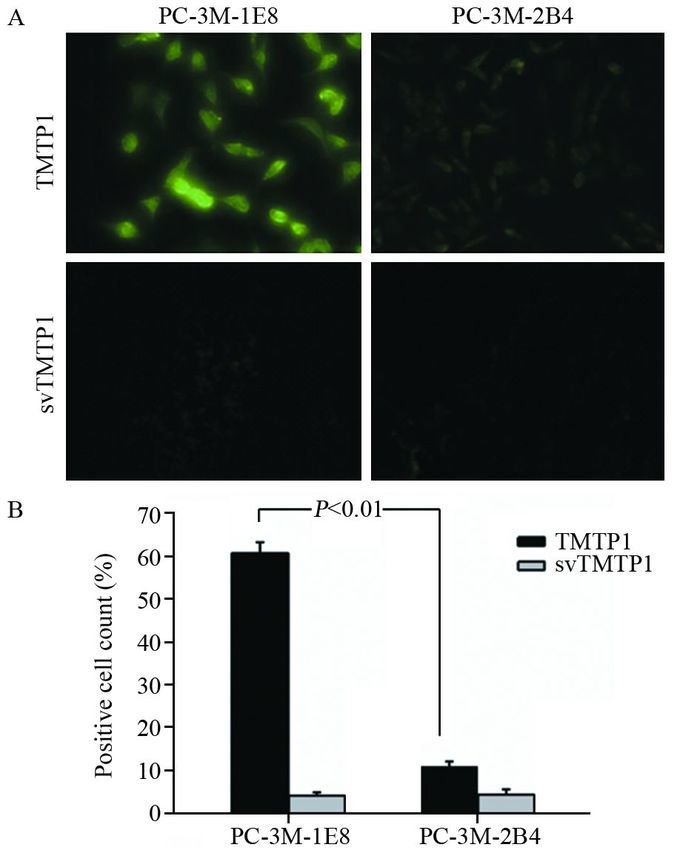
|
| A: FITC-TMTP1 (20μmol/L) or FITC-svTMTP1 (20μmol/L) was used for verifying the specific binding of TMTP1, examined by fluorescence microscope in PC-3M-1E8 and PC-3M-2B4 cell lines (×200); B: flow cytometric analyses were done by incubating PC-3M-1E8 and PC-3M-2B4 cells with 20μmol/L FITC-TMTP1 or FITC-svTMTP1 图 1 合成多肽FITC-TMTP1/FITC-svTMTP1与前列腺癌细胞高低转移配对细胞株的细胞结合实验 Figure 1 Binding of FITC-TMTP1/FITC-svTMTP1 was examined by fluorescence microscope and FCM in paired highly metastatic and non-metastatic human prostate cancer cell lines PC-3M-1E8 and PC-3M-2B4 |
使用不同浓度的FITC-TMTP1/FITC-svTMTP1孵育PC-3M-1E8细胞2 h,漂洗后经流式细胞仪检测,结果显示随着肽的孵育浓度的增加,FITC-TMTP1组的荧光阳性率也随之逐渐显著升高,而错序肽FITC-svTMTP1组阳性率的增高并不明显,FITC-TMTP1有较强的与PC-3M-1E8细胞结合的能力,且呈浓度依赖性,见图 2A。当使用不同比例的未标记FITC的TMTP1/svTMTP1与FITC-TMTP1(20 μmol/L)共同加入到PC-3M-1E8细胞培养液中孵育时,结果显示随着TMTP1:FITC-TMTP1的摩尔浓度比例逐渐上升至1:5时,TMTP1可以显著降低FITC-TMTP1对细胞的荧光染色的阳性率,而即使共孵育的错序肽svTMTP1浓度同样增加,也未显著影响FITC-TMTP1对细胞荧光染色,见图 2B,说明多肽TMTP1具有与PC-3M-1E8细胞特异结合的能力。
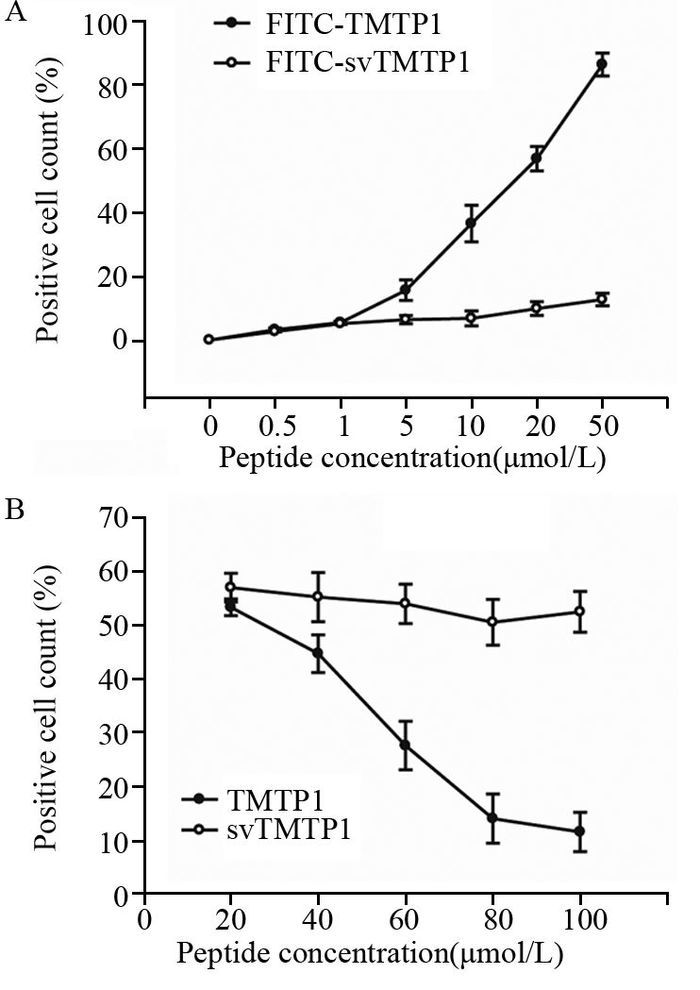
|
| A: positive rates of PC-3M-1E8 cells incubated with different concentrations (0-50 μmol/L) of FITC-TMTP1 or FITC-svTMTP1 for 2 hours were measured by flow cytometry; B: positive rates of PC-3M-1E8 cancer cells co-incubated with different concentrations (20-100 μmol/L) of free TMTP1/svTMTP1 and FITC-TMTP1 (20μmol/L) for 2 hours were measured by flow cytometry 图 2 多肽FITC-TMTP1与前列腺癌细胞PC-3M-1E8的结合呈浓度依赖性且能为游离的TMTP1所竞争拮抗 Figure 2 Binding of FITC-TMTP1 and PC-3M-1E8 was concentration-dependent and could be competitively inhibited by free synthetic TMTP1 |
7.1 mg/ml FITC-TMTP1 20 μl在荷瘤小鼠体内循环24 h后,取肿瘤组织冰冻切片后置于荧光显微镜下观察,可见在PC-3M-1E8细胞形成的皮下瘤组织在荧光显微镜下显示较强的荧光,而PC-3M-2B4细胞形成的皮下瘤组织在荧光显微镜下仅见微弱的背景荧光,而相同浓度FITC-svTMTP1在PC-3M-1E8的皮下瘤中的荧光信号最弱,见图 3A~3C;利用活体成像观测解剖后取下的肿瘤及正常组织器官,在皮下的原发灶及腹腔内的转移灶中,可以检测到FITC的荧光信号,见图 3D~3E。
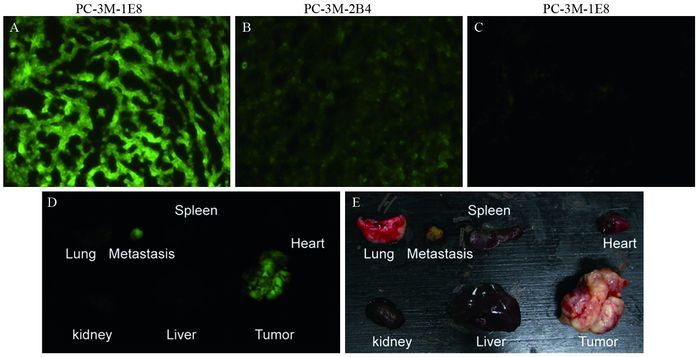
|
| A-C: FITC-conjugated TMTP1 or svTMTP1 was injected via the tail vein of mice and allowed to circulate for 24h. Tumors were then excised, and frozen sections were prepared to examine fluorescence in xenograft tumors, including PC-3M-1E8(A), PC-3M-2B4(B) after TMTP1 injection, or in PC-3M-1E8(C) after svTMTP1injection; D-E: 7.1mg/ml FITC-TMTP1 20μl was injected via the tail vein of mice and allowed to circulate for 24h. The primary tumor, lung, liver, heart, spleen, kidney, and mesentery lymph node metastases were removed and examined for fluorescence or macrography views under a whole-body optical imaging system. 图 3 多肽FITC-TMTP1特异地识别PC-3M-1E8荷瘤小鼠的皮下原发灶及腹腔转移灶 Figure 3 FITC-TMTP1 can specifically target s.c.PC-3M-1E8 tumors and abdominal metastases |
7.1 mg/ml FITC-TMTP1/FITC-svTMTP1 20 μl在PC-3M-1E8荷瘤小鼠体内循环24 h后,经灌注后取肿瘤及心、肝脏等重要脏器组织器官,冰冻切片并荧光显微镜观察,发现仍然在肿瘤部位有较强荧光信号浓聚,心脏、肝脏、脾脏、肺均仅见可见少量背景荧光信号,肾脏可见稍强的荧光信号,提示可能为多肽的代谢途径;对荧光图片进行量化分析,可见肿瘤部位平均荧光强度为(56.5±4.6),显著高于其他组织器官(P < 0.01),见图 4。
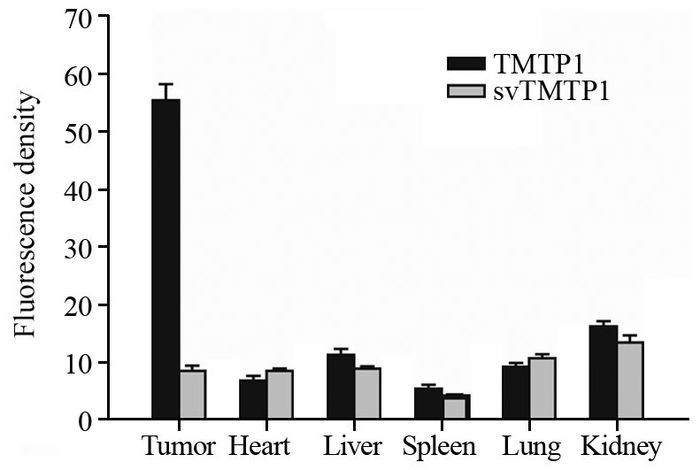
|
| 图 4 经尾静脉注射后FITC-TMTP1在小鼠的肿瘤及正常组织器官分布的荧光定量分析 Figure 4 Distribution and quantification of FITC-TMTP1 in tumor and organs after injection via tail vein |
近年来,随着对前列腺癌病程演进过程中相关分子机制研究的逐步深入,一系列诸如癌细胞特异性抗原分子、雄激素受体、调控骨转移的关键分子成为了靶向治疗干预的重要目标[9-12]。其中最具代表性的当属以前列腺特异性膜抗原(prostrate specific membrane antigen, PSMA)、前列腺干细胞抗原(prostate stem cell antigen, PSCA)为标靶的单克隆抗体治疗,目前多种针对上述两种抗原的单克隆抗体已经被分离出来,而通过抗体荷载细胞毒药物、核素、蛋白多肽等方法,不仅在基础研究中取得理想结果,甚至进入临床研究[13-15]。但是单克隆抗体治疗自身的局限性也较突出,如种类不多且只能靶向有限的、已知的相关抗原;体积较大,易被肝脏及网状内皮系统非特异性摄取、吞噬;在肿瘤组织、细胞中穿透力较弱以及对肝脏、骨髓的剂量相关不良反应限制了其应用。而特异识别肿瘤细胞膜表面分子的短肽既无上述抗体治疗所存在之不足,又具有高亲和力、高特异性和易于被肿瘤细胞摄取的特点,是另一种理想的肿瘤细胞靶向分子[16-18]。
本研究中,我们利用细菌鞭毛展示随机肽库对前列腺癌的高低转移配对细胞株进行正负筛选,并最终得到了一段五肽序列NVVRQ,经BLAST比对后未发现与已知的序列具有同源性,我们将这一新发现的短肽命名为TMTP1。由于筛选所用细胞株系利用倍比稀释法对前列腺癌细胞系PC-3M进行单细胞克隆,从同一肿瘤母系中分离出的具有不同转移潜能的亚系,研究也证实1E8为高转移亚系,2B4为不转移亚系[19]。这种相同遗传背景下的显著表型差异必然反映了转移相关基因表达与调控的差异,结合肽库展示技术无偏倚的生物筛选特性,为我们从表型出发克隆肿瘤转移相关基因提供了坚实的实验基础。
TMTP1的体内外验证实验发现,它具有对高转移前列腺癌肿瘤细胞特异的亲和能力,无论是细胞实验还是裸鼠体内验证,FITC-TMTP1在1E8细胞表面或皮下瘤组织中的荧光信号强度,均要显著高于2B4细胞及其皮下瘤组织,拮抗实验以及错构肽的对照进一步证实此种亲和能力的特异性。研究还发现,因为1E8亚系的高转移性,其建立的荷瘤小鼠模型腹腔内可有自发的淋巴结转移,而无论是荧光显微镜下的肿瘤组织冰冻切片还是整体荧光光学成像系统检测下的离体的完整肿瘤组织,均可以发现有TMTP1的强荧光信号的聚集,而错构肽则无法于上述部位检测到阳性意义的FITC信号,提示了TMTP1针对肿瘤原发及转移灶均具有良好的靶向识别能力。当然本研究获得的TMTP1多肽序列与前列腺癌高转移细胞结合的具体位点目前尚不明确,那么如何分离、克隆与之结合的位点,并鉴定、验证其是否介导了肿瘤远处转移的相关分子机制将是我们下一步的研究重点。同时进一步扩大验证TMTP1是否对其他肿瘤原发及转移灶也具有靶向识别能力,且尝试将核素、凋亡肽或者细胞毒基团与TMTP1偶联,研究其在肿瘤靶向诊断及治疗方面的潜力也是我们研究展开的另一方向。
在肿瘤分子靶向诊断及治疗领域,作为单克隆抗体有益补充,靶向多肽的重要性正受到越来越多的关注,其不仅可有效解决外源性目的基因的靶向转运问题,提高基因治疗对肿瘤组织和细胞的选择性,也可将肿瘤组织所具有的某些特殊蛋白分子结构,作为肿瘤治疗的新靶点,把筛选出的特异性生物活性多肽作为药物载体,与化疗药物结合,实行靶向化疗,为抑制肿瘤生长、控制肿瘤转移提供新的有效手段。而本研究中TMTP1多肽所展示的良好的针对前列腺癌的靶向识别作用及其后续相关实验研究无疑能为这一领域提供更多的、有益的实验基础。
| [1] | Lee YJ, Park JE, Jeon BR, et al. Is Prostate-Specific Antigen Effective for Population Screening of Prostate Cancer? A Systematic Review[J]. Ann Lab Med, 2013, 33(4): 233–41. DOI:10.3343/alm.2013.33.4.233 |
| [2] | Rowe SP, Drzezga A, Neumaier B, et al. Prostate-Specific Membrane Antigen-Targeted Radiohalogenated PET and Therapeutic Agents for Prostate Cancer[J]. J Nucl Med, 2016, 57(Suppl 3): 90S–6S. |
| [3] | Litwin MS, Tan HJ. The Diagnosis and Treatment of Prostate Cancer: A Review[J]. JAMA, 2017, 317(24): 2532–42. DOI:10.1001/jama.2017.7248 |
| [4] | Hu YF, Zhao D, Yu XL, et al. Identification of Bacterial Surface Antigens by Screening Peptide Phage Libraries Using Whole Bacteria Cell-Purified Antisera[J]. Front Microbiol, 2017, 8: 82. |
| [5] | Nemudraya AA, Kuligina EV, Ilyichev AA, et al. Selection of antitumor displayed peptides for the specific delivery of the anticancer drug lactaptin[J]. Oncol Lett, 2016, 12(6): 4547–55. |
| [6] | Lino CA, Caldeira JC, Peabody DS. Display of single-chain variable fragments on bacteriophage MS2 virus-like particles[J]. J Nanobiotechnology, 2017, 15(1): 13. DOI:10.1186/s12951-016-0240-7 |
| [7] | Umair S, Deng Q, Roberts JM, et al. Identification of Peptide Mimics of a Glycan Epitope on the Surface of Parasitic Nematode Larvae[J]. PLoS One, 2016, 11(8): e0162016. DOI:10.1371/journal.pone.0162016 |
| [8] | 陈延平, 熊涛, 余雳, 等. 基于功率型LED的在体整体荧光光学成像[J]. 光电子·激光, 2006, 17(12): 1529–33. [ Chen YP, Xiong T, Yu L, et al. Whole-body fluorescent optic imaging based on power led[J]. Guang Dian Zi·Ji Guang, 2006, 17(12): 1529–33. DOI:10.3321/j.issn:1005-0086.2006.12.028 ] |
| [9] | Kumar A, Coleman I, Morrissey C, et al. Substantial interindividual and limited intraindividual genomic diversity among tumors from men with metastatic prostate cancer[J]. Nat Med, 2016, 22(4): 369–78. DOI:10.1038/nm.4053 |
| [10] | Ferrara F, Staquicini DI, Driessen WH, et al. Targeted molecular-genetic imaging and ligand-directed therapy in aggressive variant prostate cancer[J]. Proc Natl Acad Sci U S A, 2016, 113(45): 12786–91. DOI:10.1073/pnas.1615400113 |
| [11] | Yadav SS, Li J, Stockert JA, et al. Combination effect of therapies targeting the PI3K-and AR-signaling pathways in prostate cancer[J]. Oncotarget, 2016, 7(46): 76181–96. |
| [12] | Davis JE, Xie X, Guo J, et al. ARF1 promotes prostate tumorigenesis via targeting oncogenic MAPK signaling[J]. Oncotarget, 2016, 7(26): 39834–45. DOI:10.18632/oncotarget.v7i26 |
| [13] | Vlachostergios PJ, Galletti G, Palmer J, et al. Antibody therapeutics for treating prostate cancer: where are we now and what comes next?[J]. Expert Opin Biol Ther, 2017, 17(2): 135–49. DOI:10.1080/14712598.2017.1258398 |
| [14] | DiPippo VA, Olson WC, Nguyen HM, et al. Efficacy studies of an antibody-drug conjugate PSMA-ADC in patient-derived prostate cancer xenografts[J]. Prostate, 2015, 75(3): 303–13. DOI:10.1002/pros.v75.3 |
| [15] | Knowles SM, Tavaré R, Zettlitz KA, et al. Applications of immunoPET: using 124I-anti-PSCA A11 minibody for imaging disease progression and response to therapy in mouse xenograft models of prostate cancer[J]. Clin Cancer Res, 2014, 20(24): 6367–78. DOI:10.1158/1078-0432.CCR-14-1452 |
| [16] | Zhang F, Niu G, Lin X, et al. Imaging tumor-induced sentinel lymph node lymphangiogenesis with LyP-1 peptide[J]. Amino Acids, 2012, 42(6): 2343–51. DOI:10.1007/s00726-011-0976-1 |
| [17] | Faintuch BL, Oliveira EA, Targino RC, et al. Radiolabeled NGR phage display peptide sequence for tumor targeting[J]. Appl Radiat Isot, 2014, 86: 41–5. DOI:10.1016/j.apradiso.2013.12.035 |
| [18] | Wang F, Chen L, Zhang R, et al. RGD peptide conjugated liposomal drug delivery system for enhance therapeutic efficacy in treating bone metastasis from prostate cancer[J]. J Control Release, 2014, 196: 222–33. DOI:10.1016/j.jconrel.2014.10.012 |
| [19] | 刘宇欣, 郑杰, 方伟岗, 等. 具有不同转移潜能的前列腺癌细胞亚系的分离鉴定[J]. 中华病理学杂志, 1999, 28(5): 361–4. [ Liu YX, Zheng J, Fang WG, et al. Isolation and characterization of human prostate cancer cell subclones with different metastatic potential[J]. Zhonghua Bing Li Xue Za Zhi, 1999, 28(5): 361–4. ] |
 2017, Vol. 44
2017, Vol. 44


