文章信息
- 慢性粒细胞白血病急性混合细胞白血病变1例并文献复习
- Mixed-phenotype Acute Leukemia Developed by Chronic Myelogenous Leukemia: A Case Report and Literature Review
- 肿瘤防治研究, 2017, 44(8): 570-572
- Cancer Research on Prevention and Treatment, 2017, 44(8): 570-572
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2017.17.0387
- 收稿日期: 2017-04-10
- 修回日期: 2017-05-02
2. 563003 遵义,遵义医学院附属医院内镜中心
2. Department of Endoscope, Affiliated Hospital of Zunyi Medical College, Zunyi 563003, China
慢性粒(髓)细胞白血病(chronic myelogenous leukemia, CML)是一种具有特定染色体(Ph染色体)和(或)融合基因(BCR-ABL)的骨髓增生性肿瘤,临床分为慢性期(chronic phase, CP)、加速期(accelerated phase, AP)、急变期(blast crisis, BC)。BCR-ABL融合基因及其编码的蛋白在CML发病过程扮演了重要角色,针对该融合基因开发的酪氨酸激酶抑制剂(tyrosine kinase inhibitor, TKI)治疗CML获得了较大成功。自然病程下CML患者慢性期大多可持续1~4年,之后进入加速、急变期,CML急变多数(约70%)急变为急性髓系白血病(acute myelogenous leukemia, AML),少数(约30%)可急变为急性淋巴细胞白血病(acute lymphocytic leukemia, ALL)。本文报告1例罕见的CML急变为急性混合细胞白血病(mixed-phenotype acute leukemia, MPAL)病例,并复习相关文献以提高对MPAL的认识。
1 临床资料患者,女,49岁,2016年10月13日因“诊断CML 6年,乏力20天”入院。患者2010年9月因腹泻就诊我院,血常规白细胞33.7×109/L,中幼粒细胞2%,晚幼粒细胞3%,中性粒细胞83%,淋巴细胞6%,红细胞3.98×1012/L,血红蛋白115 g/L,血小板620×109/L,骨髓增生活跃,粒系中性分叶核粒细胞比值增高(29.5%),嗜酸性粒细胞稍增多(3.5%),红系形态比例无异常,淋巴比例减低,巨核细胞52个,血小板多,诊断CML?骨髓荧光原位杂交(fluorescent in situ hybridization, FISH)提示存在Ph染色体,阳性率约98%,BCR-ABL1(P210型)融合基因阳性,临床确诊为CML-CP,因经济原因接受羟基脲及干扰素治疗。2016年10月13日因明显乏力再次入院,查体:贫血貌,浅表淋巴结未触及,胸骨下段压痛,肝脏不大,脾脏肋下3 cm;血常规:白细胞20.49×109/L,幼稚细胞64%,中性晚幼粒细胞3%,红细胞2.05×1012/L,血红蛋白60 g/L,血小板364×109/L;骨髓有核细胞增生极度活跃,分类不明细胞占96.5%,粒、红两系增生明显受抑制,外周血分类不明细胞占80%,诊断CML-BC,见图 1;骨髓免疫分型:在CD45/SSC点图上,见异常细胞群Blast,占有核细胞93.62%,主要表达CD34、HLA-DR、CD10、CD19、CD13、CD33、CD22,部分表达CD56、CD79a,弱表达CD117、CD11b、CD7、CD4;荧光定量PCR法检测骨髓BCR-ABL1融合基因(P210型)阳性,BCR-ABL1拷贝数4651645.00,ABL1拷贝数4312228.00,BCR-ABL1/ABL1 1.07871,IS BCR-ABL1/ABL1 0.87376,染色体核型分析:46, XY, t(9; 22)(q34; q11)[1],见图 2;ABL1激酶突变阴性,见图 3。临床诊断为CML-BC(双表型),给予达沙替尼70 mg,2次/天;治疗1月后骨髓象见1%分类不明细胞,血常规白细胞分类未见幼稚细胞,血红蛋白明显升高;治疗3月后骨髓象见4.5%分类不明细胞,血常规完全恢复正常,骨髓(荧光定量PCR法)BCR-ABL1融合基因(P210型)阳性,BCR-ABL1拷贝数216410.00,ABL1拷贝数594130.00,BCR-ABL1/ABL1 0.36425,IS BCR-ABL1/ABL1 0.29504;目前患者达沙替尼治疗(70 mg,2次/天)5月余,门诊随诊中,建议尽快行异基因造血干细胞移植。
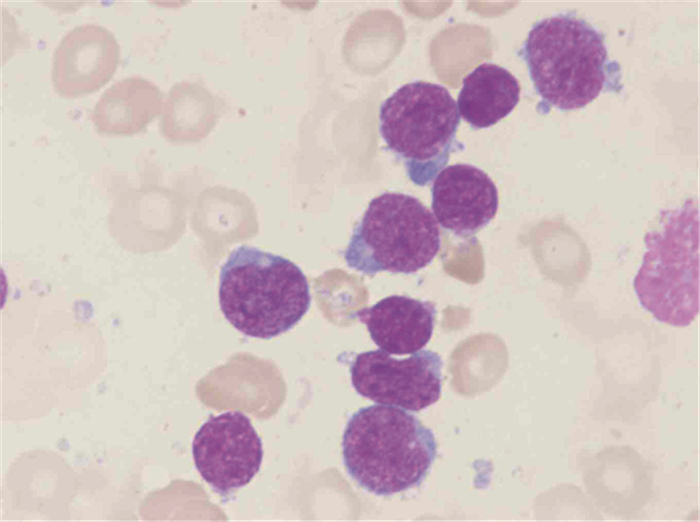
|
| 图 1 慢性粒细胞白血病患者急性混合细胞白血病变时骨髓细胞形态 Figure 1 Myelocytic morphology in patients with mixed-phenotype acute leukemia (MPAL) developed by chronic myelogenous leukemia (CML) |
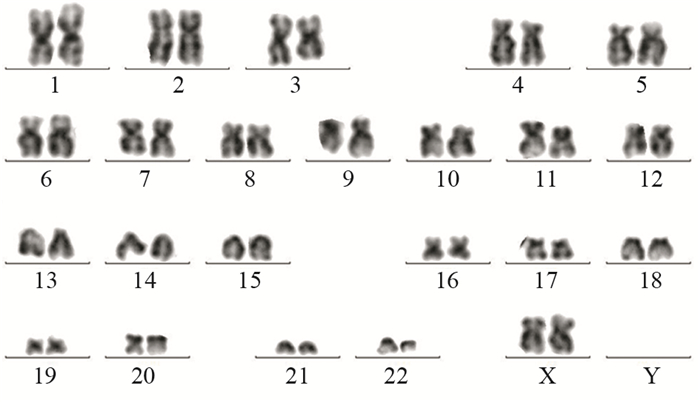
|
| 图 2 慢性粒细胞白血病患者染色体核型分析 Figure 2 Karyotype analysis of CML |
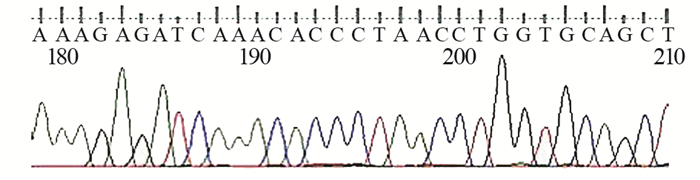
|
| 图 3 慢性粒细胞白血病患者急性混合细胞白血病变时ABL1激酶突变测序图 Figure 3 ABL1 kinase mutation sequence diagram of patients with MPAL developed by CML |
MPAL是指原始细胞表达两种或两种以上系列抗原的急性白血病,根据系列抗原表达不同(髓系(My)、淋巴系(T/B细胞系))可分为B+My、T+My、B+T及B+T+My四种类型。WHO2008/2016和EGIL1998方案广泛被用于诊断MPAL,两者具有高度一致性,其总体一致性高达79.7%,在诊断B+My、T+My和B+T及B+T+My具体亚型时的一致性分别为85.2%、56.3%和50%[1]。两种分型方案均以流式细胞术为重要依据,在此基础上前者结合了免疫组织化学和细胞化学技术,故通常认为WHO2008/2016方案是目前较为合适的MPAL诊断方案,但该方案明确把具有基因异常的复发疾病(如CML等)排除在外,本例患者基础病为CML,显然不适合采用该方案。患者诊断CML-CP6年后发生急变,急变时形态学难以判定急变类型,流式细胞检查仅见一群白血病细胞,免疫表型表达有B系抗原标志:CD22(2分)、CD79a(2分)、CD19(1分)、CD10(1分),髓系主要抗原标志MPO虽未见表达,但同时表达有CD13(1分)、CD33(1分)及CD117(1分),依据EGIL1998方案积分规则B系及My系积分均大于2分,诊断为CML急性双表型白血病变(B+My)。
MPAL约占白血病总数的2%~5%[2],CML急变为MPAL临床罕见,国内外仅有零星报道[3-5]。MPAL临床表现与AML、ALL基本类似,前者更容易发生髓外器官浸润(肝脾肿大、中枢、睾丸浸润等),发生率约38.1%,而AML、ALL髓外浸润发生率分别为9.9%、15.8%[6]。MPAL骨髓细胞形态学表现多样,Matutes等[7]分析了100例MPAL的骨髓,ALL样的43例、AML样的42例,另外15例形态学难以判断细胞类别,因此试图利用细胞形态学差异诊断MPAL是不可取的,流式细胞术是最重要的方法。B+My、T+My是最常见的免疫表型,占比分别为47%~72%、24%,B+T和B+T+My两种亚型少见,两者共占比不超过6%[8],各亚型的发生似乎无性别和年龄的差异[7]。此外,MPAL常伴有细胞遗传学异常,有限的病例资料显示约20%的患者Ph+、约8%伴混合表型白血病基因(MLL)重排、约32%伴有复杂核型,正常核型仅见于约13%的患者,Ph+和复杂核型的出现概率似乎随年龄增长而增加[9]。
目前治疗MPAL的方法主要为化疗和异基因造血干细胞移植,但截至目前尚无标准化疗方案推荐。临床医生主要依据自身经验及免疫表型应用治疗AML、ALL或两者兼顾的方案。既往资料显示,应用针对ALL为主的化疗方案患者可获得更高的完全缓解率、更长的无进展生存时间[7]。以ALL为主的方案诱导不能缓解时建议重新评估免疫表型并考虑换用AML方案,仍不能缓解的建议进入临床试验,化疗诱导缓解后应尽快行异基因造血干细胞移植;对Ph+-MPAL建议加用TKI,不能缓解时除重新评估免疫表型外还需检测ABL1激酶突变[9]。异基因造血干细胞移植被认为是治疗MPAL最有效的方法,但对23例接受造血干细胞移植或单纯化疗的MPAL预后进行研究发现接受移植的患者无论总生存时间还是无进展生存时间均与单纯化疗患者无明显差别[10]。尽管如此,在缺乏标准治疗方案的情况下仍推荐化疗缓解后尽快行异基因造血干细胞移植。本病例是一种特殊类型的MPAL,由BCR-ABL1融合基因驱动发病,未发现除Ph以外的其他异常核型、ABL1激酶突变阴性,且患者自身对化疗有抵触,故单独给予达沙替尼治疗,很快获得了血液学完全缓解,治疗3月时BCR-ABL1 mRNA显著下降,目前仍达沙替尼治疗并随诊中,后期我们将根据Ph染色体及BCR-ABL1融合基因的监测结果决定是否行异基因造血干细胞移植。影响MPAL预后的因素众多,主要有年龄、首次就诊时白细胞数量、髓外浸润表现、尿酸和肌酐的基线水平、Ph染色体、MLL重排、复杂核型、免疫表型、诱导治疗方案、患者对诱导方案的治疗反应、缓解后治疗方法等[9],其中免疫表型被认为是独立预后因素,B+My预后明显优于其他各亚型[11]。
MPAL发病率低、预后差,学术界对其认识有限,WHO2008/2016方案和EGIL1998方案是广泛被用于诊断该病的积分系统,前者结合了多种技术更能准确识别疾病,但适用范围有限,后者方法简单、结果亦可靠,尤其对于B+My亚型的诊断两者具有较高的一致性;针对MPAL的化疗推荐应用以治疗ALL为主的方案,合并Ph染色体时建议加用TKI,缓解后尽快行异基因造血干细胞移植。
| [1] | 叶蕾, 林冬, 秘营昌, 等. 混合表型急性白血病EGIL1998诊断积分系统和WHO2008诊断分型标准比较[J]. 中华血液学杂志, 2012, 33(4): 286–90. [ Ye L, Lin D, Mi YC, et al. Comparison of EGIL1998 and WHO2008 criteria for the diagnosis of mixed phenotype acute leukemia[J]. Zhonghua Xue Ye Xue Za Zhi, 2012, 33(4): 286–90. ] |
| [2] | Ye ZX, Wang SJ. Mixed phenotype acute leukemia[J]. Chin Med J(Engl), 2014, 127(16): 2999–3003. |
| [3] | Chen X, Rutledge JC, Wu D, et al. Chronic Myelogenous Leukemia Presenting in Blast Phase with Nodal, Bilineal Myeloid Sarcoma and T-Lymphoblastic Lymphoma in a Child[J]. Prediatr Dev Pathol, 2013, 16(2): 91–6. DOI:10.2350/12-07-1230-CR.1 |
| [4] | 王平, 邓小娟, 彭贤贵, 等. BCR-ABL融合基因阳性的急性混合细胞白血病2例并文献复习[J]. 重庆医学, 2011, 40(30): 3024–6. [ Wang P, Deng XJ, Peng XG, et al. Two cases report of BCR/ABL+ acute mixed lineage leukemia and literature review[J]. Chongqing Yi Xue, 2011, 40(30): 3024–6. DOI:10.3969/j.issn.1671-8348.2011.30.004 ] |
| [5] | 郭智, 何学鹏, 陈惠仁, 等. 慢性粒细胞白血病急性混合细胞白血病变一例[J]. 内科急危重症杂志, 2009, 15(5): 280. [ Guo Z, He XP, Chen HR, et al. Mixed-phenotype acute leukemia which developed by chronic myelogenous leukemia: a case report[J]. Nei Ke Ji Wei Zhong Zheng Za Zhi, 2009, 15(5): 280. ] |
| [6] | Xu XQ, Wang JM, Lu SQ, et al. Clinical and biological characteristics of adult biphenotypic acute leukemia in comparison with that of acute myeloid leukemia and acute lymphoblastic leukemia: a case series of a Chinese population[J]. Haematologica, 2009, 94(7): 919–27. DOI:10.3324/haematol.2008.003202 |
| [7] | Matutes E, Pickl WF, Van't Veer M, et al. Mixed-phenotype acute leukemia: clinical and laboratory features and outcome in100 patients defined according to the WHO 2008 classification[J]. Blood, 2011, 117(11): 3163–71. DOI:10.1182/blood-2010-10-314682 |
| [8] | Béné MC. Biphenotypic, bilineal, ambiguous or mixed lineage: strange leukemias[J]. Haematologica, 2009, 94(7): 891–3. DOI:10.3324/haematol.2009.007799 |
| [9] | Wolach O, Stone RM. How I treat mixed-phenotype acute leukemia[J]. Blood, 2015, 125(1): 2477–85. |
| [10] | Al-Seraihy AS, Owaidah TM, Ayas M, et al. Clinical characteristics and outcome of children with biphenotypic acute leukemia[J]. Haematologica, 2009, 94(12): 1682–90. DOI:10.3324/haematol.2009.009282 |
| [11] | Park JA, Ghim TT, Bae K, et al. Stem cell transplant in the treatment of childhood biphenotypic acute leukemia[J]. Pediatr Blood Cancer, 2009, 53(23): 444–52. |
 2017, Vol. 44
2017, Vol. 44
