文章信息
- 肾间叶性软骨肉瘤1例报告并文献复习
- Renal Mesenchymal Chondrosarcoma: A Case Report and Literature Review
- 肿瘤防治研究, 2017, 44(11): 779-782
- Cancer Research on Prevention and Treatment, 2017, 44(11): 779-782
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2017.17.0378
- 收稿日期: 2017-04-10
- 修回日期: 2017-08-22
间叶性软骨肉瘤是一种少见的恶性肿瘤,可发生于骨和骨外软组织,其中肾间叶性软骨肉瘤则更是极其罕见的一种,它具有明显的未分化的肿瘤细胞和分化良好的软骨成分。临床上比较少见,需病理组织学及免疫组织化学明确诊断[1]。本文通过分析1例肾间叶性软骨肉瘤患者的临床病理特征,并对相关文献进行复习,以提高对肾间叶性软骨肉瘤的认识。
1 病例资料 1.1 临床资料患者45岁,女,绝经2年。因“右侧腰痛20天,血尿12天”于2017年2月7日入院。患者于2017年1月18日无明显诱因出现右侧腰部疼痛,疼痛能忍受,间断发作,2017年1月26日出现全程肉眼血尿,可见血凝块,不伴有尿频、尿急、尿痛,2017年2月4日出现发热,体温最高达38.9℃,不伴有明显咳嗽、咳痰等症状,既往健康状况良好,否认食物、药物过敏史, 否认输血史, 否认手术外伤史。体检:输尿管走行区域正常,右肾区扣击痛弱阳性,左肾区无叩击痛。入院查中性粒细胞计数7.04×109/L,中性粒细胞百分比81.0%;血沉59 mm/h;C-反应蛋白(CRP)73.92 mg/L;降钙素原(PCT)0.08 ng/ml;Urine-Rt+沉渣:沉渣红细胞558.00 cells/μl,沉渣白细胞6760.30 cells/μl,蛋白(PRO)2+ g/L,潜血(BLD)3+ mg/L,白细胞(LEU)500 cells/μl,浊度2+。
1.2 影像学资料双肾增强磁共振成像(dynamic contrast enhanced—magnetic resonance imaging, DCE—MRI)表现:双肾见多发类圆形无强化长T1长T2信号,边界清。右肾可见6.1 cm×3.9 cm大小团块状混杂等T1稍长T2信号影,其内见条片状长T1长T2信号,并见少量出血。右侧输尿管上段见少量短T1信号。提示:右肾占位,考虑肾癌可能性大,右侧输尿管上段少量积血,双肾多发囊肿,见图 1。肾静脉彩色多普勒超声(color Doppler ultrasound, CDUS)检查提示:右肾占位伴多发钙化灶,双肾静脉超声图像未见明显异常。发射单光子计算机断层扫描仪(emission computed tomograph, ECT)未见肿瘤骨转移。
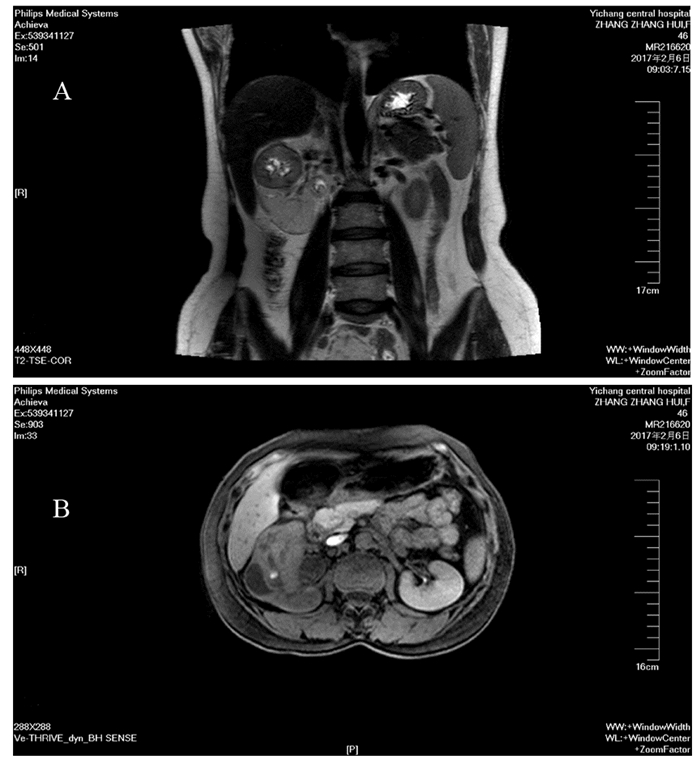
|
| Enhanced magnetic resonance showed right kidney mass, considered as the possibility of renal cancer 图 1 肾间叶性软骨肉瘤患者的增强磁共振 Figure 1 Enhanced magnetic resonance of patient with renal mesenchymal chondrosarcoma |
于2017年2月13日行后腹腔镜下右肾右输尿管全切术,术后病检结果:“右”肾间叶性软骨肉瘤,肿瘤大小6.5 cm×5 cm×5 cm,肿瘤侵犯肾纤维被膜但未浸透纤维被膜,肿瘤部分侵犯肾窦脂肪组织,但肾周脂肪囊、肾盂输尿管开口处及输尿管断端均未见肿瘤,见图 2。
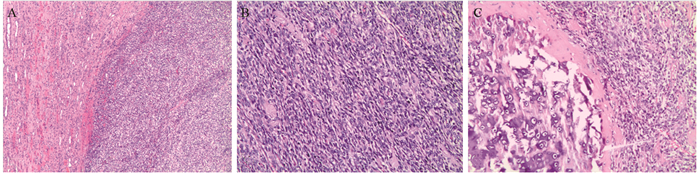
|
| A: the tumor border was clear, the normal kidney tissue was on the left and the tumor tissue was on the right (HE×4); B: tumor cells were arranged in a bundle (HE×10); C: the short spindle tumor cells were mixed with cartilage islands (HE×10) 图 2 肾间叶性软骨肉瘤的形态学特征 Figure 2 Morphological features of renal mesenchymal chondrosarcoma |
免疫组织化学结果:PCK[AE1/AE3](-),EMA(-),GATA3(-),CD34(血管裂隙样区域+),Bcl-2(+),STAT6(-),Ki-67(+20%),CD99(+),CD57(个别散在+),CD10(血管裂隙样区域弱+),RCC(-),CD117(少量弱+),Syn(-),CgA(-),Vimentin(+),CK7(-),CD56(-),D2-40(部分+),NSE(弱+),S-100(软骨区域+)。
患者分别于2017年3月17日、4月13日、5月16日、6月15日行“AI”方案化疗4疗程(ADM 70 mg,d1,IFO 2.0 g,d1~4),消化道反应Ⅰ度,过程顺利。目前患者基础情况较好,密切随访中。
2 讨论间叶性软骨肉瘤是一种少见的恶性肿瘤,约占所有软骨肉瘤的1%[2],可发生于骨和骨外软组织,主要发生于骨组织,发生于骨外软组织者约占1/3,临床少见,诊断较困难。陈琳等[3]研究发现其影像学表现为进行性边界不清的侵袭性溶骨性破坏,多数肿瘤内有不规则的斑点样钙化颗粒, 增强MRI可清楚地显示钙化和非钙化区两个区域的不均匀强化。病理学上典型的软骨岛与间叶性瘤细胞双相图像是诊断本病的病理特征。肿瘤呈灰白或灰红色,质硬韧至鱼肉状不等,常见钙化灶、出血、坏死灶,可显示清晰的软骨样外观。显微镜下见骨和软组织的间叶性软骨肉瘤形态相同,为双相性瘤组织,由圆形、梭形的未分化间叶细胞围绕分化较成熟的透明软骨岛,软骨灶中常伴钙化或骨化,未分化间叶细胞胞质少,细胞核呈梭形、圆形、卵圆形,深染,核分裂相可多可少。根据影像学、病理学及免疫组织化学可明确诊断,治疗上以根治性手术切除为主,但该病侵袭性强,预后一般较差[4]。
其中肾间叶性软骨肉瘤则更是极其罕见的一种,它具有明显的未分化肿瘤细胞和分化良好的软骨成分,在中国知网、维普和PubMed数据库上,以“肾间叶性软骨肉瘤”、“renal”、“kidney”和“mesenchymal chondrosarcoma”为关键词进行检索,检索从建库以来至2017年2月的相关文献。目前国内外关于肾间叶性软骨肉瘤的报道共15篇,包括国内4篇和国外11篇[1, 5-18],见表 1。根据既往研究发现,女性患病率高于男性,加上本例患者,中位患病年龄37.5岁。
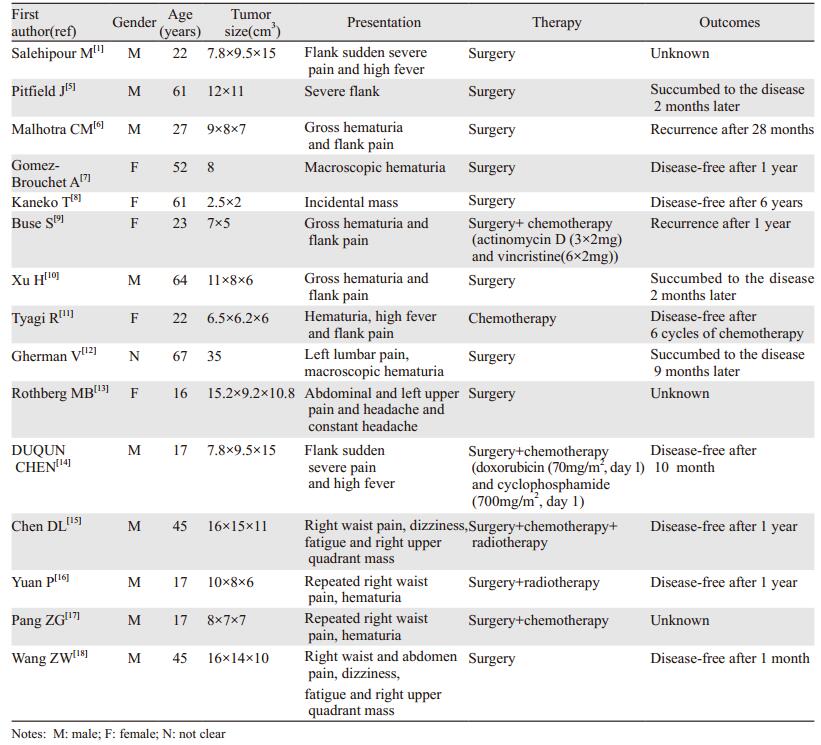
|
其临床症状不具有特异性,包括疼痛、肿胀、软组织包块、血尿、发热等[19]。本例患者的临床表现主要为右侧腰部疼痛、全程肉眼血尿和发热,符合既往研究的肾间叶性软骨肉瘤的临床症状。
2.2 间叶性软骨肉瘤的诊断对于肾间叶性软骨肉瘤的诊断,B型超声、CT、同位素肾扫描、肾动脉造影、尿液脱落细胞学及病理学、免疫组织化学是主要诊断方式。影像学上,常表现为软组织肿块和颗粒样钙化[20]。而其诊断主要依赖于典型的组织病理学诊断:分化良好的软骨岛包围着未分化的梭形间质细胞,以及进一步的免疫组织化学分析。免疫组织化学染色显示软骨细胞S-100呈强阳性, 未分化间叶瘤细胞呈Vimentin、NSE、leu-7、CD99阳性。本例患者肾静脉彩色多普勒US检查提示:右肾内可见中等回声包块及右肾占位伴多发钙化灶。双肾MRI增强扫描提示:右肾可见团块状混杂信号影。均符合肾间叶性软骨肉瘤的影像学表现。并且病理结果及免疫组织化学结果提示:CD99(+),Vimentin(+),NSE(弱+),S-100(软骨区域+)均符合肾间叶性软骨肉瘤的诊断。有研究证实,Indianhedgehog(Ihh)作为与软骨细胞分化密切相关的基因在所有软骨肉瘤中表达,并与肿瘤的分化程度有关,预示着这类相关基因有可能成为间叶性软骨肉瘤的诊断性标志物[21],具体作用机制有待进一步研究。
2.3 间叶性软骨肉瘤的鉴别诊断肾间叶性软骨肉瘤的病理学检查应与Wilms瘤/原始神经外胚叶肿瘤(PNET)(影像学上常表现为纯溶骨性渗透性骨质破坏,缺乏软骨性钙化的表现以及软骨岛)、低分化滑膜肉瘤(肿瘤内尽管可见血管外皮瘤样区域或钙化灶,但缺乏高分化软骨岛)及恶性血管外皮瘤(该瘤无散在的软骨小灶,钙化及骨化也极少且瘤细胞较大,异型性也较间叶性软骨肉瘤明显)、肾恶性横纹肌样瘤(常有特殊的发病部位,无软骨分化)、巨大肾癌等相鉴别。根据其岛屿状散在的软骨样区, 并结合不同肿瘤免疫组织化学染色特点有助于鉴别诊断。
2.4 间叶性软骨肉瘤的治疗间叶性软骨肉瘤的治疗主要是根治性切除术,研究表明术后辅以放化疗或结合新辅助化疗可以得到更为理想的效果。Cesari等[22]通过分析28例患有间叶性软骨肉瘤的患者单纯接受手术和同时辅以化疗患者的10年生存率和10年无病生存期,发现进行肿瘤根治性手术治疗的患者比没有手术治疗的患者提高了10年生存率,手术同时结合化疗的患者比单纯接受手术治疗的患者提高了10年无病生存期。Huvos等[23]也进行了类似分析,35例患者中绝大多数接受了新辅助化疗和辅助化疗,中位生存期为37.9月,3、5和10年的总生存率分别达到50%、42%和28%。可见肾间叶性软骨肉瘤的治疗主要是通过评估患者病情行根治性手术治疗,必要时辅以新辅助放化疗和术后辅助放化疗。
2.5 间叶性软骨肉瘤的预后间叶性软骨肉瘤是一种高度侵袭性的恶性肿瘤,容易发生转移,主要的转移部位包括股骨、甲状腺、输尿管和肺,并且进展迅速,预后一般较差。Dantonello等[24]注意到与其他肉瘤相似,年龄对于间叶性软骨肉瘤可能是一个有利的预后因素,年轻患者的预后比老年患者的预后更好。但关于肾间叶性软骨肉瘤的报道较少,其确切的预后以及确实可行的治疗方案仍未可知。通过此病例报道希望对肾间叶性软骨肉瘤有更深一步的了解,并为将来的研究分析提供可供参考的依据。
| [1] | Salehipour M, Hosseinzadeh M, Sisakhti AM, et al. Renal Extra Skeletal Mesenchymal Chondrosarcoma: A Case Repor[J]. Urol Case Rep, 2017, 12: 23–5. DOI:10.1016/j.eucr.2016.12.013 |
| [2] | Trembath DG, Dash R, Major NM, et al. Cytopathology of mesenchymal chondrosarcomas: a report and comparison of four patients[J]. Cancer, 2003, 99(4): 211–6. DOI:10.1002/cncr.11300 |
| [3] | 陈琳, 朱岩, 范钦和, 等. 间叶性软骨肉瘤6例临床病理分析[J]. 临床与实验病理学杂志, 2012, 28(4): 439–41. [ Chen L, Zhu Y, Fan QH, et al. Clinicopathological analysis of 6 cases of mesenchymal chondrosarcoma[J]. Lin Chuang Yu Shi Yan Bing Li Xue Za Zhi, 2012, 28(4): 439–41. ] |
| [4] | 唐顺, 郭卫, 汤小东, 等. 间叶性软骨肉瘤的外科治疗及预后分析[J]. 中国肿瘤临床, 2013, 40(16): 984–7. [ Tan S, Guo W, Tang XD, et al. Surgical treatment and prognosis of mesenchymal chondrosarcoma[J]. Zhongguo Zhong Liu Lin Chuang, 2013, 40(16): 984–7. DOI:10.3969/j.issn.1000-8179.20121855 ] |
| [5] | Pitfield J, Preston BJ, Smith PG, et al. A calcified renal mass: chondrosarcoma of kidney[J]. Br J Radiol, 1981, 54(639): 262. DOI:10.1259/0007-1285-54-639-262 |
| [6] | Malhotra CM, Doolittle CH, Rodil JV, et al. Mesenchymal chondrosarcoma of the kidney[J]. Cancer, 1984, 54(11): 2495–9. DOI:10.1002/(ISSN)1097-0142 |
| [7] | Gomez-Brouchet A, Soulie M, Delisle MB, et al. Mesenchymal chondrosarcoma of the kidney[J]. J Urol, 2001, 166(6): 2305. DOI:10.1016/S0022-5347(05)65561-9 |
| [8] | Kaneko T, Suzuki Y, Takata R, et al. Extraskeletal mesenchymal chondrosarcoma of the kidney[J]. Int J Urol, 2006, 13(3): 285–6. DOI:10.1111/j.1442-2042.2006.01293.x |
| [9] | Buse S, Behnisch W, Kulozik A, et al. Primary chondrosarcoma of the kidney: case report and review of the literature[J]. Urol Int, 2009, 83(1): 116–8. DOI:10.1159/000224880 |
| [10] | Xu H, Shao M, Sun H, et al. Primary mesenchymal chondrosarcoma of the kidney with synchronous implant and infiltrating urothelial carcinoma of the ureter[J]. Diagn Pathol, 2012, 7: 125. DOI:10.1186/1746-1596-7-125 |
| [11] | Tyagi R, Kakkar N, Vasishta RK, et al. Mesenchymal chondrosarcoma of kidney[J]. Indian J Urology, 2014, 30(30): 225–7. |
| [12] | Gherman V, Tomuleasa C, Bungardean C, et al. Management of renal extraskeletal mesenchymal chondrosarcoma[J]. BMC Surgery, 2014, 14: 107. DOI:10.1186/1471-2482-14-107 |
| [13] | Rothberg MB, Bhalodi AA, Reda EF, et al. Primary Renal Mesenchymal Chondrosarcoma: A Case Report[J]. Urol, 2015, 85(3): 676–8. DOI:10.1016/j.urology.2014.11.032 |
| [14] | Chen D, Ye ZI, Wu X, et al. Primary mesenchymal chondrosarcoma with bilateral kidney invasion and calcification in renal pelvis: A case report and review of the literature[J]. Oncol Lett, 2015, 10(2): 1075–8. |
| [15] | 陈德理, 杜淮生, 余波, 等. 肾间叶性软骨肉瘤(附一例报告)[J]. 蚌埠医药, 1986(3): 111–2. [ Chen DL, Du HS, Yu B, et al. Renal mesenchymal chondrosarcoma(Report of one case)[J]. Bengbu Yi Yao, 1986(3): 111–2. ] |
| [16] | 袁鹏, 王佳, 石明, 等. 肾脏间叶性软骨肉瘤1例[J]. 临床泌尿外科杂志, 2002, 17(2): 55. [ Yuan P, Wang J, Shi M, et al. Renal mesenchymal chondrosarcoma: a case report[J]. Lin Chuang Mi Niao Wai Ke Za Zhi, 2002, 17(2): 55. ] |
| [17] | 庞宗国, 徐泳, 张贤良. 肾原发间叶性软骨肉瘤1例[J]. 华西医学, 2003, 18(2): 267. [ Pang ZG, Xu Y, Zhang XL. Primary renal mesenchymal chondrosarcoma: a case report[J]. Hua Xi Yi Xue, 2003, 18(2): 267. ] |
| [18] | 王正位, 王磊, 单锋芝, 等. 肾脏间叶性软骨肉瘤一例并文献复习[J]. 中华肿瘤防治杂志, 2015, 22(19): 1578–9. [ Wang ZW, Wang L, Shan FZ, et al. Renal mesenchymal chondrosarcoma: a case report and review of the literature[J]. Zhonghua Zhong Liu Fang Zhi Za Zhi, 2015, 22(19): 1578–9. ] |
| [19] | Murphey MD, Walker EA, Wilson AJ, et al. From the archives of the AFIP: imaging of primary chondrosarcoma: radiologic-pathologic correlation[J]. Radiographics, 2003, 23(5): 1245–78. DOI:10.1148/rg.235035134 |
| [20] | Hashimoto N, Ueda T, Joyama S, et al. Extraskeletal mesenchymal chondrosarcoma: an imaging review of ten new patients[J]. Skeletal Radiol, 2005, 34(12): 785–92. DOI:10.1007/s00256-005-0025-9 |
| [21] | Wang L, Motoi T, Khanin R, et al. Identification of a novel, recurrent HEY1-NCOA2 fusion in mesenchymal chondrosarcoma based on a genome-wide screen of exon-level expression data[J]. Genes Chromosomes Cancer, 2012, 51(2): 127–39. DOI:10.1002/gcc.v51.2 |
| [22] | Cesari M, Bertoni F, Bacchini P, et al. Mesenchymal chondrosarcoma. An analysis of patients treated at a single institution[J]. Tumori, 2007, 93(5): 423–7. |
| [23] | Huvos AG, Rosen G, Dabska M, et al. Mesenchymal chondrosarcoma. A clinicopathologic analysis of 35 patients with emphasis on treatment[J]. Cancer, 1983, 51(7): 1230–7. DOI:10.1002/(ISSN)1097-0142 |
| [24] | Dantonello TM, Int-Veen C, Leuschner I, et al. Mesenchymal chondrosarcoma of soft tissues and bone in children, adolescents and young adults: experiences of the CWS and COSS study groups[J]. Cancer, 2008, 112(11): 2424–31. DOI:10.1002/(ISSN)1097-0142 |
 2017, Vol. 44
2017, Vol. 44


