文章信息
- 双氢青蒿素对人下咽癌裸鼠移植瘤的抑制作用
- Antitumor Effect of Dihydroartemisinin on Hypopharyngeal Cancer in Nude Mice with Transplanted Tumor
- 肿瘤防治研究, 2017, 44(10): 647-651
- Cancer Research on Prevention and Treatment, 2017, 44(10): 647-651
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2017.17.0370
- 收稿日期: 2017-04-07
- 修回日期: 2017-07-14
2. 050021 石家庄, 河北中医学院免疫学与病原生物学教研室
2. Department of Pathobiology and Immunology, Hebei University of Chinese Medicine, Shijiazhuang 050021, China
下咽癌(hypopharyngeal cancer)的发病率占头颈部恶性肿瘤的1.4%~5.0%,占全身恶性肿瘤的0.3%,是常见的头颈部恶性肿瘤[1]。尽管临床上保留喉功能的多种综合治疗手段提高了下咽癌患者的生活质量,但总生存率并没有明显提高[2]。因此,需要寻找治疗下咽癌的新策略。
双氢青蒿素(dihydroartemisinin, DHA)是抗疟疾药青蒿素(artemisinin)的重要衍生物[3],能在体内外发挥抗肿瘤作用,极有潜力成为价廉且有效的抗癌药[4]。本课题组前期研究证实,DHA能通过抑制信号转导与转录激活因子3(signal transducers and activators of transcription 3, STAT3)磷酸化(Tyr705)来阻断Jak2/STAT3信号通路,导致人咽鳞癌细胞Fadu周期阻滞而凋亡[5]。本实验利用荷瘤裸鼠模型,研究不同浓度的DHA体内抑制Fadu细胞生长的效应,为DHA在下咽癌治疗中的进一步应用提供参考。
1 材料与方法 1.1 细胞系人咽鳞癌细胞株Fadu为白求恩国际和平医院耳鼻喉头颈外科实验室保存。
1.2 主要试剂双氢青蒿素购自日本CTI公司。顺铂(Cisplatin, DDP)购自济南齐鲁制药厂。
1.3 方法 1.3.1 细胞培养用含10%小牛血清、1%青链霉素双抗的DMEM(高糖)培养液作为完全培养液。细胞接种后置5%CO2培养箱中37℃连续培养。
1.3.2 克隆形成实验将Fadu细胞分别用10、20、40 μmol/L DHA处理24 h后,铺于6孔板上(200个/孔),培养10~14天,计算克隆数目(直径≥60 μm或50个细胞以上的细胞团为一个克隆)及克隆形成抑制率,分析DHA体外抑制肿瘤形成能力。
1.3.3 裸鼠皮下移植瘤模型的建立4~5周龄的BALB/c nu/nu雄性裸鼠(体重16~18)g,共30只,分别用于建立Fadu细胞的裸鼠皮下移植瘤模型。将裸鼠随机分为5组,每组6只,右腋皮下注射无血清DMEM重悬的Fadu细胞悬液0.2 ml(1×107个/毫升)。肿瘤长至直径约5 mm时,开始对上述荷瘤裸鼠经腹腔注射药物进行干预。
1.3.4 药物干预及裸鼠分组(1)处理组(DHA组):根据课题组预实验基础及已有文献[6],每日腹腔注射DHA用量为25 mg/kg、50 mg/kg、100 mg/kg分别为DHA低剂量组、DHA中剂量组、DHA高剂量组;(2)化疗组(DDP组):每隔1日,腹腔注射顺铂,用量为2 mg/kg体重;(3)溶剂对照组(NC组):腹腔注射相同体积的DMSO作为溶剂对照组。
1.3.5 移植瘤体积变化的测量每3~5天用游标卡尺测量肿瘤的长、宽,按公式V=L×I2×0.50计算瘤体积(V代表瘤体积,L为长径,I为短径),并绘制肿瘤生长曲线;每次测量肿瘤时称小鼠体重,计算相对体重。
1.3.6 抑瘤率检测药物干预3周后,处死裸鼠;剥离肿瘤组织称重,并按公式(1-实验组平均瘤重/对照组平均瘤重)×100%,计算抑瘤率(%);并剖腹取材,称取肝、脾、肾等器官的重量。
1.4 统计学方法各组实验数据用SPSS16.0统计软件进行分析,采用单因素方差分析(One-way ANOVA),两两比较用Tukey检验,数据用均数±标准差的方式表示(n=3),P < 0.05为差异有统计学意义。
2 结果 2.1 DHA抑制人下咽癌Fadu细胞增殖不同浓度的DHA作用Fadu细胞24 h,然后进行克隆形成实验,结果显示,随DHA浓度增加,存活细胞数目减少,见图 1。说明DHA能抑制Fadu细胞的增殖,且有剂量依赖性。
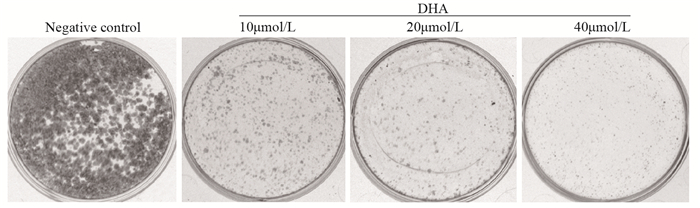
|
| 图 1 克隆形成实验分析不同浓度DHA处理细胞24h后对Fadu细胞增殖的抑制作用 Figure 1 Inhibitory effect of different concentrations of DHA on Fadu cells proliferation detected by clonogenic assay after 24h |
经DHA处理后,三种DHA剂量组移植瘤体积均小于NC组,差异有统计学意义(P=0.026),说明DHA能抑制裸鼠移植瘤的生长,见图 2。
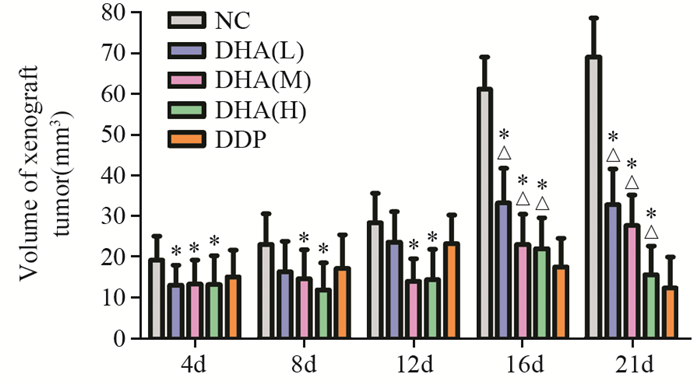
|
| *: P < 0.05, compared with DDP groups; △: P < 0.05, compared with NC group; DHA: dihydroartemisinin; DDP: cisplatin; NC: negative group 图 2 不同浓度DHA对肿瘤体积的影响 Figure 2 Effect of different concentrations of DHA on tumor volume |
DHA处理后4天,测量结果如图 2显示,DHA低剂量组(13.01±4.97)mm3、中剂量组(13.38±5.87)mm3和高剂量组(13.21±5.12)mm3的移植瘤体积均明显小于DDP组(15.10±6.50)mm3。差异有统计学意义(P=0.047),且DHA各浓度组的组间差异无统计学意义(P=0.289),见图 2。结果说明,低、中、高剂量DHA抑制早期或小体积Fadu移植瘤生长的作用均优于顺铂。
药物处理后8~12天,DHA中剂量组移植瘤体积(14.06±5.53)mm3和高剂量组(14.46±7.46)mm3均明显小于DDP组(23.27±7.01)mm3,差异有统计学意义(P=0.004, P=0.028);DHA中、高剂量组之间差异无统计学意义(P=0.347)。DHA低剂量组的移植瘤体积(23.63±7.48)mm3与DDP组相比差异无统计学意义(P=0.347),见图 2。结果说明,中、高剂量DHA抑制中期或中等体积Fadu移植瘤生长的作用均优于顺铂。
在药物处理的21天,剥离肿瘤组织,测量肿瘤长径及短径,计算体积。低、中、高剂量DHA处理组的肿瘤体积均明显小于NC组(69.01±9.57)mm3。差异有统计学意义(P=0.004),且组间比较差异有统计学意义(P=0.006),见图 2。结果说明,DHA能抑制裸鼠移植瘤的生长,并且随DHA剂量增加抑瘤效果明显增加。低、中剂量DHA处理组的肿瘤体积均明显大于DDP组(12.37±7.56)mm3,差异有统计学意义(P=0.006);其中DHA高剂量组的移植瘤体积(13.64±7.02)mm3稍大于DDP组,差异无统计学意义(P=0.273)。提示低、中剂量的DHA虽能抑制Fadu移植瘤生长,但抑瘤效果不如顺铂;高剂量DHA抑制Fadu移植瘤生长作用与顺铂相同。
2.3 不同浓度DHA对Fadu移植瘤重量的影响剥离肿瘤组织后称重,低、中、高剂量DHA处理组的肿瘤重量均明显小于NC组(64.17±10.78)mg。差异有统计学意义(P=0.004)且组间比较差异均有统计学意义(P=0.045, P=0.008, P=0.008),见图 3。结果提示,不同剂量DHA均能抑制Fadu移植瘤的生长,随DHA剂量增加抑瘤效果明显增加。
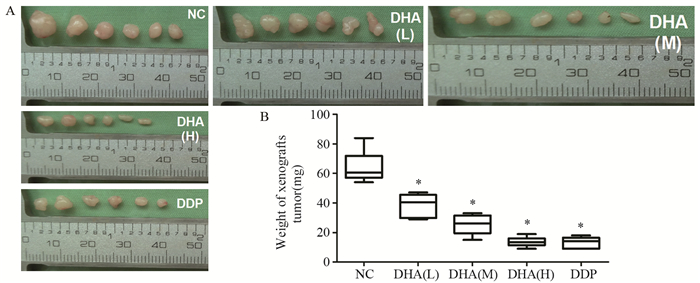
|
| A: volume changes of xenografts tumor; B: weight changes of xenografts tumor; *: P < 0.05, compared with NC group 图 3 不同浓度DHA对Fadu移植瘤体积和重量的影响 Figure 3 Effect of different concentrations of DHA on volume and weight of xenografts tumor |
低剂量DHA组(38.67±7.87)mg与中剂量DHA组(25.33±7.06)mg的移植瘤重量均明显大于DDP组(13.33±3.72)mg,差异有统计学意义(P=0.004, P=0.013)。说明低、中剂量DHA虽能抑制Fadu移植瘤生长,但抑瘤效果不如顺铂。
高剂量DHA组的移植瘤重量(13.67±3.33)mg稍大于DDP组,组间差异无统计学意义(P=1.00)。结果说明,高剂量DHA抑瘤效果与顺铂相同。
低、中、高剂量DHA处理组的抑瘤率分别为39.74%、60.52%及78.70%,DDP组的抑瘤率为79.22%。此结果与DHA影响移植瘤重量结果一致,说明DHA能有效抑制Fadu移植瘤的生长,抑瘤率呈浓度依赖性,且高剂量DHA抑瘤效果与顺铂相同。
2.4 DHA处理对裸鼠体重及肝、脾、肾重量的影响DHA高剂量组裸鼠体重与NC组相比稍下降,差异无统计学意义(P=0.465)。各组肾的重量差异无统计学意义(P=0.361),说明DHA不影响裸鼠体重及肾重量,见图 4。
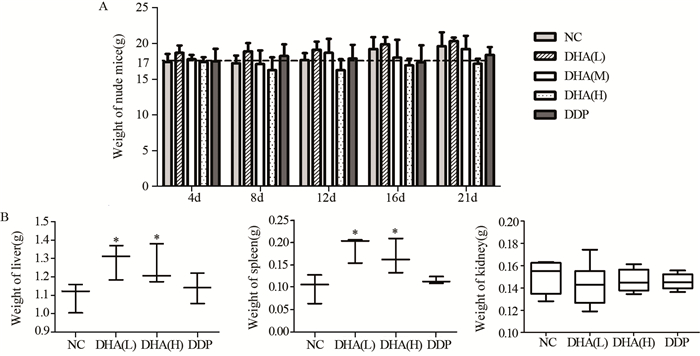
|
| *: P < 0.05, compared with NC group 图 4 DHA处理对裸鼠体重(A)及肝、脾、肾重量(B)的影响 Figure 4 Effect of DHA on body(A), liver, spleen and kidney(B) weight of nude mice |
DHA低剂量组的肝、脾重量(1.29±0.09)g、(0.19±0.03)g及高剂量组的肝、脾重量(1.25±0.11)g、(0.17±0.04)g均值显著高于NC组(1.09±0.08)g、(0.09±0.03)g,差异有统计学意义(均P=0.049)。DHA低、高剂量组间差异无统计学意义(均P=0.827)。结果说明,不同剂量DHA均能提高荷瘤裸鼠的肝、脾重量。
DHA低、高剂量组的肝重量均值稍高于DDP组(1.14±0.08)g,差异无统计学意义(P=0.127、P=0.275);DHA低、高剂量组的脾重量稍高于DDP组(0.11±0.03)g,差异有统计学意义(均P=0.049)。结果说明,不同剂量DHA与顺铂相比能显著提高荷瘤裸鼠的脾重量。
3 讨论青蒿素是中药黄花蒿Artemisia annua L.的提纯物[3]。双氢青蒿素、蒿甲醚(artemether)及青蒿琥酯(artesunate)是青蒿素的三种主要衍生物。1972年中国人将青蒿素及其衍生物主要用于治疗各种疟疾;80年代早期,开始用于治疗人类血吸虫病[7]。双氢青蒿素是FDA批准的用于治疗疟疾的药物,通过细胞周期阻滞及破坏血管生成、抑制肿瘤生长或诱导肿瘤细胞凋亡,还能逆转肿瘤细胞的多药耐药性等[6]。近年来发现,双氢青蒿素可与转铁蛋白结合,选择性杀伤肿瘤细胞,极有可能成为质优价廉的高效抗肿瘤药物[6]。
本实验体外研究发现,双氢青蒿素抑制Fadu细胞的增殖作用具有浓度依赖性。与此一致的是有研究报道,在体外双氢青蒿素通过caspase-3通路诱导口腔癌细胞YD-10B[8]及头颈鳞癌细胞凋亡[5, 9]。另外,双氢青蒿素还能抑制由狗口腔乳头瘤病毒(canine oral papillomavirus)诱导的肿瘤形成,但不能抑制病毒复制[10]。本实验利用Fadu裸鼠移植瘤模型的研究也发现,双氢青蒿素抑制Fadu移植瘤的生长也具有剂量依赖性。这种剂量依赖性对早期咽鳞癌生长的抑制作用差异不显著,故早期咽鳞癌可选用低浓度DHA进行干预,而中、高浓度DHA均可用于中晚期咽鳞癌。进一步研究发现,DHA高浓度组的抑瘤率及肿瘤重量均与顺铂组接近。结果提示,高浓度DHA有可能单独用于咽鳞癌化疗。青蒿素抑制胃癌细胞株SGC-7901裸鼠移植瘤的体内实验也表明,高、中剂量组单独作用的抗肿瘤效果强于临床化疗药物5-Fu[11]。近来,10位的宫颈癌患者(Ⅲ期或Ⅳ期)[12]和23位转移性乳腺癌患者[13]的临床研究也表明双氢青蒿素具有抗肿瘤效果。
本研究显示,高剂量DHA为有效剂量,干预3周对裸鼠的体重及肾的重量没有影响。与此一致的是,也有研究表明,DHA与化疗药物联合应用对小鼠的体重没有影响,对肝、脾、肾及心脏无毒性作用[14]。对于长期应用双氢青蒿素安全性的临床实验表明,用双氢青蒿素-哌喹治疗75例疟疾患者8周,患者没有发生严重的肾损伤[15]。除此之外,有研究观察到双氢青蒿素-哌喹治疗10 591例疟疾患者28天,没有改变肝脏中酶类表达水平及活性[16]。本研究还发现,DHA处理组的脾、肝重量比NC组增加。与此结果一致的是,有研究表明,DHA能促进荷瘤动物脾细胞增殖,并降低脾细胞中CD4+CD25+Foxp3+的调节性T细胞数量,调控免疫应答[17]。另有研究表明,DHA能减少SD大鼠模型的肺损伤,并减轻肝纤维化[18-20]。便长期应用高剂量双氢青蒿素是否会产生毒性的问题,值得我们关注和研究。
利用结构修饰或剂型改变开发水溶性更高、疗效更好的青蒿素类药物,将成为肿瘤化疗新药研发的重点方向。本实验研究的双氢青蒿素最佳给药剂量及临床前安全性评价将为青蒿素类药物开发及临床研究提供实验依据。
| [1] | Argiris A, Karamouzis MV, Raben D, et al. Head and neck cancer[J]. Lancet, 2008, 371(9625): 1695–709. DOI:10.1016/S0140-6736(08)60728-X |
| [2] | Sánchez Barrueco A, González Galán F, Lora Pablos D, et al. HPV in larynx squamous cell carcinoma:New serotypes and survival study within 10-year follow-up[J]. Otolaryngol Head Neck Surg, 2017, 156(4): 677–82. DOI:10.1177/0194599817695545 |
| [3] | Tu Y. The discovery of artemisinin (qinghaosu) and gifts from Chinese medicine[J]. Nat Med, 2011, 17(10): 1217–20. DOI:10.1038/nm.2471 |
| [4] | Ho WE, Peh HY, Chan TK, et al. Artemisinins:Pharmacological actions beyond anti-malarial[J]. Pharmacol Ther, 2014, 142(1): 126–39. DOI:10.1016/j.pharmthera.2013.12.001 |
| [5] | Jia L, Song Q, Zhou C, et al. Dihydroartemisinin as a putative STAT3 inhibitor, suppresses the growth of head and neck squamous cell carcinoma by targeting Jak2/STAT3 signaling[J]. PLoS One, 2016, 11(1): e0147157. DOI:10.1371/journal.pone.0147157 |
| [6] | Efferth T. From ancient herb to modern drug:Artemisia annua and artemisinin for cancer therapy[J]. Semin Cancer Biol, 2017, pii:S1044-579X(17): 30029–9. |
| [7] | Liu YX, Wu W, Liang YJ, et al. New uses for old drugs:the tale of artemisinin derivatives in the elimination of schistosomiasis japonica in China[J]. Molecules, 2014, 19(9): 15058–74. DOI:10.3390/molecules190915058 |
| [8] | Nam W, Tak J, Ryu JK, et al. Effects of artemisinin and its derivatives on growth inhibition and apoptosis of oral cancer cells[J]. Head Neck, 2007, 29(4): 335–40. DOI:10.1002/(ISSN)1097-0347 |
| [9] | Lin R, Zhang Z, Chen L, et al. Dihydroartemisinin (DHA) induces ferroptosis and causes cell cycle arrest in head and neck carcinoma cells[J]. Cancer Lett, 2016, 381(1): 165–75. DOI:10.1016/j.canlet.2016.07.033 |
| [10] | Disbrow GL, Baege AC, Kierpiec KA, et al. Dihydroartemisinin is cytotoxic to papillomavirus-expressing epithelial cells in vitro and in vivo[J]. Cancer Res, 2005, 65(23): 10854–61. DOI:10.1158/0008-5472.CAN-05-1216 |
| [11] | 牛高华, 尚凡晶, 武华. 青蒿素对人胃癌裸鼠移植瘤的生长抑制作用及其机制的研究[J]. 中华肿瘤防治杂志, 2010, 17(12): 903–7. [ Niu GH, Shang FJ, Wu H. Growth inhibition activity and antitumor mechanism of artemisinin on xenografts of human gastric cancer in nude mice[J]. Zhonghua Zhong Liu Fang Zhi Za Zhi, 2010, 17(12): 903–7. ] |
| [12] | Jansen FH, Adoubi I, JC KC, et al. First study of oral Artenimol-R in advanced cervical cancer:clinical benefit, tolerability and tumor markers[J]. Anticancer Res, 2011, 31(12): 4417–22. |
| [13] | Ericsson T, Sundell J, Torkelsson A, et al. Effects of artemisinin antimalarials on Cytochrome P450 enzymes in vitro using recombinant enzymes and human liver microsomes:potential implications for combination therapies[J]. Xenobiotica, 2014, 44(7): 615–26. DOI:10.3109/00498254.2013.878815 |
| [14] | Tai X, Cai XB, Zhang Z, et al. In vitro and in vivo inhibition of tumor cell viability by combined dihydroartemisinin and doxorubicin treatment, and the underlying mechanism[J]. Oncol Lett, 2016, 12(5): 3701–6. |
| [15] | Kheng S, Muth S, Taylor WR, et al. Tolerability and safety of weekly primaquine against relapse of Plasmodium vivax in Cambodians with glucose-6-phosphate dehydrogenase deficiency[J]. BMC Med, 2015, 13: 203. DOI:10.1186/s12916-015-0441-1 |
| [16] | Adjei A, Narh-Bana S, Amu A, et al. Treatment outcomes in a safety observational study of dihydroartemisinin/piperaquine (Eurartesim((R))) in the treatment of uncomplicated malaria at public health facilities in four African countries[J]. Malaria J, 2016, 15: 43. DOI:10.1186/s12936-016-1099-7 |
| [17] | Noori S, Hassan ZM. Dihydroartemisinin shift the immune response towards Th1, inhibit the tumor growth in vitro and in vivo[J]. Cell Immunol, 2011, 271(1): 67–72. DOI:10.1016/j.cellimm.2011.06.008 |
| [18] | Chen Q, Chen L, Kong D, et al. Dihydroartemisinin alleviates bile duct ligation-induced liver fibrosis and hepatic stellate cell activation by interfering with the PDGF-betaR/ERK signaling pathway[J]. Int Immunopharmacol, 2016, 34: 250–8. DOI:10.1016/j.intimp.2016.03.011 |
| [19] | Chen Q, Chen L, Wu X, et al. Dihydroartemisinin prevents liver fibrosis in bile duct ligated rats by inducing hepatic stellate cell apoptosis through modulating the PI3K/Akt pathway[J]. IUBMB Life, 2016, 68(3): 220–31. DOI:10.1002/iub.v68.3 |
| [20] | Xu W, Lu C, Zhang F, et al. Dihydroartemisinin restricts hepatic stellate cell contraction via an FXR-S1PR2-dependent mechanism[J]. IUBMB Life, 2016, 68(5): 376–87. DOI:10.1002/iub.v68.5 |
 2017, Vol. 44
2017, Vol. 44


