文章信息
- 18F-FDG代谢分布特点对高代谢肺占位病变的鉴别诊断价值
- Value of 18F-FDG Distribution for Differential Diagnosis of High Metabolic Lung Lesions
- 肿瘤防治研究, 2017, 44(12): 823-826
- Cancer Research on Prevention and Treatment, 2017, 44(12): 823-826
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2017.17.0302
- 收稿日期: 2017-03-22
- 修回日期: 2017-10-12
肺部占位的良恶性鉴别诊断,一直是临床关注的重点,早期明确病变性质对于临床决策至关重要。
18F-FDG PET/CT能同时提供病变的CT特征及葡萄糖代谢的生理学特征,大大提高了肺占位尤其是孤立肺结节诊断的准确性[1-2],既往的研究中多采用最大标准摄取值(SUVmax)作为半定量指标衡量病变的代谢程度[2-4],然而18F-FDG并非肿瘤特异性显像剂,许多炎性病变FDG代谢增高,与肺癌代谢有很大重叠,易造成假阳性的诊断[5-6]。本研究选择全部表现为高代谢的肺占位,回顾性分析良恶性两组病变代谢分布的差异,探讨FDG代谢分布特点对高代谢肺占位的鉴别诊断价值。
1 资料与方法 1.1 一般资料收集2009年12月至2015年10月因肺占位于北京大学肿瘤医院行18F-FDG PET/CT检查的病例,选择肺占位呈结节或肿块样,病变FDG代谢活跃(高于纵隔心血池)且病变内代谢不均匀,有穿刺或手术病理者。不考虑占位大小、淋巴结与远处转移情况。排除代谢较低(低于纵隔心血池)、代谢均匀或病灶较小无法分辨代谢分布情况的病例。符合入选标准的共102例,分为肺癌组71例(男52例、女19例,年龄(59.9±10.9)岁,鳞癌37例、腺癌28例、小细胞肺癌6例)与炎性病变组31例(男27例、女4例,年龄(58.8±11.1)岁,结核17例、非结核炎性病变14例;其中真菌感染1例,炎性假瘤2例,慢性肺脓肿2例,慢性炎症9例)。
1.2 PET/CT成像方法18F-FDG PET/CT扫描采用飞利浦公司PET/CT显像仪(Gemini TF 16, Philips, Netherland),其中PET/CT部分采用LYSO晶体和微电子设备,CT部分为16排高分辨螺旋CT。所有患者检查前均空腹6 h以上,测定患者空腹血糖水平<10 mmol/L。按患者体重(3.0~3.7 MBq/kg)静脉注射18F-FDG后,患者平静休息,60 min左右行颅脑及躯干部PET/CT图像采集。躯干部PET采集1.0分钟/床位,9或10床位;头部PET:7~10分钟/床位,1床位。衰减校正平扫CT:120 kV,100 mAs;OSEM法重建(重建层厚3 mm)。
1.3 图像分析由具有多年诊断经验的核医学医师利用Philips GEMINI TR16软件阅片。在最大横断面测量病灶短径d。采用半定量分析法,以病灶中心为分界,近肺门侧为近心端(proximal part),近胸膜侧为远心端(distal part),参考病灶所在的肺段位置,以肺段支气管动脉为近心端,肉眼观察代谢最高区位于近心端或远心端,手动勾画病灶近心端与远心端的容积感兴趣区(region of interest, ROI),先勾画高代谢区的ROI,在对侧勾画相同大小的ROI,软件自动测量病灶的最大标准摄取值(SUVmax),并计算两者的比值(P/D值),并将比值分为两种类型,即近心端浓聚(P/D>1)或者远心端浓聚(P/D<1)。
1.4 统计学方法采用SPSS20软件进行数据统计分析,两组病例间SUVmax及短径的比较采用t检验,两组病例间比值分型的差异采用卡方检验,以P<0.05为差异有统计学意义。
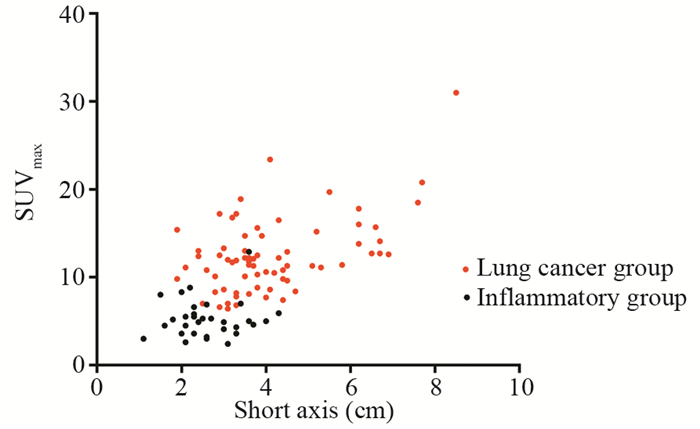
2 结果 2.1 肺癌组与炎性病变组病变的代谢程度与病灶大小肺癌组SUVmax为6.4~31.0,炎性病变组SUVmax为2.6~12.9,肺癌组高于炎性组,差异有统计学意义((12.46±4.23)vs.(5.26±2.17), P<0.001),但两者有很大重叠。肺癌组短径d为1.9~8.5 cm,炎性病变组短径d为1.1~4.3 cm,肺癌组大于炎性组,差异有统计学意义((4.12±1.46)vs.(2.63±0.76), P<0.001),见图 1。
|
| 图 1 肺癌组与炎性组病灶SUVmax及短径分布图 Figure 1 Distribution of SUVmax and short axis in lung cancer group and inflammatory group |
肺癌组P/D>1者占91.5%(65/71),炎性病变组P/D<1者占80.6%(25/31),两组差异有统计学意义(P<0.001)。以P/D>1为标准,对肺癌诊断的敏感度为91.5%,特异性为80.6%,准确性88.2%,见表 1,图 2~3。
|
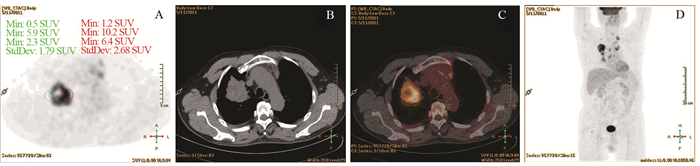
| Patient, male, 67 years old. A moderately differentiated adenocarcinoma on the upper lobe of the right lung, the size was about 5.3×6.2cm, SUVmax was 11.1. Image A, B, C and D showed PET axial tomography image, CT axial tomography image, PET/CT fusion image and body maximum intensity projection (MIP). The PET images showed that the SUVmax of proximal part was 10.2, the SUVmax of distal part was 5.9, P/D value was 1.73 图 2 一例典型的肺癌PET/CT图像 Figure 2 PET/CT image of one typical case of lung cancer |
|
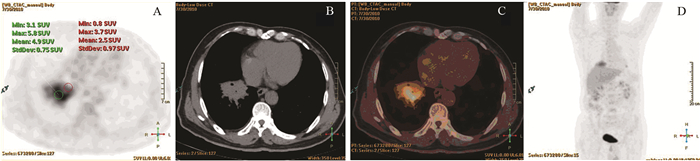
| Patient, male, 37 years old. An inflammatory infiltration with lung abscess on the lower lobe of the right lung, the size was about 5.9×4.3cm, SUVmax was 5.9. Image A, B, C and D showed PET axial tomography image, CT axial tomography image, PET/CT fusion image and body MIP. The PET images showed the SUVmax of proximal part was 3.7, the SUVmax of distal part was 5.8, P/D value was 0.64 图 3 肺炎性病变的PET/CT图像 Figure 3 PET/CT image of inflammatory lung lesion |
18F-FDG PET/CT与单纯的CT或PET相比,大大提高了对肺占位尤其是SPN诊断的敏感度(88%~97%)与特异性(72%~89%)[1-2, 7-9],被广泛应用于临床。多数的研究中以目测或半定量判断病灶的FDG代谢程度,最常用的半定量阈值为SUVmax≥2.5,提高SUVmax阈值,诊断的特异性提高,但敏感度下降[2, 5, 9]。假阳性的病灶包括肺的感染性疾病如(肺炎、肺脓肿、曲霉菌病),肉芽肿性疾病(结核、结节病,组织包浆菌病,韦格式肉芽肿),由于活性炎性细胞糖酵解作用也显著增强,炎症病灶的炎性细胞浸润、肉芽肿形成以及巨噬细胞增生等过程均可使病灶对FDG摄取增高[6, 9-12]。本研究尝试用FDG代谢分布特点对一些高代谢的肺占位进行良恶性鉴别。
本组病例均为高代谢病灶(所有病例均SUVmax>2.5,良性组平均SUVmax(5.26±2.17),恶性组平均SUVmax(12.46±4.23))。半定量测定显示恶性组以FDG在病灶近心端浓聚为主,良性组以FDG在远心端浓聚为主,以P/D>1为标准,对肺癌诊断有较高的敏感度(91.5%)、特异性(80.6%)和准确性(88.2%)。
相似的研究见于Zhao等提出用相对放射活性分布(relative activity distribution, RAD)指数鉴别SPN良恶性,恶性病灶的RAD(0.98±0.03)低于良性病灶(1.01±0.02),以RAD<1为标准,特异性、准确性、阳性预测值、阴性预测值分别达到96.67%、93.71%、98.15%、86.57%,并且RAD为计算机软件自动计算,具有较强的客观性[13]。文中RAD指数计算由几个参数计算得出,在肺门部设定一个参考点,测量肺结节的SUVmax,病灶SUVmax90%的点到肺门的距离为d90,病灶中SUVmax80%的点到肺门的距离为d80,计算d90/d80的比值。结果中恶性病灶比值小于1代表了恶性病灶的高代谢区更靠近肺门侧,与本组病例的结果一致。Zhao等的软件自动测量法对病灶代谢的评价是基于计算机辅助的诊疗,本文采用的方法优势在于评价病灶的代谢分布无需特殊软件,可用肉眼观察,在诊断过程中简便易行,在容易出现假阳性的高代谢占位中尤其适用。本团队进行计算机辅助诊疗软件的工作也在研发中。
对于肺内良恶性病变代谢分布差异产生的病理学基础,笔者认为血供是重要的原因之一。肿瘤是血管依赖性疾病,肿瘤新生血管引起血容积、灌注量及毛细血管通透性的变化,活动性炎性结节会引起血管管腔大小及毛细血管通透性的变化,决定了肿瘤与炎性结节不同血流模式的病理基础。免疫组织化学显示, 恶性结节肿瘤间质内可见大量不成熟的肿瘤血管, 炎性病灶内则呈现较多量扩张的成熟毛细血管,结核球内仅见少量染色血管[14]。肺癌的供血以支气管动脉为主,支气管动脉多起源于降主动脉[15-16],少数有肺外体循环动脉供血(肋间后动脉,胸廓内动脉,膈动脉,锁骨下动脉等),主要多发生于肿瘤较大且明显侵犯胸膜时[15]。肺癌近心端血供更加丰富(起自降主动脉的支气管动脉供血),肿瘤细胞生长及代谢活跃,FDG摄取增高;而慢性炎症更易刺激肺外体循环动脉参与供血[16],这些血管多位于远心端,因此炎性病变的渗出在远心端更多,FDG的代谢亦出现在远心端较多。本组远心端高于近心端的6例肺癌中,有5例位于外周部,是否与体外肺循环参与供血有关,因为少数肺外体循环动脉供血,主要多发生于肿瘤较大且明显侵犯胸膜时[15]。但是病灶的代谢受多因素的影响,血管可能仅仅是一方面的因素,其他的因素需要后续的大样本、多中心、与病理结合来做深入的研究。本研究的创新之处在于提出了PET/CT一项新的指标-病灶的代谢分布特点,在鉴别高代谢占位中具有较高的准确性,可以降低PET/CT诊断的假阳性,并且可重复性好,适用于较大且出现代谢不均匀的病灶,对一些较小或目测代谢较均匀的病例需要今后进一步大样本前瞻性的研究的验证。不足之处在于样本量较小,另外对近心端与远心端的判断与ROI的勾画具有一定主观性。到目前为止,产生良恶性病灶代谢分布不同的机制确实还未有除影像学的数据支持,进一步证实需要大样本前瞻性研究、动物模型实验、与病理学(例如血管密度)对照研究等,尚需要很多研究工作来证实。
综上,肺癌代谢分布多为近端高于远端,炎性病变代谢分布多为远端高于近端。FDG代谢分布特点可以为肺部高代谢的鉴别提供参考,减少假阳性。临床工作中应综合PET/CT的各种优势,包括分析肺占位的CT征象、FDG代谢程度、FDG代谢分布特点,PET/CT对全身情况的监测,结合临床病史及实验室检查,对肺占位的诊断准确性将会有更一步提高。
| [1] | Swensen SJ, Jett JR, Hartman TE, et al. Lung cancer screening with CT: Mayo Clinic experience[J]. Radiology, 2003, 226(3): 756–61. DOI:10.1148/radiol.2263020036 |
| [2] | Bar-Shalom R, Kagna O, Israel O, et al. Noninvasive diagnosis of solitary pulmonary lesions in cancer patients based on 2-fluoro-2-deoxy-D-glucose avidity on positron emission tomography/computed tomography[J]. Cancer, 2008, 113(11): 3213–21. DOI:10.1002/cncr.v113:11 |
| [3] | Sim YT, Goh YG, Dempsey MF, et al. PET-CT evaluation of solitary pulmonary nodules: correlation with maximum standardized uptake value and pathology[J]. Lung, 2013, 191(6): 625–32. DOI:10.1007/s00408-013-9500-6 |
| [4] | 李囡, 范洋, 于江媛, 等. 18F-FGD PET/CT在原发性乳腺癌治疗后随访期间血清CEA和(或)CA153升高患者中的应用[J]. 肿瘤防治研究, 2016, 43(6): 521–5. [ Li N, Fan Y, Yu JY, et al. Application of 18F-FGD PET/CT in follow-up of primary breast cancer patients with increased serum CEA and(or) CA153[J]. Zhong Liu Fang Zhi Yan Jiu, 2016, 43(6): 521–5. ] |
| [5] | Garcia-Velloso MJ, Bastarrika G, de-Torres JP, et al. Assessment of indeterminate pulmonary nodules detected in lung cancer screening: Diagnostic accuracy of FDG PET/CT[J]. Lung Cancer, 2016, 97: 81–6. DOI:10.1016/j.lungcan.2016.04.025 |
| [6] | Schrevens L, Lorent N, Dooms C, et al. The role of PET scan in diagnosis, staging, and management of non-small cell lung cancer[J]. Oncologist, 2004, 9(6): 633–43. DOI:10.1634/theoncologist.9-6-633 |
| [7] | Chang CY, Tzao C, Lee SC, et al. Incremental value of integrated FDG-PET/CT in evaluating indeterminate solitary pulmonary nodule for malignancy[J]. Mol Imaging Biol, 2010, 12(2): 204–9. DOI:10.1007/s11307-009-0241-0 |
| [8] | Kim SK, Allen-Auerbach M, Goldin J, et al. Accuracy of PET/CT in characterization of solitary pulmonary lesions[J]. J Nucl Med, 2007, 48(2): 214–20. |
| [9] | 陈文新, 林美福, 田嘉禾, 等. 18F-FDG与18F-FLT PET/CT在肺结核瘤与恶性肿瘤鉴别诊断中的应用[J]. 中国临床医学影像杂志, 2012, 23(12): 837–40. [ Chen WX, Lin MF, Tian JH, et al. Differential diagnosis of pulmonary tuberculomas and malignant nodules using 18F-FLT and 18F-FDG PET/CT imaging[J]. Zhongguo Lin Chuang Yi Xue Ying Xiang Za Zhi, 2012, 23(12): 837–40. DOI:10.3969/j.issn.1008-1062.2012.12.001 ] |
| [10] | 葛全序, 朱仁娟, 刘庆伟, 等. 18F-FGD PET/CT结合高分辨率CT对孤立性肺结节的诊断价值[J]. 中华核医学杂志, 2005, 25(5): 264–6. [ Ge QX, Zhu RJ, Liu QW, et al. Evaluation of PET/CT combined with HRCT in differentiating malignant from benign solitary pulmonary nodules[J]. Zhonghua He Yi Xue Za Zhi, 2005, 25(5): 264–6. ] |
| [11] | 郑建国, 屈婉莹, 姚稚明, 等. 18F-FDG PET/CT在孤立性肺结节和肿块中误诊原因分析[J]. 中华核医学杂志, 2007, 27(3): 135–8. [ Zheng JG, Qu WY, Yao ZM, et al. Analysis of misdiagnosed solitary pulmonary nodules in 18F-FDG PET/CT imaging[J]. Zhonghua He Yi Xue Za Zhi, 2007, 27(3): 135–8. ] |
| [12] | Sathekge M, Maes A, Kgomo M, et al. Use of 18F-FDG PET/CT to predict response to first-line tuberculostatics in HIV associated tuberculosis[J]. J Nucl Med, 2011, 52(6): 880–5. DOI:10.2967/jnumed.110.083709 |
| [13] | Zhao L, Tong L, Lin J, et al. Characterization of solitary pulmonary nodules with 18F-FDG PET/CT relative activity distribution analysis[J]. Eur Radiol, 2015, 25(7): 1837–44. DOI:10.1007/s00330-015-3592-8 |
| [14] | 白荣杰, 程晓光, 申宝忠, 等. 64层CT灌注成像对孤立性肺结节微血管结构的评价[J]. 临床放射学杂志, 2008, 27(8): 1032–7. [ Bai RJ, Cheng XG, Shen BZ, et al. Evaluation of Microvessel Structure of Solitary Pulmonary Nodules with 64-slice Spiral CT Perfusion Imaging[J]. Lin Chuang Fang She Xue Za Zhi, 2008, 27(8): 1032–7. ] |
| [15] | 肖锋. 非小细胞肺癌血供动脉的MSCTA特征及在鉴别诊断中的价值[J]. 重庆医科大学学报, 2010, 35(7): 1083–5. [ Xiao F. MSCTA features for blood supply artery of non-small cell lung cancer and its value for differential diagnosis[J]. Chongqing Yi Ke Da Xue Xue Bao, 2010, 35(7): 1083–5. ] |
| [16] | 肖湘生, 于红, 李惠民, 等. 肺癌支气管动脉与肺动脉CT血管造影分析[J]. 中华肿瘤杂志, 2006, 28(4): 302–5. [ Xiao XS, Yu H, Li HM, et al. Impact of multi-layer spiral CT angiography of bronchial artery and pulmonary artery in assessment of the main blood supply to the primary lung cancer[J]. Zhonghua Zhong Liu Za Zhi, 2006, 28(4): 302–5. ] |
 2017, Vol. 44
2017, Vol. 44



