文章信息
- 腺样囊性癌的碳离子治疗
- Carbon Ion Radiotherapies for Adenoid Cystic Carcinoma
- 肿瘤防治研究, 2017, 44(12): 855-860
- Cancer Research on Prevention and Treatment, 2017, 44(12): 855-860
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2017.17.0265
- 收稿日期: 2017-03-13
- 修回日期: 2017-09-12
2. 530021 南宁,广西医科大学第一附属医院放疗科
2. Department of Radiotherapy, The First Affiliated Hospital of Guangxi Medical University, Nanning 530021, China
腺样囊性癌(adenoid cystic carcinoma, ACC)又名圆柱瘤,由Billmth于1859年首次提出,是临床上较少见的恶性肿瘤类型。有报道称腺样囊性癌年发病率在3~4.4例每百万人[1],该病以头颈部发病率最高,约占头颈部恶性肿瘤的1%[2],好发于小涎腺、舌下腺、腮腺、颌下腺等,占涎腺肿瘤的5%~10%,在涎腺恶性肿瘤中占24%[3-4];也可能发生在鼻咽部、口底、支气管、咽旁间隙等,发病率较低[4]。男女发病率无较大差异,较多见的年龄是40~60岁[5]。腺样囊性癌是一种进展较为缓慢的恶性肿瘤,容易出现神经侵犯和远处转移[6-7]。这一特性在临床上表现为肿瘤高复发、易远处转移,往往治疗后远期疗效不佳。由于发病位置隐蔽,患者就诊时常已是疾病晚期,故容易漏诊、误诊,治愈率较低。因对常规光子线放疗和化疗敏感度较差,故其治疗以手术为主。可完全切除的早期腺样囊性癌,5年局部控制率(LC)约80%,晚期尤其无法手术切除者,即使术后采用辅助放疗,局部控制率也仅约50%[7-8]。
对于ACC患者放射治疗方式来说,光子治疗仍是目前放疗的主流技术,但局部复发是ACC治疗后失败的主要方式,局部复发的主要原因通常包括肿瘤靶区照射范围不足、肿瘤内存在放射不敏感的细胞群或肿瘤处于导致放射不敏感的环境(如乏氧)。再程放射治疗是局部复发ACC患者的最为有效的根治手段,近年来用于再程放射治疗的技术有:近距离后装放射治疗、立体定向放疗(如伽马刀)、调强放疗等,以上均属于光子放射治疗。如鼻咽癌患者,局部复发的鼻咽癌患者一般都在初诊时已完成高剂量的根治性光子治疗,再程放射提高了复发性鼻咽癌的疗效,但对于再程光子不敏感的肿瘤患者,疗效仍难令人满意,2年生存率不及50%[9-11],5年局部控制率(LC)低于40%[12]。
常规放疗技术治疗ACC效果不理想,随着医疗设备的进步,一些新的放疗技术运用到临床中,比如质子和重离子的运用。由于质子束和重离子束具有更好的物理剂量学优势,尤其是碳离子这种高传能线密度(LET)射线,对常规光子不敏感的肿瘤具有更高的相对生物学效应(RBE)[13],日本国立放射学研究所(NIRS)及德国海德堡大学质子重离子中心(HIT)均将碳离子作为治疗粒子。碳离子的物理特性包括:具有Bragg峰,其Bragg峰宽较狭,后沿下降较快,剂量分布较好;每单位行程的游离能量大、散射小,约80~430 MeV,杀伤力更强[13]。碳离子生物学特点有:高传能密度,相对生物效应(RBE)值在2~5;具有直接杀死肿瘤细胞的切断DNA双链功能,损伤很难或无法修复;杀灭肿瘤无细胞周期依赖性;有一个较小的氧增比(OER),杀灭肿瘤不受氧浓度影响[13-14]。碳离子放疗已在临床上应用于治疗颅底、头颈部、骨盆等骨骼和软组织肿瘤,其疗效确切,在其他肿瘤同样取得可喜的结果,例如局部复发性直肠癌和胰腺癌[15]。
1 单独运用碳离子放疗治疗ACC目前全球的质子中心主要分布在欧美和日本,但仅日本、德国、意大利和中国拥有碳离子治疗设备[14]。根据国际粒子治疗联合协作组统计(截至2016年2月25日),全球有近60家质子治疗中心、5家碳离子治疗中心和5家同时拥有质子和重离子治疗中心[16]。碳离子是目前最常用的重离子,其应用广泛开展于日本。
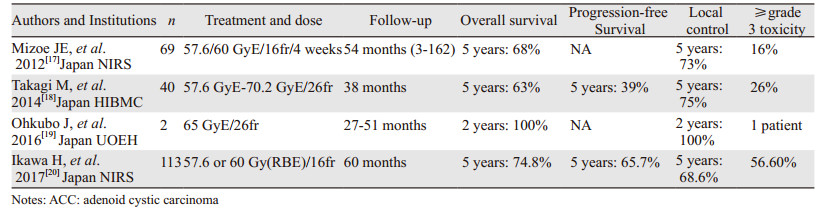
日本Mizoe等研究者[17]从1997年4月至2006年2月对236名进行碳离子放疗患者中,根据其组织病理类型,筛选出64名ACC患者,采用放疗剂量57.6或60 GyE/16次/4周。这些患者5年总生存率为68%,5年局部控制率达到了73%,但是有16%患者出现3度不良反应,如口腔黏膜反应、皮肤反应,无4度不良反应。日本的兵库县县立粒子线治疗中心(HIBMC)Takagi等[18]2014年回顾性分析了2002年至2012年期间碳离子治疗的40例ACC患者,放疗剂量为57.6 GyE/26次~70.2 GyE/26次,大部分患者接受65 GyE/26次照射。中位随访期为38月,5年的总生存率、无进展生存率和局部控制率分别为63%、39%、75%,仅26%的患者出现了重度(3级及以上)的晚期不良反应。2016年日本职业与环境卫生大学附属医院(UOEH)Ohkubo等[19]回顾性分析了其收治的8例粒子治疗的头颈部肿瘤患者的临床结局,其中2例为碳离子放射治疗的ACC患者,治疗剂量为65 GyE/26次,分别随访27和51月,其两年内都达到局部控制的标准,但有1名患者治疗期间出现脑部3度不良反应。同样来自于日本NIRS的Ikawa等[20]总结了2006年12月至2013年7月收治的共113名经碳离子治疗的ACC患者临床资料,研究发现113名患者经碳离子治疗后5年总生存(OS)、无疾病进展生存(PFS)及局部控制率(LC)分别为:74.8%、65.7%、68.6%,其疗效确切,但超过3度不良反应的患者比例为56.6%。基于上述研究,所以德国HIT认为碳离子(C12)是治疗腺样囊性癌的标准治疗方案,可用于原发或复发ACC的治疗,剂量方面推荐50.8~70.4 GyE/16次/4周,超过3度以上不良反应较少见。几项研究对比情况见表 1。
单独应用碳离子放疗治疗ACC效果比较理想,3~5年的局部控制率可达75%~90%,3度及以上不良反应较少见,但目前这类研究较少,病例不多,在临床应用中需要根据不同的病情及所在单位的具体情况实施,以免造成严重不良反应。
2 碳离子放疗联合调强放射治疗治疗ACC光子线放疗已经广泛应用于临床,目前大部分的肿瘤放疗单位均可开展调强放射治疗(IMRT),因其良好的剂量分布对肿瘤的治疗有良好的效果,针对部分光子线抵抗的恶性肿瘤,如ACC,一些肿瘤中心开始研究碳离子放疗联合IMRT治疗恶性肿瘤。
德国重离子研究中心(GSI)的Schulz-Ertner等[21]2003年报道从1998年9月至2002年2月收治的16名ACC患者接受IMRT及碳离子综合放疗,剂量18 GyE/6次+54 Gy,1年、3年局部控制率分别为80.8%、64.6%,总生存100%及83.3%,未发现4到5级不良反应。德国HIT的Jensen教授课题组[22]2015年回顾性分析了治疗中心1997年至2008年收治的95名头颈部ACC患者碳离子(18 GyE/6次)+IMRT或FSRT(分次立体定向放疗)(54 Gy)与单纯IMRT或FSRT(66 Gy)放疗效果,其中碳离子组共58名患者,IMRT或FSRT组37名患者,结果5年的局部控制率、无进展生存率、总生存率碳离子组为59.6%、48.4%、76.5%,光子线照射组分别为39.9%、27%、58.7%,碳离子组有较高的控制率及总生存,但差异无统计学意义,急性不良反应在光子线治疗组稍高。研究者还分析了治疗中心在2010年7月至2011年8月对54例术后残留的恶性涎腺肿瘤的患者给予IMRT(50 Gy)联合碳离子(24 GyE/8次)放疗[23],其中89%的患者为腺样囊性癌,在治疗结束6至8周第1次随访时的客观缓解率为54%(PR+CR),3年局部控制率、无进展生存率和总生存率分别为81.9%、57.9%和78.4%,这一结果优于单纯光子线治疗。放射治疗期间,26%的患者出现3度黏膜反应,未出现4度反应,皮肤及口腔黏膜反应不大。课题组进一步分析了从1998年8月至2013年5月收治的以碳离子及IMRT放疗的309名ACC患者[24],治疗方案为使用IMRT治疗50.4~56.0 Gy后,继予碳离子放射24 GyE/8次,中位总剂量为71 GyE。中位随访期为33.9月,3年局部控制率、无进展生存率和总生存率分别为83.7%、67.8%、88.9%,5年分别为58.5%、56.1%、74.6%,治疗过程中,碳离子联合光子治疗的不良反应小于该中心单独使用光子线治疗者,见表 2。

|
以上研究均为德国肿瘤治疗中心所开展,均取得了较好的治疗效果,3~5年的总生存率可达80%,也证明了碳离子可以与IMRT联合放疗,并且联合后治疗效果好于单纯IMRT或FSRT。由于目前世界上可开展此类治疗的单位较少,查到的文献均为德国HIT或GSI的资料,需要不同国家和地区的治疗机构根据不同的实际情况开展,尚需进一步的临床试验验证。剂量方面,根据上述临床研究结果,建议碳离子18~24 GyE/6-8次+IMRT50 Gy左右。
3 碳离子放疗与质子放疗的比较质子也具有更好的物理剂量学优势,质子的RBE基本上与X射线和电子线的RBE相同,RBE=1.1~1.2,只具有间接杀死肿瘤细胞的切断DNA单链功能,难于对抗阻型、缺氧型肿瘤进行有效治疗,因此单从物理和生物特性来看,碳离子优于质子。但碳离子重量较大,使被治疗的肿瘤及其边缘区,即使从宏观上来看剂量是均匀的,但从微观看,存在某些癌细胞没有照射到的冷点,这种冷点处的癌细胞在以后有复发的可能,此效应称为后效应[14],从而使二者比较复杂化。
印第安纳大学医学院Linton等[25]报道26名在2004年至2012年收治的ACC患者给予质子放疗,其中20名患者有颅底骨质破坏,原发患者19名,放疗剂量72 Gy(RBE),中位随访时间为25月(7~50月),结果显示首程放疗患者2年总生存率及局部控制率分别为93%、95%,不良反应方面,4级、5级反应各1名患者。研究者认为该研究建议继续随访观察。德国GSI的Morimoto等[26]2014年报道了47名恶性肿瘤患者予质子放疗,10名患者予碳离子放疗,剂量57.6 GyE/16次~70.2 GyE/26次,25名ACC患者3年总生存率80%,局部控制率63%。日本HIBMC[18]回顾性分析了2002年2月至2012年3月期间治疗的80例腺样囊性癌患者,质子和碳离子治疗均为40例,大部分患者(47例,59%)的放射剂量为65 GyE/26次,其余的患者接受了70.2 GyE/26次或57.6 GyE/6次的照射。中位随访期为38月(6~115月),所有经离子治疗患者5年的总生存率、无进展生存率和局部控制率分别为63%、39%、75%,其中质子治疗组总生存率、无进展生存率和局部控制率分别为63.3%、30.4%、75.8%,碳离子治疗组总生存率、无进展生存率和局部控制率分别为93.8%、69.5%、77.7%,两组之间差异无统计学意义(OS: P=0.097、PFS: P=0.074、LC: P= 0.730),采用质子和碳离子治疗的疗效相当。值得注意的是,质子和重离子对局部晚期腺样囊性癌也有很好的局部控制率,T4期和不能手术患者的5年局部控制率分别达到66%和68%。仅26%的患者出现了重度(3级及以上)晚期不良反应。
碳离子与质子放疗效果相当,对于无法手术的ACC患者可以取得较高的局部控制率及较轻的不良反应,目前质子放疗的研究结果少于碳离子放疗,两者孰优孰劣尚有争议。
4 特殊病例的碳离子放疗德国HIT的Jensen等[27]2011年报道了对R1切除或神经侵犯Pn+的ACC复发患者进行碳离子放疗,16名ACC复发患者放疗剂量为44.9GyE,再程放疗间隔中位时间为66月,随访时间为6月,在治疗及随访期间未出现3度及以上不良反应,9人部分缓解(PR),4人稳定(SD)。同样来自HIT的Combs等[28]2012报道,该中心2009年1月至2011年11月收治青少年患者,平均年龄12岁(2~21岁),包括骨肉瘤、眼眶横纹肌肉瘤、脊索瘤等,其中3例ACC患者,放疗剂量为IMRT50 Gy+碳离子18或24 GyE,随访9月,随访期间发现1例轻微不良反应,患者肿瘤控制良好,未见肿瘤复发或转移。美国宾夕法尼亚大学附属医院肿瘤中心的Bonner Millar等[29]2013年报道了1例气管ACC,第一阶段予IMRT46 Gy放疗后重新行CT扫描予碳离子34 GyE放疗,随访11月未复发,未出现3级及以上不良反应。德国HIT的Jensen等[30]2015年报道了2010年4月至2013年5月该中心收治的52例ACC复发患者行放疗,其中48例单纯碳离子、4例碳离子放疗联合IMRT,中位剂量分别为51 GyE和63 Gy,累积放疗剂量达到128 Gy(67~182 Gy),两程放疗中位间隔时间61月,随访时间14月(1~39月),结果缓解率(CR+PR)56.6%,1年的局部控制率(LC)70.3%,未出现3度以上不良反应。日本NIRS的Koto等[31]2016年回顾性分析了该中心2002年5月至2014年8月收治的18例口底腺样囊性癌患者,给予碳离子放疗,其中17例为T4a、1例为T2,放疗剂量大部分为64 Gy/16次/4周,部分患者口咽黏膜全部包在射野范围内,剂量57.6Gy/16次/4周,中位随访时间57月(10~132月),5年局部控制率为92%,总生存率为72%,无疾病进展生存率(DFS)44%,不良反应方面,2名患者出现3度反应骨坏死,1名患者出现口底出血,其余未见3度及以上不良反应,见表 3。
无论是复发的ACC患者,还是特殊部位如气管、口底等,以及年幼的ACC患者,碳离子放疗均取得了较高的局部控制率,不良反应不明显,从上表可看出每种类型的病例数均较少,也说明这类患者接受碳离子放疗机会较少,在做好质控的前提下对此类患者临床上可以开展碳离子放疗。
5 正在进行的研究在恶性肿瘤治疗过程中,常常将放疗与化疗或靶向药物联合来增强疗效,碳离子放疗是否能联合靶向治疗,同样是德国HIT的Jensen等[32]2011年启动了一项前瞻性、多中心、Ⅰ/Ⅱ期临床试验,计划入组49名ACC患者,治疗方案为(18 GyE/6次)+(18或24 Gy)。
IMRT+西妥昔单抗(负荷剂量400 mg/m2,后每周250 mg/m2),评价此治疗方案的有效性、安全性。目前还在入组中,该项研究为全球首次对碳离子联合西妥昔单抗治疗ACC进行研究,期待研究结果。
6 总结碳离子放疗(CIRT)是放疗的新型技术,在发达国家如德国、日本、美国等国家开展较为广泛,尤其是德国HIT和日本NIRS。这些肿瘤中心针对碳离子放疗的剂量、正常器官的保护、与不同放疗方式的结合等方面做了大量研究,研究结果表明碳离子放疗对治疗肿瘤有一定疗效,特别是对于一些特殊类型、特殊部位的恶性肿瘤,如软组织肿瘤(包括脊索瘤、软骨肉瘤)、眼脉络膜恶性黑色素瘤、头颈部腺样囊性癌、头颈部鳞癌等以及位于颅底和鼻窦的恶性肿瘤或放疗后局部复发的头颈部肿瘤,均体现出优于光子线放疗的物理学和生物学优势[14],本文主要讨论的是腺样囊性癌。从以上研究不难发现,碳离子治疗ACC在取得一定疗效的同时不良反应发生的比例差别巨大,一方面各研究中心放疗剂量、次数、时间无统一标准,均为本中心常用治疗方案,如何制衡疗效与不良反应发生两者的关系成为困扰治疗中心的难题;另一方面,与光子放射疗法不同,全球只有5家医院收集了CIRT的长期临床资料,处方剂量和器官风险(organs at risk, OAR)缺乏综合经验,样本量成为统一标准及衡量疗效的又一难题[33]。值得庆幸的是,目前碳离子在ACC患者中的应用越来越多,可以用在原发、复发的患者,可以用在年幼的患者中,可与光子线放疗相结合,还有研究考虑与靶向药物相结合,下一步可以研究与化疗相结合,观察其有效性和安全性。随着治疗设备及技术的发展,将潜在地改善CIRT的剂量分布,特别是对于中低剂量部位,离子治疗带来的不良反应也会相应减少。目前对碳离子治疗ACC的研究并不多,基本是Ⅰ/Ⅱ期临床试验,尚待Ⅲ/Ⅳ期临床试验进一步证实其疗效,为进一步开展本项治疗提供临床证据。
| [1] | Bjørndal K, Krogdahl A, Therkildsen MH, et al. Salivary gland carcinoma in denmark 1990-2005: A national study of incidence, site and histology.Results of the danish head and neck cancer group (dahanca)[J]. Oral Oncol, 2011, 47(7): 677–82. DOI:10.1016/j.oraloncology.2011.04.020 |
| [2] | Dodd RL, Slevin NJ. Salivary gland adenoid cystic carcinoma: A review of chemotherapy and molecular therapies[J]. Oral Oncol, 2006, 42(8): 759–69. DOI:10.1016/j.oraloncology.2006.01.001 |
| [3] | 张芳, 徐菁. 腺样囊性癌的病理研究新进展[J]. 山西医药杂志月刊, 2007, 22(4): 302–3. [ Zhang F, Xu J. Advances in pathological research of adenoid cystic carcinoma[J]. Shanxi Yi Yao Za Zhi Yue Kan, 2007, 22(4): 302–3. ] |
| [4] | Papaspyrou G, Hoch S, Rinaldo A, et al. Chemotherapy and targeted therapy in adenoid cystic carcinoma of the head and neck: A review[J]. Head Neck, 2011, 33(6): 905–11. DOI:10.1002/hed.v33.6 |
| [5] | Dillon PM, Chakraborty S, Moskaluk CA, et al. Adenoid cystic carcinoma: A review of recent advances, molecular targets, and clinical trials[J]. Head Neck, 2016, 38(4): 620–7. DOI:10.1002/hed.v38.4 |
| [6] | Coca-Pelaz A, Rodrigo JP, Bradley PJ, et al. Adenoid cystic carcinoma of the head and neck[J]. Oral Oncol, 2015, 51(7): 652–61. DOI:10.1016/j.oraloncology.2015.04.005 |
| [7] | Umeda M, Nishimatsu N, Yokoo S, et al. The role of radiotherapy for patients with adenoid cystic carcinoma of the salivary gland[J]. Oral Surg Oral Med Oral Pathol Oral Radiol Endod, 2000, 89(6): 724–9. DOI:10.1067/moe.2000.106302 |
| [8] | Mendenhall WM, Morris CG, Amdur RJ, et al. Radiotherapy alone or combined with surgery for adenoid cystic carcinoma of the head and neck[J]. Head Neck, 2004, 26(2): 154–62. DOI:10.1002/(ISSN)1097-0347 |
| [9] | Qiu S, Lin S, Tham IW, et al. Intensity-modulated radiation therapy in the salvage of locally recurrent nasopharyngeal carcinoma[J]. Int J Radiat Oncol Biol Phys, 2012, 83(2): 676–83. DOI:10.1016/j.ijrobp.2011.07.006 |
| [10] | Han F, Zhao C, Huang SM, et al. Long-term outcomes and prognostic factors of re-irradiation for locally recurrent nasopharyngeal carcinoma using intensity-modulated radiotherapy[J]. Clin Oncol(R Coll Radiol), 2012, 24(8): 569–76. DOI:10.1016/j.clon.2011.11.010 |
| [11] | 蓝玉宏, 田允铭, 白力, 等. 初治转移鼻咽癌疗后预后评分模型建立及分层治疗研究[J]. 中华放射肿瘤学杂志, 2015, 24(4): 421–6. [ Lan YH, Tian YM, Bai L, et al. Post treatment prognostic score model establishment and stratified therapy for newly diagnosed metastatic nasopharyngeal carcinoma[J]. Zhonghua Fang She Zhong Liu Xue Za Zhi, 2015, 24(4): 421–6. ] |
| [12] | Catton C, O'Sullivan B, Bell R, et al. Chordoma: Long-term follow-up after radical photon irradiation[J]. Radiother Oncol, 1996, 41(1): 67–72. DOI:10.1016/S0167-8140(96)91805-8 |
| [13] | Jäkel O. Medical physics aspects of particle therapy[J]. Radiat Prot Dosimetry, 2009, 137(1-2): 156. DOI:10.1093/rpd/ncp192 |
| [14] | 陈明, 王谨. 重离子治疗癌症的原理和现状[J]. 中华放射肿瘤学杂志, 2011, 20(5): 447–50. [ Chen M, Wang J. Principle and status of heavy ion therapy for cancer[J]. Zhonghua Fang She Zhong Liu Xue Za Zhi, 2011, 20(5): 447–50. ] |
| [15] | Kamada T, Tsujii H, Blakely EA, et al. Carbon ion radiotherapy in japan: An assessment of 20 years of clinical experience[J]. Lancet Oncol, 2015, 16(2): e93–e100. DOI:10.1016/S1470-2045(14)70412-7 |
| [16] | 孔琳, 陆嘉德. 头颈部恶性肿瘤的质子、重离子治疗实践[J]. 中华放射肿瘤学杂志, 2016, 25(5): 427–31. [ Kong L, Lu JD. Practice of proton and heavy ion radiotherapies for head and neck malignancies[J]. Zhonghua Fang She Zhong Liu Xue Za Zhi, 2016, 25(5): 427–31. ] |
| [17] | Mizoe JE, Hasegawa A, Jingu K, et al. Results of carbon ion radiotherapy for head and neck cancer[J]. Radiother Oncol, 2012, 103(1): 32–7. DOI:10.1016/j.radonc.2011.12.013 |
| [18] | Takagi M, Demizu Y, Hashimoto N, et al. Treatment outcomes of particle radiotherapy using protons or carbon ions as a single-modality therapy for adenoid cystic carcinoma of the head and neck[J]. Radiother Oncol, 2014, 113(3): 364–70. DOI:10.1016/j.radonc.2014.11.031 |
| [19] | Ohkubo JI, Hohchi N, Takeuchi S, et al. Treatment outcome of ion beam therapy in eight patients with head and neck cancers[J]. Eur Arch Otorhinolaryngol, 2016, 273(12): 4397–402. DOI:10.1007/s00405-016-4086-2 |
| [20] | Ikawa H, Koto M, Takagi R, et al. Prognostic factors of adenoid cystic carcinoma of the head and neck in carbon-ion radiotherapy: The impact of histological subtypes[J]. Radiother Oncol, 2017, 123(3): 387–93. DOI:10.1016/j.radonc.2017.04.026 |
| [21] | Schulz-Ertner D, Nikoghosyan A, Jäkel O, et al. Feasibility and toxicity of combined photon and carbon ion radiotherapy for locally advanced adenoid cystic carcinomas[J]. Int J Radiat Oncol Biol Phys, 2003, 56(2): 391–8. DOI:10.1016/S0360-3016(02)04511-X |
| [22] | Jensen AD, Nikoghosyan AV, Poulakis M, et al. Combined intensity-modulated radiotherapy plus raster-scanned carbon ion boost for advanced adenoid cystic carcinoma of the head and neck results in superior locoregional control and overall survival[J]. Cancer, 2015, 121(17): 3001–9. DOI:10.1002/cncr.v121.17 |
| [23] | Jensen AD, Nikoghosyan AV, Lossner K, et al. Cosmic: A regimen of intensity modulated radiation therapy plus dose-escalated, raster-scanned carbon ion boost for malignant salivary gland tumors: Results of the prospective phase 2 trial[J]. Int J Radiat Oncol Biol Phys, 2015, 93(1): 37–46. DOI:10.1016/j.ijrobp.2015.05.013 |
| [24] | Jensen AD, Poulakis M, Nikoghosyan AV, et al. High-let radiotherapy for adenoid cystic carcinoma of the head and neck: 15 years' experience with raster-scanned carbon ion therapy[J]. Radiother Oncol, 2015, 118(2): 272–80. |
| [25] | Linton OR, Moore MG, Brigance JS, et al. Proton therapy for head and neck adenoid cystic carcinoma: Initial clinical outcomes[J]. Head Neck, 2015, 37(1): 117–24. DOI:10.1002/hed.23573 |
| [26] | Morimoto K, Demizu Y, Hashimoto N, et al. Particle radiotherapy using protons or carbon ions for unresectable locally advanced head and neck cancers with skull base invasion[J]. Jpn J Clin Oncol, 2014, 44(5): 428–34. DOI:10.1093/jjco/hyu010 |
| [27] | Jensen AD, Nikoghosyan AV, Ecker S, et al. Raster-scanned carbon ion therapy for malignant salivary gland tumors: Acute toxicity and initial treatment response[J]. Radiat Oncol, 2011, 6: 149. DOI:10.1186/1748-717X-6-149 |
| [28] | Combs SE, Kessel KA, Herfarth K, et al. Treatment of pediatric patients and young adults with particle therapy at the heidelberg ion therapy center (hit): Establishment of workflow and initial clinical data[J]. Radiat Oncol, 2012, 7: 170. DOI:10.1186/1748-717X-7-170 |
| [29] | Bonner Millar LP, Stripp D, Cooper JD, et al. Definitive radiotherapy for unresected adenoid cystic carcinoma of the trachea[J]. Chest, 2012, 141(5): 1323–6. DOI:10.1378/chest.11-0925 |
| [30] | Jensen AD, Poulakis M, Nikoghosyan AV, et al. Re-irradiation of adenoid cystic carcinoma: Analysis and evaluation of outcome in 52 consecutive patients treated with raster-scanned carbon ion therapy[J]. Radiother Oncol, 2015, 114(2): 182–8. DOI:10.1016/j.radonc.2015.01.002 |
| [31] | Koto M, Hasegawa A, Takagi R, et al. Evaluation of the safety and efficacy of carbon ion radiotherapy for locally advanced adenoid cystic carcinoma of the tongue base[J]. Head Neck, 2016, 38(Suppl 1): E2122–6. |
| [32] | Jensen AD, Nikoghosyan A, Hinke A, et al. Combined treatment of adenoid cystic carcinoma with cetuximab and imrt plus c12 heavy ion boost: Accept [acc, erbitux(r) and particle therapy][J]. BMC Cancer, 2011, 11: 70. DOI:10.1186/1471-2407-11-70 |
| [33] | Molinelli S, Magro G, Mairani A, et al. Dose prescription in carbon ion radiotherapy: How to compare two different rbe-weighted dose calculation systems[J]. Radiother Oncol, 2016, 120(2): 307–12. DOI:10.1016/j.radonc.2016.05.031 |
 2017, Vol. 44
2017, Vol. 44