文章信息
- 基于液相色谱-质谱联用技术的男性肺腺癌患者代谢组学研究
- Metabonomics Investigation of Lung Adenocarcinoma in Male Patients Based on Liquid Chromatography-mass Spectrometry
- 肿瘤防治研究, 2017, 44(9): 607-611
- Cancer Research on Prevention and Treatment, 2017, 44(9): 607-611
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2017.17.0237
- 收稿日期: 2017-03-09
- 修回日期: 2017-06-30
2. 130021 长春,吉林省中医院老年病2内科
2. Second Department of Geriatrics, Chinese Medicine Hospital of Jilin Province, Changchun 130021, China
近年来工业化脚步的逐渐加快以及雾霾的不断加剧,肺癌发病情况日益严峻。肺癌患者中,男性比例占据多数,据Chen等[1]的最新统计结果表明,2015年男性肺癌死亡病例43.2万例,新增病例50.9万例,并预计2030年这一比例将翻倍增长。肺癌患者中,非小细胞肺癌占85%,其中腺癌居首[2-3]。肺癌患者早期并无明显临床表现,因此,其早期诊断显得尤为重要。
早期肺癌的诊断方法包括支气管镜、痰液细胞学以及影像学检查等手段,然而这些检查方法存在价格昂贵、误差率高等问题使患者难以接受。近年来,随着系统生物学各项技术的不断发展,肿瘤标志物的识别已成为肿瘤早期诊断的研究热点。代谢组学技术是研究生物体某一时期所有代谢物的整体变化规律,可直接反映生物体系的最终变化状态,特别适用于分析肿瘤发生和增殖过程中肿瘤细胞合成、释放所导致体内代谢物质的变化[4]。本研究采用基于快速高分辨液相色谱-四极杆-飞行时间质谱技术(RRLC-Q-TOF-MS)的代谢组学方法检测肺腺癌患者和健康者血浆小分子代谢产物,以期为肺腺癌的早期诊断提供新的依据。
1 资料与方法 1.1 样本收集选取吉林省肿瘤医院自2015年3月至2016年3月收治的17例成年男性肺腺癌患者(均为汉族)空腹血浆作为病例组,患者均由病理学检查确诊,且样品采集之前并未服用任何药物,未曾接受任何其他治疗。根据2015年WHO肺癌分类系统组织学分型,其中腺泡样为主型12例、实体性为主型5例;按照2009年国际抗癌联盟第七版TNM分期,T1期8例、T2期9例;年龄37~48岁,平均年龄43.4岁,均无转移;以吉林省中医院体检中心选取体检合格的20例健康成年男性(均为汉族)空腹血浆作为健康对照组,年龄37~47岁,平均年龄44.2岁。上述样本收集后存入-80℃冰箱冻存。
1.2 试剂与仪器Agilent1200系列高效液相色谱仪(美国安捷伦公司),Agilent 6520四级杆-飞行时间质谱仪(美国安捷伦公司),色谱甲醇、甲酸和乙腈(德国Merck公司),超纯水(Milli-Q系统制得,美国Millipore公司),标准品均购自Sigma-Aldrich公司。
1.3 样品前处理样品检测时室温解冻,取200 µl血浆,加入800 µl甲醇,用以沉淀血浆蛋白,涡旋混匀,12 000 r/min离心10 min,取上清液,进样量为5 µl。
1.4 LC-MS分析液相色谱:Waters ODS色谱柱(250 mm×4.6 mm, 5 μm),柱温30℃;流动相A为0.1%甲酸水,流动相B为乙腈;采用梯度洗脱,正离子模式:0~12 min, 5%~40% B;> 12~16 min, > 40%~80% B;> 16~20 min, > 80%~100% B;负离子模式:0~8 min, 5%~30% B;> 8~15 min, > 30%~70% B;> 15~20 min, > 70%~100% B;流速:0.3 ml/min,进样量5 µl。
质谱:Agilent 6520四级杆-飞行时间质谱仪(美国安捷伦公司),分别采用电喷雾正离子和负离子电离模式;气体温度:300 ℃;干燥气(氮气)流速:8.0 L/min;雾化气压力:30 psig;裂解电压:180 V;锥孔电压:65 V;质量扫描范围:m/z 100-900。样品测定前运用调谐液对质量轴进行校正。
1.5 数据处理样品运用LC/MS进行测定,得到样品的色谱图,采用Masshunter软件在Molecular feature extract(MFE)模式下进行背景扣除、峰校准、归一化和数据简化处理,运用Data Acquisition软件对采集到的色谱图进行预处理,得到化合物质荷比、保留时间和峰面积的化合物转换文件(compound exchange file, CEF),导入Mass Profiler Professional(MPP)软件进行滤噪和归一化。单变量数据统计采用t检验,倍量变化分析(fold-change analysis, FC),P < 0.05和倍量(FC)≥2为差异有统计学意义。多变量数据分析采用主成分分析法(PCA)对组间样本进行代谢轮廓分析,并对分组贡献较大的化合物进行降维筛选,通过载荷图得到潜在的生物标志物,采用t检验比较组间生物标志物的差异,结果用均数±标准差表示(x±s),运用偏最小二乘法(PLS-DA)建立预测模型,考察此模型在肺腺癌模型诊断上的预测能力,通过R2Y、Q2参数值评价模型质量,其中R2Y越接近1说明模型越稳定,Q2 > 0.5表示预测率较高。最后根据生物标志物在液相色谱和质谱条件下的特征与标准品和数据库(HMDB: http://www.hmdb.ca/; MassBank http://www.massbank.jp/; KEGG: http://www.genome.jp/)进行比对而最终确认。
1.6 方法学验证从所有待测样品中各取出50 µl,制成混合QC样本用于方法学验证,检测过程中,每5个测定样本中插入一个QC样本,之后将所有QC样本结果进行比较,在正离子和负离子模式下分别选取5个离子进行统计以评价测定期间系统的稳定性和重现性。所选的离子如下:正离子m/z 120.0776, 162.1075, 203.0464, 274.2675, 302.2970;负离子m/z 167.0211, 201.0385, 248.9593, 316.9462, 333.0597。
2 结果 2.1 系统稳定性评价经过统计分析,10个离子的保留时间、质荷比和峰面积的相对标准偏差(RSD%)分别为(0.19~0.31)%,(0.0002~0.0007)%,(6.5~9.2)%。这一结果表明了在整个分析过程期间,仪器系统的稳定性与重现性良好。
2.2 血浆代谢谱分析采用LC-MS方法对血浆样本进行分离和数据采集,对照组某一健康男性和肺腺癌组某一患者血浆样本在正离子和负离子模式下的基峰强度色谱图(base peak intensity, BPI),见图 1。
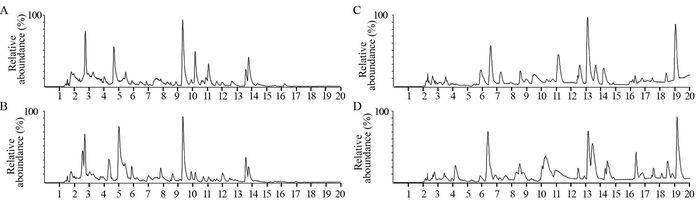
|
| A: control group in negative ion mode; B: lung adenocarcinoma group in negative ion mode; C: control group in positive ion mode; D: lung adenocarcinoma group in positive ion mode 图 1 健康对照组与肺腺癌组血浆样本的基峰强度色谱图 Figure 1 Base peak intensity (BPI) chromatograms obtained from negative and positive ion RRLC-Q-TOF-MS analyses of healthy control group and lung adenocarcinoma group |
通过Agilent Mass Hunter Workstation的MPP软件处理,在正离子模式下获得了11 805个化合物,经t检验后差异具有统计学意义(P < 0.05)的化合物共有75个;在负离子模式下获得了9 761个化合物,经t检验后差异具有统计学意义(P < 0.05)的化合物共有63个。
2.3.2 多变量统计结果PCA通过多维空间对样品进行差异筛选,正离子和负离子模式下对照组和肺腺癌组的PCA得分图,见图 2,图中每一个图标代表一个样本在二维平面的投影,每个样本的位置由自身所含有的化合物所决定,所含化合物种类及含量相似的样本距离较近。从图中可以看出,正离子和负离子模式下,对照组样本与肺腺癌组样本均有较好的分离,表明与健康者相比,肺腺癌患者的血浆代谢物谱发生了明显的变化。
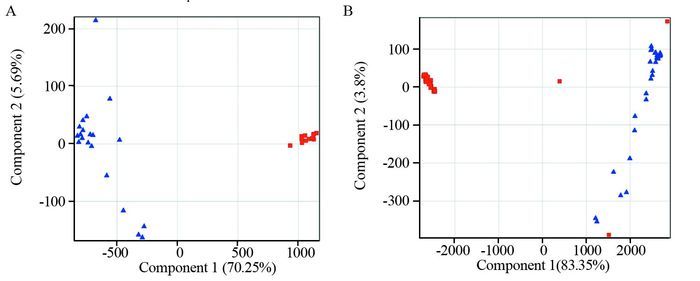
|
A: positive ion mode; B: negative ion mode;  : control group; : control group;  : lung adenocarcinoma group
图 2 区分健康对照组与肺腺癌组的3D-PCA得分图
Figure 2 3D-PCA score plots of healthy control and lung adenocarcinoma groups : lung adenocarcinoma group
图 2 区分健康对照组与肺腺癌组的3D-PCA得分图
Figure 2 3D-PCA score plots of healthy control and lung adenocarcinoma groups
|
运用PCA将对照组和肺腺癌组的血浆代谢产物进行区分,正离子和负离子模式下的载荷图,见图 3,图中每一个图标代表一个化合物,距离中心点越远的化合物对分组的贡献越大,作为潜在的差异代谢产物,通过生物标志物在LC-MS/MS下的精确分子量和串联质谱中裂解谱图特征与相应的标准品或权威数据库进行比较,根据比较结果对可能的潜在生物标志物进行鉴定。运用PLS-DA方法对所有样本数据进行分析,将PCA分析结果中t检验后差异具有统计学意义(P < 0.05)的化合物作为分析对象,拟合参数为R2Y=0.853,Q2=0.914,结果表明肺腺癌模型的稳定性和预测率较高。最终在正离子模式下,共鉴定了11个差异代谢产物;负离子模式下,共鉴定了5个差异代谢产物。其中亚油酸(linoleic acid)、油酸(oleic acid)、棕榈油酸(palmitoleic acid)、次黄嘌呤(hypoxanthine)、乳酸(lactic acid)、丙酮酸(pyruvic acid)通过与相应标准品比对进行鉴定;LysoPC(16:0)、LysoPC(18:1)、LysoPC(18:2)、LysoPC(22:4)、Linoleylcarnitine(carnitine 18:2)、脯氨酸甜菜碱(proline betaine)通过与数据库HMDB比对进行鉴定;Decanoylcarnitine(carnitine 10:0)、Octanoylcarnitine(carnitine 8:0)、Palmitoylcarnitine(carnitine 16:0)、胆碱(choline)通过与数据库MassBank比对进行鉴定。差异代谢产物的相关信息,见表 1。
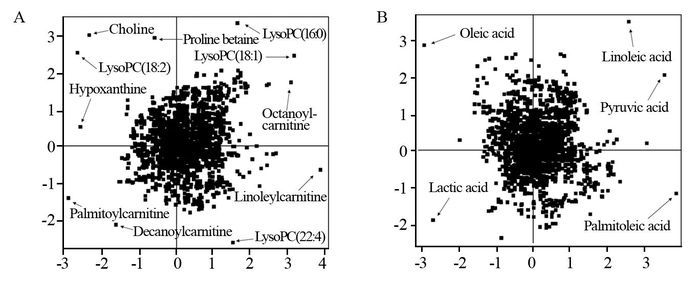
|
| A: positive ion mode; B: negative ion mode 图 3 区分健康对照组与肺腺癌组的PCA载荷图 Figure 3 PCA loading diagram of healthy control and lung adenocar-cinoma groups in positive and negative ion mode |
 |
LysoPC(16:0)、LysoPC(18:1)、LysoPC(18:2)、LysoPC(22:4)均为溶血磷脂酰胆碱(LPC),可在溶血磷脂酰胆碱酰基转移酶(LPCAT)的催化作用下生成磷脂酰胆碱(PC),LPCAT主要存在于肺上皮细胞,而肺腺癌主要是在肺上皮细胞的恶性病变中发生,因此其代谢出现紊乱可导致肺功能出现异常,同时,肺部疾病也会导致LPCAT功能出现紊乱,影响溶血磷脂酰胆碱的代谢[5-6]。此外,溶血磷脂酰胆碱在血磷脂酶D(PLD)的作用下转化成溶血磷脂酸(LPA)。研究表明,LPA是一个强力的刺激信号,能够导致细胞增殖,与肿瘤的发生发展密切相关[7-9]。本实验的结果显示,肺腺癌患者血浆中LPC含量明显降低,表明肺腺癌细胞增殖过程中由于处于高代谢状态,出现了LPCAT的异常表达,导致LPC含量降低[10]。
另一方面,溶血磷脂酰胆碱在溶血磷脂酶A1(LysoPLA1)的催化作用下水解生成脂肪酸,而本研究中肺腺癌患者血浆中的亚油酸、油酸、棕榈油酸的含量明显降低,也符合LPC代谢紊乱这一结果。有研究表明,肺癌患者血中脂肪酸含量的降低是由于肿瘤细胞在增殖过程中过度消耗的结果,或者脂肪酸合成酶受到肿瘤细胞抑制所引起[11]。
Decanoylcarnitine、Linoleylcarnitine、Octanoylcarnitine、Palmitoylcarnitine均属于酰基肉碱类物质,在乙酰辅酶A的作用下,由肉碱经酯化而生成,可促进长链脂肪酸转运至线粒体,经氧化后为细胞提供能量,也能够使短链脂肪酸由线粒体内转运至细胞液[12]。肉碱来自体外饮食摄入和自身合成,血中肉碱含量通常较为稳定,在本研究中,肺腺癌患者血浆中酰基肉碱含量明显降低,说明在肿瘤的发生发展过程中,由于机体的高能量消耗状态而使肉碱大量消耗,能量代谢发生紊乱,这一结果也与文献报道相一致[13]。同时,乳酸和丙酮酸在肺腺癌患者血浆中含量升高也可以说明肿瘤细胞能量代谢异常(糖酵解增强)的表现,符合肿瘤组织中Warburg效应存在的现象[14-15]。
肺腺癌患者血浆中次黄嘌呤的含量明显升高,也有文献报道在肺癌患者的尿液中,次黄嘌呤的含量显著增加,表明在肿瘤细胞增殖的过程中,核酸类成分合成与分解代谢均加快[16-17]。胆碱参与体内多种代谢通路,是乙酰胆碱、甜菜碱和磷脂的前体物质,有研究表明在chr15q25的一个位点上,其中包含烟碱乙酰胆碱受体亚单位基因CHRNA3、CHRNB4和CHRNA5的一个集群,与肺癌的前期发生密切相关,表明胆碱及其代谢产物可作为肺癌诊断的潜在生物标志物[18-19]。脯氨酸甜菜碱由脯氨酸和甜菜碱组成,而甜菜碱由胆碱合成,本试验中肺腺癌患者血浆中胆碱的含量明显减少,脯氨酸甜菜碱含量的显著升高,这一结果与文献报道相一致,表明肺腺癌患者胆碱相关的代谢通路出现了紊乱[13, 16]。
肺腺癌的代谢组学研究中,在病例选择方面大多数并未对男性患者和女性患者进行区别筛选,导致诸如睾酮(testosterone)、雄甾醇(androsterone)、孕烯醇酮(pregnenolone)等性激素相关物质出现在差异代谢产物中,干扰了试验结果[16, 20-21]。与女性患者不稳定的激素代谢相比,男性患者的代谢物谱相对稳定,而且肺腺癌患者中以男性居多,因此本试验选择男性患者为研究对象以减少误差。
本研究利用代谢组学方法,运用RRLC-Q-TOF高分辨质谱手段研究肺腺癌男性患者血浆中代谢产物的变化,通过单变量与多变量数理统计分析方法,在健康者与肺腺癌患者的血浆中鉴定了16个差异代谢产物,结合代谢通路的分析,表明肺腺癌患者血浆中溶血磷脂酰胆碱、酯酰肉碱、胆碱、脂肪酸、次黄嘌呤等物质代谢通路出现紊乱。RRLC-Q-TOF/MS的代谢组学方法可增进对肺腺癌疾病状态的了解,以期为肿瘤疾病的发病机制和早期筛查提供新的参考。
| [1] | Chen W, Zheng R, Baade PD, et al. Cancer statistics in China, 2015[J]. CA Cancer J Clin, 2016, 66(2): 115–32. DOI:10.3322/caac.21338 |
| [2] | Goldstraw P, Ball D, Jett JR, et al. Non-small-cell lung cancer[J]. Lancet, 2011, 378(9804): 1727–40. DOI:10.1016/S0140-6736(10)62101-0 |
| [3] | Jemal A, Center MM, DeSantis C, et al. Global Patterns of Cancer Incidence and Mortality Rates and Trends[J]. Cancer Epidemiol Biomarkers Prev, 2010, 19(8): 1893–907. DOI:10.1158/1055-9965.EPI-10-0437 |
| [4] | Sugimoto M, Wong DT, Hirayama A, et al. Capillary electrophoresis mass spectrometry-based saliva metabolomics identified oral, breast and pancreatic cancer-specific profiles[J]. Metabolomics, 2010, 6(1): 78–95. DOI:10.1007/s11306-009-0178-y |
| [5] | Li Z, Jiang H, Ding T, et al. Deficiency in Lysophosphatidylcholine Acyltransferase 3 Reduces Plasma Levels of Lipids by Reducing Lipid Absorption in Mice[J]. Gastroenterology, 2015, 149(6): 1519–29. DOI:10.1053/j.gastro.2015.07.012 |
| [6] | Uehara T, Kikuchi H, Miyazaki S, et al. Overexpression of Lysophosphatidylcholine Acyltransferase 1 and Concomitant Lipid Alterations in Gastric Cancer[J]. Ann Surg Oncol, 2016, 23(Suppl 2): S206–13. |
| [7] | Ray U, Roy SS, Chowdhury SR. Lysophosphatidic Acid Promotes Epithelial to Mesenchymal Transition in Ovarian Cancer Cells by Repressing SIRT1[J]. Cell Physiol Biochem, 2017, 41(2): 795–805. DOI:10.1159/000458744 |
| [8] | Mills GB, Moolenaar WH. The emerging role of lysophosphatidic acid in cancer[J]. Nat Rev Cancer, 2003, 3(8): 582–91. DOI:10.1038/nrc1143 |
| [9] | Brindley DN. Lipid phosphate phosphatases and related proteins: signaling functions in development, cell division, and cancer[J]. J Cell Biochem, 2004, 92(5): 900–12. DOI:10.1002/(ISSN)1097-4644 |
| [10] | Dong J, Cai X, Zhao L, et al. Lysophosphatidylcholine profiling of plasma: discrimination of isomers and discovery of lung cancer biomarkers[J]. Metabolomics, 2010, 6: 478–88. DOI:10.1007/s11306-010-0215-x |
| [11] | Kuhajda FP. Fatty acid synthase and cancer: new application of an old pathway[J]. Cancer Res, 2006, 66(12): 5977–80. DOI:10.1158/0008-5472.CAN-05-4673 |
| [12] | Pekala J, Patkowska-Sokola B, Bodkowski R, et al. L-carnitine-metabolic functions and meaning in humans life[J]. Curr Drug Metab, 2011, 12(7): 667–78. DOI:10.2174/138920011796504536 |
| [13] | Yang Q, Shi X, Wang Y, et al. Urinary metabonomic study of lung cancer by a fully automatic hyphenated hydrophilic interaction/RPLC-MS system[J]. J Sep Sci, 2010, 33(10): 1495–503. DOI:10.1002/jssc.v33:10 |
| [14] | Xu XD, Shao SX, Jiang HP, et al. Warburg effect or reverse Warburg effect? A review of cancer metabolism[J]. Oncol Res Treat, 2015, 38(3): 117–22. DOI:10.1159/000375435 |
| [15] | 牛艳洁, 江银玲, 许长江, 等. 代谢组学方法分析肺癌患者血清和尿液小分子代谢产物的初步研究[J]. 中国肺癌杂志, 2012, 15(4): 195–201. [ Niu YL, Jiang YL, Xu CJ, et al. Preliminary results of metabolite in serum and urine of lung cancer patients detected by metabolomics[J]. Zhongguo Fei Ai Za Zhi, 2012, 15(4): 195–201. ] |
| [16] | Cai X, Dong J, Zou L, et al. Metabonomic Study of Lung Cancer and the Effects of Radiotherapy on Lung Cancer Patients: Analysis of Highly Polar Metabolites by Ultraperformance HILIC Coupled with Q-TOF MS[J]. Chromatographia, 2011, 74: 391. DOI:10.1007/s10337-011-2077-4 |
| [17] | 陈英杰, 郑育芳, 王凝芳, 等. 尿中核苷检测在胃癌诊断中的意义[J]. 癌症, 2003, 22(5): 537–40. [ Chen YJ, Zheng YF, Wang NF, et al. Significance of urinary nucleosides in diagnosis of gastric carcinoma[J]. Ai Zheng, 2003, 22(5): 537–40. ] |
| [18] | Amos CI, Wu X, Broderick P, et al. Genome-wide association scan of tag SNPs identifies a susceptibility locus for lung cancer at 15q25.1[J]. Nat Genet,, 2008, 40(5): 616–22. DOI:10.1038/ng.109 |
| [19] | Schwartz AG, Cote ML, Wenzlaff AS, et al. Racial differences in the association between SNPs on 15q25.1, smoking behavior, and risk of non-small cell lung cancer[J]. J Thorac Oncol, 2009, 4(10): 1195–201. DOI:10.1097/JTO.0b013e3181b244ef |
| [20] | Wen T, Gao L, Wen Z, et al. Exploratory investigation of plasma metabolomics in human lung adenocarcinoma[J]. Mol Biosyst, 2013, 9(9): 2370–8. DOI:10.1039/c3mb70138g |
| [21] | An YJ, Cho HR, Kim TM, et al. An NMR metabolomics approach for the diagnosis of leptomeningeal carcinomatosis in lung adenocarcinoma cancer patients[J]. Intl J Cancer, 2015, 136(1): 162–71. DOI:10.1002/ijc.v136.1 |
 2017, Vol. 44
2017, Vol. 44


